Novas descobertas em biologia e imunologia de tumores, bem como em patologia molecular, impulsionaram rapidamente o desenvolvimento de anticorpos imunomoduladores e da chamada terapêutica “direccionada” [1]. Isto torna a terapia do melanoma avançado um desafio interdisciplinar. O tratamento moderno do melanoma avançado é, portanto, cada vez mais personalizado e baseia-se também no estado de mutação do tumor.
A ressecção cirúrgica continua a ser uma opção válida para metástases de órgãos solitários e, tal como a perfusão onerosa de membros com citostáticos e interferon-α, pode proporcionar uma sobrevivência a longo prazo sem recaídas. Várias quimioterapias, especialmente para melanomas sem mutação a serem alvo terapêutico, incluem por exemplo dacarbacina, vinblastina, cisplatina, taxol e bleomicina, ocasionalmente também tamoxifen como terapia hormonal. As taxas de resposta moderadas são à custa da toxicidade sem afectar significativamente a sobrevivência global. Temozolomida, um alquilano com uma taxa de resposta comparável à dacarbazina, pode frequentemente ser utilizado para metástases cerebrais devido à sua penetrabilidade do líquido cefalorraquidiano (LCR), embora menos de 10% dos doentes tenham uma resposta objectivável a esta terapia.
Imunoterapias
Devido à natureza antigénica e imunogénica do melanoma maligno, várias tentativas terapêuticas com substâncias imunomoduladoras foram feitas durante muito tempo. Além das vacinas peptídeas (frequentemente com oligonucleótido CpG adjuvante), estão a ser testadas citocinas (por exemplo IL-2 recombinante) e estão a ser desenvolvidos procedimentos de imunoterapia, tais como a transferência de células T adoptivas com TIL (linfócitos infiltrantes do tumor) e linfócitos do sangue periférico (PBL) ou células T “engendradas” geneticamente modificadas (“receptor de antigénio quimérico” e TCR). A alta dose de IL-2 (e a combinação de IL-2 com gp100) levou a remissões duradouras num pequeno número de pacientes, mas está principalmente estabelecida nos EUA [2]. Actualmente, estão a ser realizados vários estudos sobre a transferência de células T adoptivas e células modificadas por TCR, bem como bloqueios de pontos de controlo.
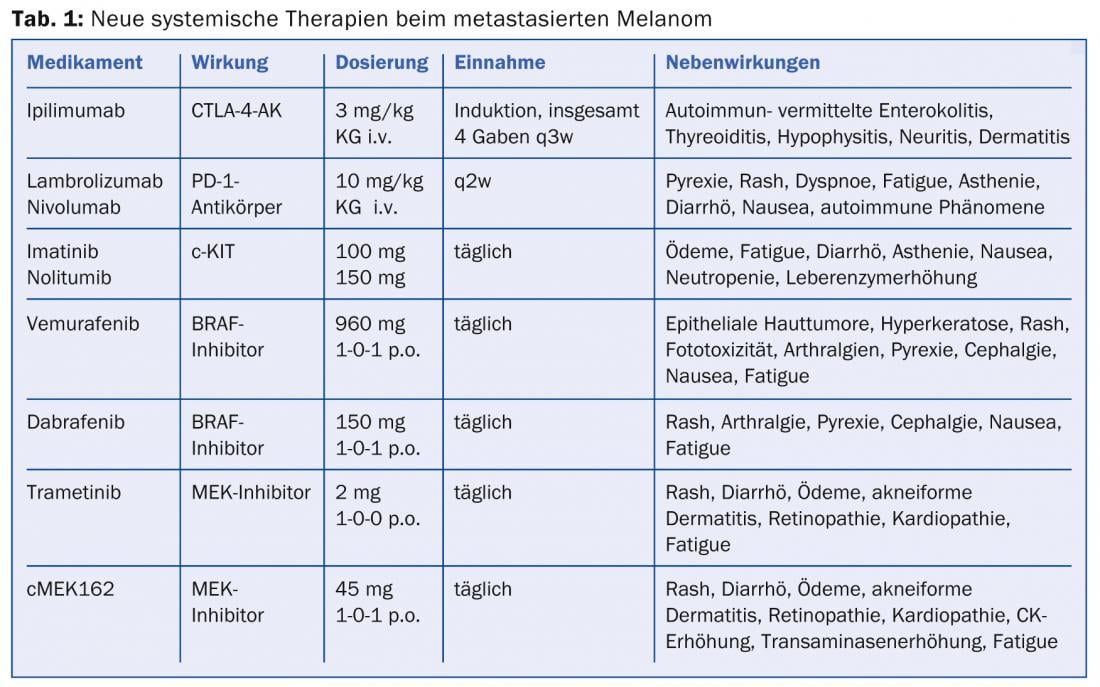
Anticorpos CTLA-4: O método de bloqueio do ponto de controlo (por exemplo, o bloqueio CTLA-4) permitiu novos alvos para a terapia imunomoduladora com sucesso. O linfócito T citotóxico associado ao antigénio 4 (CTLA-4) compete com o CD28 pela ligação às células que apresentam antigénio, levando à inibição dos sinais costimulatórios para a activação das células T. Contudo, quando o CTLA-4 é bloqueado por um anticorpo monoclonal IgG1 humano específico, como o ipilimumabe, é libertado um “travão” das próprias células de defesa do corpo e a resposta ao tumor mediado por células T é melhorada. O Ipilimumab (Yervoy®) foi o primeiro anticorpo dirigido contra o CTLA-4 a mostrar uma sobrevivência significativamente prolongada em combinação com uma vacina peptídeo gp100 (mediana de sobrevivência 10,1 vs. 6,4 monte do controlo da vacina) e foi aprovado pela EMA para o tratamento do melanoma metastático desde 2011 [3]. Do mesmo modo, a combinação de dacarbacina com o bloqueio CTLA-4 resultou em remissões completas e duráveis (taxa de sobrevivência de 3 anos aprox. 20%) e, apesar de uma baixa taxa de resposta (aprox. 15%), oferece pela primeira vez a perspectiva de sobrevivência a longo prazo. Como uma resposta ao ipilimumabe só pode ocorrer doze semanas após o início da terapia e o fármaco por vezes induz efeitos secundários imunológicos graves, é uma desvantagem que nenhum marcador de prognóstico tenha ainda possibilitado a selecção do paciente. Portanto, o diagnóstico precoce e a gestão rápida dos efeitos secundários da enterocolite autoimune comum, hepatite, tiroidite, hipofisite, neurite e dermatite são importantes (tab. 1).
Anticorpos PD-1 e PD-L1 (PD-1 e PD-L1-AK): Com o objectivo de optimizar ainda mais a resposta imunitária endógena contra células tumorais, foram recentemente desenvolvidos anticorpos que inibem o receptor inibitório “Morte Programada 1” (PD-1) na superfície das células T activadas. Se a proliferação das células T for inibida pela ligação da PD ligand-1 ao receptor PD-1 da célula T, os anticorpos anti-PD-1 lambrolizumab e nivolumab, que estão em ensaios desde 2013, podem inverter esta restrição da “fase effector”. Os resultados do estudo inicial com nivolumab mostraram uma resposta notável em 31% dos doentes com melanoma pré-tratados [4]. Semelhante ao bloqueio CTLA-4, os anticorpos anti-PD-1 também induzem remissões estáveis com significativamente menos efeitos secundários relacionados com a auto-imunidade. Além disso, uma resposta é geralmente vista algumas semanas após o início da terapia, com a expressão do ligando PD-1 na superfície da célula tumoral a ser suspeita como um possível biomarcador preditivo. Lambrolizumab, bem como os anticorpos directos contra o ligante PD-1 (PD-L1-AK) estão actualmente em testes clínicos. A utilização simultânea de anticorpos de bloqueio CTLA-4 e PD-1 também mostra efeitos sinérgicos.
Terapia orientada com base no estado de mutação
Os métodos moleculares e análises mutacionais revelaram várias interfaces para o tratamento inovador do melanoma metastático na última década. A mutação mais comum (aproximadamente 50%) em células de melanoma é uma mutação pontual no gene codificador do BRAF kinase-encoding. BRAF é uma kinase importante no MAPK (“Mitogen-Activated Protein Kinase”), sinalizando a via de sinalização e é parcialmente responsável pela proliferação e crescimento de células tumorais. A activação de mutações do gene BRAF V600 leva à sobre-activação desta via de sinalização, resultando num crescimento excessivo de células. As mutações de NRAS, uma kinase localizada a jusante do BRAF, também estão presentes em até 20% dos doentes com melanoma e, tal como o BRAF, causam um agravamento do prognóstico. Outra mutação bastante rara com consequências terapêuticas diz respeito ao KIT-c tirosina kinase, que ocorre predominantemente em melanomas de mucosa e acral. Os pacientes com uma mutação do c-KIT no exon 11 ou 13 respondem melhor ao tratamento com um inibidor de cinase do c-KIT como o imatinib ou nilotinib (ensaio TEAM). Os efeitos secundários comuns da terapia são edema, fadiga, diarreia, perda de apetite, náuseas, neutropenia e elevações de enzimas hepáticas.
Inibidores de BRAF
A chamada mutação V600 BRAF também foi identificada como terapêuticamente preditiva em 40-50% dos tumores. O primeiro inibidor de BRAF clinicamente testado, vemurafenibe (Zelboraf®), resultou em altas taxas de resposta de 5,6 respondedores completos em doentes com uma mutação V600E confirmada. 51,3% de remissões parciais e uma mediana de sobrevivência global de 13,2 meses (estudo BRIM-3 actualizado) [5]. A resposta clínica apresenta-se geralmente como redução rápida de tumores, embora meses depois a resistência se desenvolva frequentemente devido à reactivação da via MAPK ou à upregulação de vias alternativas.
Outro inibidor do BRAF é o dabrafenibe (Tafinlar®), que foi agora aprovado (ensaio BREAK-3) para tratamento de primeira linha em melanoma BRAF V600E não-reectável ou metastático [6,7]. O facto de uma resposta tumoral eficaz sob dabrafenibe ser observada numa grande proporção de doentes afectados durante uma média de oito meses melhora tanto a qualidade de vida como significativamente o tempo de sobrevivência esperado e representa uma nova experiência no tratamento do melanoma avançado. O estudo BREAK-MB também mostrou que os pacientes com metástases cerebrais experimentam pelo menos o dobro do tempo de sobrevivência, de resto muito curto, através do tratamento com dabrafenib. Os riscos da utilização de inibidores de BRAF incluem por vezes a recorrência de tumores cutâneos, pelo que os doentes devem ser monitorizados regularmente em relação a tais tumores. Outros efeitos secundários, tais como toxicidade da pele e das mucosas, infecções, ECG e alterações electrolíticas, e alterações do açúcar no sangue, podem exigir a interrupção da terapia. A precaução é também indicada em combinação com drogas que afectam a actividade enzimática CYP3A4 ou CYP2C8 e o pH gástrico, bem como a administração concomitante de warfarina ou digoxina.
Inibidores MEK
Como um dos locais centrais de comutação na cadeia de sinalização MAPK, e localizado a jusante do RAS-RAF, o MEK kinase (isoformas MEK1/2) pode ser activado quer por mutações quer por factores de crescimento autocrítico. O inibidor altamente selectivo MEK1/2 trametinib tem demonstrado melhorar significativamente a sobrevivência sem progressão (PFS: 4,8 vs 1,5 meses) e a sobrevivência global em doentes com uma mutação BRAF V600E ou V600K em comparação com a quimioterapia (estudo METRIC) [8]. Até agora, não foram observados carcinomas de células escamosas com trametinibe, como é frequentemente o caso dos inibidores de BRAF. Num outro estudo, o trametinib também mostrou um efeito eficaz nos melanomas com raras mutações BRAF [9]. Outro potente e selectivo inibidor de MEK1/2, cMEK162, encontra-se actualmente num ensaio de fase II. Os resultados iniciais do cMEK162 em doentes com melanoma não tratado com BRAF- ou melanoma com mutação NRAS mostraram resultados comparativamente bons para ambos os grupos (PFS 3,7 vs. 3,6 meses), de modo que pela primeira vez parece também possível uma abordagem terapêutica para doentes cujos tumores têm uma mutação NRAS [10].
Combinação de inibidores de BRAF e MEK
Devido ao desenvolvimento observado de resistência, a combinação de um inibidor BRAF com um inibidor MEK foi agora também testada num ensaio de fase I/II. Após estudo inicial de dose-finding, foram administrados dabrafenib 150 mg 2× diariamente a pacientes com uma mutação V600. mais trametinib 1 mg ou 2 mg diários. ou, para comparação, dabrafenib como monoterapia (150 mg 2× ao dia) [11]. A combinação com a dose mais elevada de trametinibe mostrou uma PFS significativamente prolongada de 3,6 meses em comparação com a monoterapia com dabrafenibe, com 41% dos pacientes no braço combinado ainda sem progressão após 12 meses. Os efeitos secundários mais frequentes (71%) foram a pirexia (38,5°) e arrepios com a combinação de altas doses (quadro 1) . Estes efeitos secundários ocorreram 66% menos frequentemente com a monoterapia dabrafenibe. Como se esperava, formaram-se menos tumores secundários da pele também sob terapia combinada.
PD Dr. med. Andreas Trojan
Literatura:
- Dummer R, et al: Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up; ESMO Guidelines Working Group. Ann Oncol 2012 Oct; 23 Suppl 7.
- Smith FO, et al: Tratamento do melanoma metastático usando interleucina-2 sozinho ou em conjunto com vacinas. Clin Cancer Res 2008; 14(17): 5610-5618.
- Hodi FS, et al: Melhoria da sobrevivência com ipilimumab em doentes com melanoma metastático. N Engl J Med 2010; 363(8): 711-723.
- Topalian SL, et al: Sobrevivência, remissão duradoura de tumores, e segurança a longo prazo em doentes com melanoma avançado que recebem nivolumab. J Clin Oncol 2014 Abr 1; 32(10): 1020-1030.
- McArthur GA, et al: Segurança e eficácia do vemurafenibe em BRAF(V600E) e BRAF(V600K) melanoma mutação-positivo (BRIM-3): acompanhamento prolongado de um estudo fase 3, aleatório, de rótulo aberto. Lancet Oncol 2014 Mar; 15(3): 323-332.
- Ascierto PA, et al: ensaio de Fase II (BREAK-2) do inibidor de BRAF dabrafenib (GSK2118436) em doentes com melanoma metastático. J Clin Oncol 2013 Set 10; 31(26): 3205-3211.
- Hauschild A, et al: Dabrafenib em melanoma metastático mutado BRAF: um ensaio controlado multicêntrico, aberto, fase 3 aleatorizado. Lancet 2012 Jul 28; 380(9839): 358-365.
- Flaherty KT, et al: Melhoria da sobrevivência com inibição de MEK no melanoma mutilado por BRAF. N Engl J Med 2012; 367(2): 107-114.
- Kim KB, et al: Estudo de Fase II do inibidor MEK1/MEK2 trametinib em pacientes com melanoma cutâneo metastático BRAF-mutante previamente tratado com ou sem um inibidor BRAF. J Clin Oncol 2013; 31(4): 482-489.
- Ascierto PA, et al: MEK162 para pacientes com melanoma avançado que albergam mutações NRAS ou Val600 BRAF: um estudo não aleatório, de fase 2 com rótulo aberto. Lancet Oncol 2013; 14(3): 249-256.
- Flaherty KT, et al: inibição combinada de BRAF e MEK no melanoma com mutações de BRAF V600. N Engl J Med 2012; 367(18): 1694-1703.
CONCLUSÃO PARA A PRÁTICA
- Com a aprovação de ipilimumab (Yervoy®) e vemurafenib (Zelboraf®), a investigação imunológica e molecular foi traduzida com sucesso para a clínica.
- O ipilimumab leva frequentemente a remissões duradouras com uma taxa de resposta significativamente mais baixa.
- Promissores no campo das substâncias imunomoduladoras, anticorpos anti-PD-1, bem como combinações de anticorpos anti-CTLA-4 e anti-PD-1, estão a ser clinicamente testados.
- Apesar do rápido início da acção e das elevadas taxas de resposta, os inibidores de BRAF desenvolvem frequentemente resistência, contra a qual combinações com, por exemplo, inibidores MEK poderiam ser utilizadas com sucesso no futuro.
UM RETENIR
- Com a autorização para comercializar ipilimumab (Yervoy®) e vémurafénib (Zelboraf®), a investigação imunológica e molecular foi aplicada com sucesso à clínica.
- L’ipilimumab permet des rémissions souvent prolongées avec un taux de réponse nettement plus faible.
- Dans le domaine des substances immunomodulatrices, les anticorps anti-PD-1 ainsi que des combinaisons d’anticorps anti-CTLA-4 et anti-PD-1 vont être testés cliniquement avec de grands espoirs.
- Malgré une apparition rapide de l’effet et des taux de réponse élevés, une résistance se développe fréquemment avec les inhibiteurs de BRAF, contre lesquelles des combinaisons par exemple avec des inhibiteurs de MEK pourront être utilisées efficacement à l’avenir.
PRÁTICA DA DERMATOLOGIA 2014; 24(3): 16-20