O antigénio de membrana específica da próstata (PSMA) desempenha um papel cada vez mais importante não só no diagnóstico do carcinoma da próstata. Com a radioligand 117Lutetium-PSMA-617, está também disponível uma nova opção terapêutica para o cancro da próstata resistente à castração avançada (mCRPC). Isto poderia em breve avançar para fases iniciais da doença e linhas de terapia.
A radioterapia usando 117Lutetium-PSMA-617foi de grande interesse em todos os grandes congressos de oncologia deste ano. Motivo suficiente para ter a sua própria sessão na Conferência do Consenso Avançado sobre o Cancro da Próstata (APCCC), que teve lugar a 9 de Outubro. Para além dos resultados dos estudos actuais, foram também discutidos nesta ocasião desafios clínicos e esperanças futuras – tanto na terapia baseada na PSMA como no diagnóstico.
PSMA: Pequenas tabelas de multiplicação
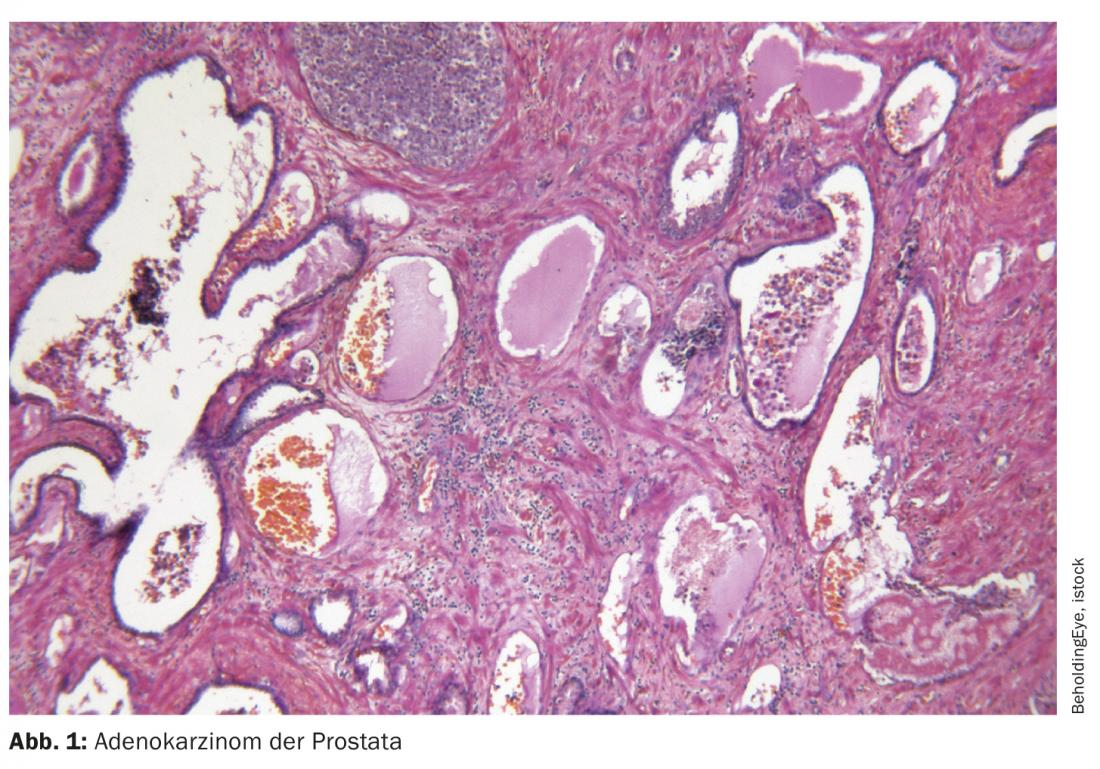
O antigénio de membrana específica da próstata (PSMA) é uma proteína transmembrana com a função enzimática de uma carboxipeptidase de folato hidrolase. Tem um domínio citoplasmático curto, um domínio extracelular longo e uma região transmembrana hidrofóbica [1,2]. O PSMA é particularmente – mas não exclusivamente – expresso em células epiteliais da próstata. No carcinoma da próstata, é encontrada uma sobreexpressão de até 1000 vezes em comparação com outros tipos de tecidos. A proteína serve muito provavelmente para a absorção de ácido fólico e glutamato, mas o seu papel exacto ainda não é claro. Para além da próstata, o PSMA é fisiologicamente encontrado nas glândulas lacrimais e salivares, bem como no intestino delgado. A expressão ligeiramente inferior é detectável no fígado, baço e gânglios parassimpáticos, o que por vezes pode levar a resultados falso-positivos em imagens baseadas em PSMA [3]. Além disso, uma vez que os traçadores utilizados são excretados renalmente, a absorção nos rins, ureteres e bexiga é inevitável.
Existem acentuadas diferenças intra e interindividuais na expressão PSMA, que são de grande importância na clínica. Por um lado, sem o PSMA falta o alvo terapêutico, por outro lado, as lesões negativas de PSMA não podem ser detectadas em imagens baseadas em PSMA. Até 10% dos doentes não mostram qualquer expressão ou mostram apenas uma expressão mínima. Em geral, isto é mais elevado no mCRPC do que no cancro de próstata sensível à castração (CSPC). Níveis mais elevados de PSMA estão associados a uma pontuação mais elevada de Gleason e a uma sobrevivência global mais fraca [4]. Muitas vezes, alguns focos num paciente expressam PSMA enquanto outros permanecem invisíveis na PSMA PET – um desafio clínico.
O PSMA foi reconhecido como um potencial alvo terapêutico e diagnóstico há mais de 30 anos. A primeira aprovação da FDA de um anticorpo monoclonal dirigido contra a PSMA seguiu-se já em 1996: ProstaScint®. No entanto, isto revelou-se pouco fiável nos estudos clínicos, uma vez que se liga ao domínio citoplasmático da PSMA e, portanto, só se instala em células cancerosas apoptóticas. As abordagens mais recentes visando o PSMA baseiam-se, portanto, no ataque ao domínio extracelular da proteína transmembrana.
A interacção do receptor de androgénio com o PSMA é interessante. Assim, a terapia de privação de androgénio (ADT) conduz normalmente a uma expressão aumentada da PSMA [5,6] tanto em casos sensíveis à castração como em casos resistentes à castração. Algumas metástases só aparecem na imagem PSMA depois da ADT. Devido à resposta tumoral, o carcinoma da próstata sensível à castração (CSPC) resulta em efeitos opostos de ADT na imagem de PSMA: o número de células tumorais diminui, mas estas mostram uma expressão de PSMA mais elevada.
PSMA em imagem
Entretanto, o PSMA-PET representa um método de imagem robusto com um processo bem definido e uma boa disponibilidade global. Existem directrizes correspondentes desde 2017, e espera-se uma actualização em 2022 [7]. No entanto, a utilização óptima não está conclusivamente esclarecida e existem alguns desafios clínicos. Entre outras coisas, há um grande número de traçadores que ainda não foram adequadamente comparados uns com os outros (visão geral 1) . Algumas comparações com alguns pacientes mostram resultados semelhantes para as diferentes substâncias [8,9]. Os dados mais robustos existem para a comparação entre 18F-PSMA-1007e 68Ga-PSMA-11, presumivelmente porque estes traçadores são os mais amplamente utilizados. Neste cenário, 18F-PSMA-1007demonstrou produzir mais falsos positivos. As lesões ósseas em particular não podem ser detectadas de forma fiável com 18F-PSMA-1007, devido à acumulação fisiológica na medula óssea. Assim, especialmente com este marcador, devem ser utilizadas imagens adicionais como a ressonância magnética ou a tomografia computorizada para interpretar as imagens. Por outro lado, a 18F-PSMA-1007provou ser extremamente útil na avaliação das condições locorregionais [10]. Em termos de sensibilidade, não parece haver qualquer desvantagem de um traçador [11]. O resultado final é que diferentes traçadores são provavelmente mais adequados dependendo do cenário – um campo em que ainda há muito a investigar.

Para além da falta de caracterização precisa de vários traçadores, o PSMA-PET também coloca alguns outros desafios, nomeadamente de natureza financeira. Independentemente da substância utilizada, a sensibilidade do método nunca é de 100%. Além disso, a avaliação fiável das imagens exige uma certa experiência – experiência que não pode ser tomada como certa, tendo em conta a novidade. O PSMA não é de forma alguma específico do cancro, da próstata ou mesmo do cancro da próstata. A expressão também se encontra, por exemplo, no linfoma, carcinoma pulmonar e adenocarcinoma do cólon, bem como em várias inflamações activas tais como a doença de Crohn ou COVID-19. O significado clínico da imagem baseada em PSMA e o seu impacto na prática clínica também permanecem por esclarecer no futuro.
Isto levanta a questão candente de saber se o PSMA-PET é de facto a melhor modalidade para uma encenação fiável. Esta questão é difícil de esclarecer, especialmente porque a imagem convencional tem sido utilizada para avaliar a fase tumoral em quase todos os ensaios clínicos até à data e faltam comparações aleatórias. Substituir ou complementar a imagem clássica com PSMA-PET poderia ter um impacto duradouro e difícil de estimar na gestão clínica, incluindo a terapia e, portanto, nos resultados. Se, por exemplo, metástases anteriormente não detectadas forem detectadas pelo método, não há menos perigo de tratamento excessivo. Por outro lado, há provavelmente pacientes que beneficiariam de uma avaliação mais precisa da sua fase da doença e, portanto, de uma intensificação do tratamento. O objectivo deve continuar a ser a utilização de imagens para identificar os pacientes que realmente necessitam de um aumento de intensidade e assim melhorar os seus resultados clínicos.
Para ilustrar esta questão, foram apresentados alguns números impressionantes na APCCC. Assim, 98% dos pacientes com CRPC que são considerados M0 no estadiamento convencional têm lesões no PSMA-PET, dos quais 24% são locais e 76% são N1/M1 [12]. Globalmente, cerca de metade dos pacientes M0 originais tornam-se assim pacientes M1 – um aumento com consequências. Porque embora as opções de tratamento sejam semelhantes em CRPC metastático e não metastático, de acordo com o estado actual de aprovação, a opção de apalutamida ou darolutamida é perdida [13]. Com novas modalidades de imagem, a gestão clínica deve ser sempre questionada e adaptada – um processo que está actualmente em pleno andamento no cancro da próstata. Não há dúvida de que o PSMA-PET é superior ao CT convencional e à colina PET, que esteve em uso até 2016, em termos de especificidade e sensibilidade. No entanto, o valor clínico continua por esclarecer, de forma óptima no âmbito de ensaios clínicos aleatórios.
Radioterapia baseada em PSMA
Por mais controverso que o uso de PSMA-PET possa ser no estadiamento, é igualmente claro na selecção de doentes para terapia utilizando radioligandas dirigidas por PSMA. Como tal, o 117Lutetium-PSMA-617já está acessível em centros especializados na Suíça como parte de um programa de uso compassivo, embora ainda não tenha sido obtida a aprovação do Swissmedic [13]. Até agora, o tratamento é utilizado após a falha de um agente alvo AR e de um taxano (docetaxel) no mCRPC. A sequência terapêutica ideal com cabazitaxel ainda não está clara e deve ser avaliada individualmente. Devido à natureza diferente da terapia, tem um elevado potencial para complementar de forma óptima as opções existentes. Além disso, com uma taxa de expressão de cerca de 87% no mCRPC, o PSMA é um alvo quase ubíquo, incluindo biomarcadores para resposta. O tratamento PSMA poderia, portanto, ser uma opção para um grande número de doentes no futuro – e a identificação de doentes adequados não é particularmente complicada.
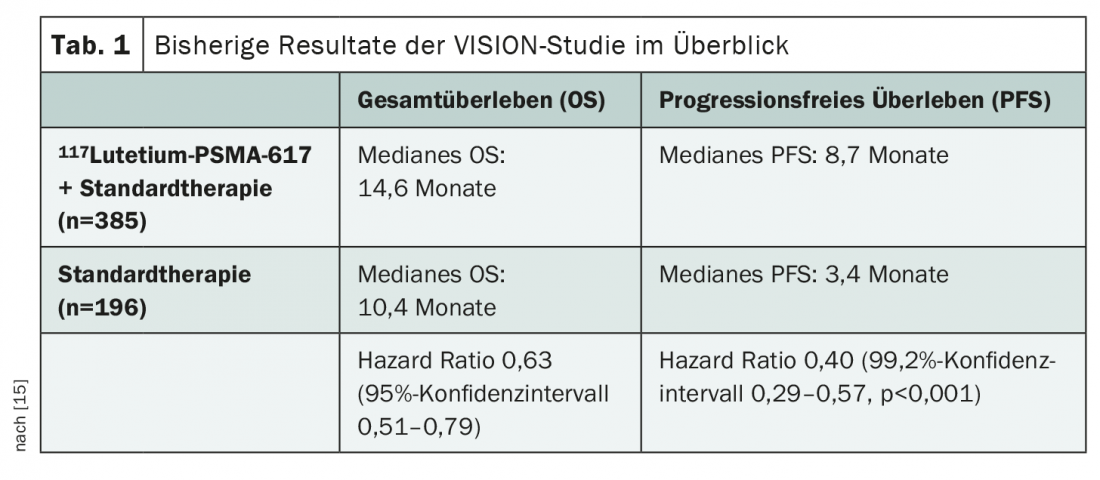
A maior parte dos dados disponíveis até agora no 117Lutetium-PSMA-617provém do estudo VISION recentemente publicado [14,15] apresentado em vários congressos. Isto investiga a adição de 117Lutetium-PSMA-617à terapia padrão em mCRPC após pré-tratamento com pelo menos um bloqueador de receptores de androgénio e um regime de quimioterapia à base de taxano no estabelecimento de 68Gallium-PSMA-11 PET/CTpositivo. Já foram demonstrados benefícios significativos na sobrevivência global (OS) e na sobrevivência sem progressão (PFS) em todos os subgrupos (Quadro 1) . Dada a eficácia comprovada da terapia 117Lutetium-PSMA-617neste contexto, levantam-se agora várias outras questões. Por exemplo, o momento ideal para o tratamento ainda precisa de ser clarificado. O 117Lutetium-PSMA-617deve ser utilizado antes, com ou após a quimioterapia? E o tratamento por radioligand também poderia ser utilizado em fases iniciais da doença, por exemplo em CSPC ou em casos não-metastáticos? Qual é a situação relativamente às opções terapêuticas subsequentes? Faltam também dados fiáveis sobre a avaliação da toxicidade a longo prazo, em particular a supressão da medula óssea, até à data. É provável que esta questão venha cada vez mais à tona com testes em fases iniciais e mais precoces da doença e linhas de terapia.
Alguns estudos estão actualmente a investigar a sequência óptima de tratamento usando 117Lutetium-PSMA-617. Por exemplo, o ensaio PSMAfore está em curso, testando a eficácia da radioligand em mCRPC após um bloqueador de receptores andrógenos mas antes da quimioterapia. Uma aplicação ainda anterior está a ser investigada no ensaio PSMAddition, que está a testar a adição de 117Lutetium-PSMA-617ao tratamento padrão em mCSPC de primeira linha. Mesmo no cenário neoadjuvante, está actualmente em curso um ensaio: LuTectomia. Embora o benefício do mCRPC após a quimioterapia baseada em taxoterapia seja agora considerado comprovado, a sua utilização em linhas anteriores de terapia e em fases anteriores da doença será vista ao longo dos próximos anos.
A selecção dos pacientes como chave?
<Os peritos da APCCC atribuíram o facto de apenas ter sido alcançada uma redução de 50% no PSA na maioria dos pacientes do estudo VISION com a terapia 117-lutetium-PSMA-617à selecção inadequada de pacientes até à data, entre outras coisas. Provavelmente nem todos os pacientes incluídos beneficiaram do tratamento adicional. Isto pode indicar que, para além do PSMA-PET, outros métodos de selecção de doentes devem ser utilizados para alcançar uma eficácia clínica óptima. Estes poderiam ser de natureza genética, mas um FDG-PET adicional é também uma opção.
O perfil genético do cancro da próstata é extremamente heterogéneo; por exemplo, a doença metastática de novo apresenta frequentemente um perfil genético menos favorável com resultados mais fracos [16]. Estes pacientes respondem menos bem a uma série de terapias, o que também pode ser verdade para o tratamento 117Lutetium-PSMA-617. No entanto, há uma falta de dados fiáveis sobre esta matéria – uma razão para determinar o perfil genético no âmbito dos estudos clínicos. Assim, no futuro, o perfil genético poderia também ser tido em conta nas decisões de tratamento, para além da expressão PSMA.
Também não é claro se o FDG-PET deve ser utilizado para a selecção de doentes, para além da PSMA-. Isto não foi feito no estudo VISION [14] – ao contrário do estudo TheraP, que comparou o tratamento com 117Lutetium-PSMA-617com cabazitaxel no mCRPC [17]. O FDG-PET adicional levou, por um lado, a mais exclusões de estudo – e, por outro lado, a uma maior taxa de resposta ao tratamento 117Lutetium-PSMA-617 de66% (VISÃO: 46%). Isto deve-se provavelmente ao facto de que os pacientes que tinham metástases de PSMA-expressoras, bem como aqueles sem expressão correspondente, puderam ser identificados e excluídos graças à FDG-PET. Para além de um benefício potencial na selecção de doentes, a realização de FDG-PET também traz vantagens na caracterização mais precisa da doença e na optimização dos locais de amostragem de biopsias. Por exemplo, os sintomas causados por metástases podem ser melhor atribuídos e tratados correctamente numa fase inicial. Em geral, a heterogeneidade intraindividual frequentemente existente do carcinoma metastático da próstata representa uma limitação importante para o tratamento com radioligans. Isto pode ser detectado por um FDG-PET adicional.
Sonhos do futuro: de combinações e novos ingredientes activos
O desenvolvimento do 117Lutetium-PSMA-617lança as bases para uma nova opção terapêutica no cancro da próstata. Estes terão de ser examinados mais de perto nos próximos anos e caracterizados em termos do seu potencial. Ainda é necessário encontrar as melhores combinações terapêuticas, bem como sequências. Além disso, existem abordagens alternativas de tratamento que também visam o PSMA.
Abre-se um vasto campo de investigação na área das possíveis terapias de combinação com 117Lutetium-PSMA-617. Combinações adequadas de medicamentos poderiam, entre outras coisas, impedir a resistência devido à heterogeneidade da doença. Combinações com enzalutamida na primeira linha (ENZA-P), e olaparibe (LuPARP) e pembrolizumab (PRINCE) na segunda linha estão actualmente a ser investigadas em mCRPC. E as coisas também estão a mudar no que diz respeito a possíveis terapias subsequentes. Aqui, o foco é particularmente em α-emissores. Por um lado, estes poderiam ser utilizados após o emissor do β-emissor 117Lutetium-PSMA-617, e por outro lado, poderiam ser uma alternativa mais eficaz e mais suave a este. Isto porque os emissores do α causam uma maior transferência de energia a um alcance mais curto. Actualmente, as substâncias 225Act-PSMA-617, 225Act-J591e 227Thorium-PSMA-TTCestão a ser investigadas em ensaios da fase I.
As classes de medicamentos alternativos que visam a PSMA são células CAR-T e anticorpos bisespecíficos (BiTE, Bispecific T-Cell Engagers) tais como o acapatamab. Actualmente, estes estão ainda na sua infância e o seu desenvolvimento está também a revelar-se difícil, dado o estádio avançado da doença com grande vulnerabilidade da população de doentes. No entanto, há primeiros resultados promissores dos ensaios da fase I com taxas de resposta de cerca de 34% [18]. Continuamos curiosos.
Fonte: PSMA em diagnóstico e terapia. Sessão 2, Conferência Avançada de Consenso sobre o Cancro da Próstata (APCCC) online, 09.10.2021.
Literatura:
- Rajasekaran AK, Anilkumar G, Christiansen JJ: O antigénio de membrana específica da próstata é uma proteína multifuncional? Am J Physiol Cell Physiol. 2005; 288(5): C975-981.
- Sengupta S, et al: Comparação de ligandos de antigénio de membrana específica da próstata na investigação de tradução clínica para o diagnóstico do cancro da próstata. Representante do cancro (Hoboken). 2019; 2(4): e1169.
- Hofman MS, et al: Prostate-specific Membrane Antigen PET: Clinical Utility in Prostate Cancer, Normal Patterns, Pearls, and Pitfalls. Radiografias. 2018; 38(1): 200-217.
- Paschalis A, et al.: Heterogeneidade do Antigénio de Membrana Específica da Próstata e Defeitos de Reparação do ADN no Cancro da Próstata. Eur Urol. 2019; 76(4): 469-478.
- Bakht MK, et al: Influence of Androgen Deprivation Therapy on the Uptake of PSMA-Targeted Agents: Emerging Opportunities and Challenges. Nucl Med Mol Imaging. 2017; 51(3): 202-211.
- Hope TA, et al: 68Ga-PSMA-11 PET Imaging of Response to Androgen Receptor Inhibition: First Human Experience. J Nucl Med. 2017; 58(1): 81-4.
- Fendler WP, et al: (68)Ga-PSMA PET/CT: Joint EANM and SNMMI procedure guideline for prostate cancer imaging: version 1.0. Eur J Nucl Med Mol Imaging. 2017; 44(6): 1014-1024.
- Giesel FL, et al: Comparação Intraindividual de (18)F-PSMA-1007 e (18)F-DCFPyL PET/CT na Avaliação Prospectiva de Pacientes com Carcinoma da Próstata Recentemente Diagnosticado: Um Estudo Piloto. J Nucl Med. 2018; 59(7): 1076-80.
- Dietlein M, et al.: Comparação de [(18)F]DCFPyL e [(68)Ga]Ga-PSMA-HBED-CC para Imagens PSMA-PET em Pacientes com Cancro da Próstata Relapsado. Mol Imaging Biol. 2015; 17(4): 575-584.
- Dietlein F, et al.: Comparação intra-individual de (18)F-PSMA-1007 com ligandos de PSMA Renally Excreted para imagens PET de PSMA em doentes com cancro da próstata recauchutado. J Nucl Med. 2020; 61(5): 729-734.
- Rauscher I, et al.: Comparação Parcial de (68)Ga-PSMA-11 PET/CT e (18)F-PSMA-1007 PET/CT: Frequência de Fossas e Eficácia de Detecção na Recidiva Bioquímica após Prostatectomia Radical. J Nucl Med. 2020; 61(1): 51-57.
- Fendler WP, et al: Antigénio de Membrana Específico da Próstata Antigénio de Emissões de Ligand Positrões em Homens com Cancro da Próstata Resistente à Castração Não-Metastática. Clin Cancer Res. 2019; 25(24): 7448-7454.
- Informação sobre drogas Swissmedic: www.swissmedicinfo.ch (último acesso 21.10.2021).
- Sartor O, et al: Lutetium-177-PSMA-617 para o cancro da próstata resistente à castração metástática. N Engl J Med. 2021; 385(12): 1091-1103.
- Morris MJ, et al: Estudo de fase III do lutécio-177-PSMA-617 em doentes com cancro da próstata resistente à castração metastática (VISION). Reunião Anual ASCO 2021, Sessão Plenária Genitourinary Cancer – Prostate, Testicular, and Penile, Abstract #LBA4.
- Deek MP, et al: The Mutational Landscape of Metastatic Castration-sensitive Prostate Cancer: The Spectrum Theory Revisited. Eur Urol. 2021; 80(5): 632-640.
- Hofman MS, et al: [(177)Lu]Lu-PSMA-617 versus cabazitaxel em doentes com cancro da próstata resistente à castração metastática (TheraP): um ensaio aleatório, de rótulo aberto, fase 2. Lanceta. 2021; 397(10276): 797-804.
- Einsele H, et al.: The BiTE (bispecific T-cell engager) platform: Development and future potential of a targeted immuno-oncology therapy across tumour types. O cancro. 2020; 126(14): 3192-3201.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(6): 26-28 (publicado 8.12.21, antes da impressão).