Os três pilares básicos da terapia para pacientes com fibrilação atrial (FA) são reduzir o risco de AVC, prevenir a taquicardomiopatia e melhorar a qualidade de vida através do alívio dos sintomas. A ablação por cateter da fibrilação atrial é superior à terapia antiarrítmica em termos de controlo do ritmo e qualidade de vida [1,2]. As directrizes actuais deixam relativamente muito espaço de manobra na indicação de isolamento das veias pulmonares. Os doentes sem doença cardíaca estrutural com FA ou FA paroxística sintomática persistente há menos de um ano têm a melhor hipótese de sucesso. Quanto mais cedo no decurso da doença o tratamento tiver lugar, mais elevadas serão as taxas de sucesso da ablação dos cateteres. Graças aos grandes avanços tecnológicos, as taxas de complicações nos centros experientes são muito baixas, de modo que se pode falar de um procedimento muito seguro.
Com uma prevalência de 1,5-2%, a fibrilação atrial é a arritmia cardíaca mais comum na prática clínica. A prevalência aumenta com a idade. Entre os jovens de 80 anos, mais de 8% são afectados [3,4], os homens um pouco mais frequentemente do que as mulheres. A fibrilação atrial idiopática não associada a cardiopatia estrutural é relatada como tendo uma prevalência de até 30% [5].
Dependendo da duração, a fibrilação atrial é dividida em paroxística (≤48 horas), persistente (>7 dias), persistente de longa duração (>1 ano) e fibrilação atrial permanente. Neste último caso, a perturbação do ritmo é aceite e o controlo do ritmo já não é procurado. Semelhante à pontuação da NYHA, a carga de arritmia é atribuída a uma pontuação de sintomas (EHRA I-IV).
A mortalidade dos pacientes com fibrilação atrial é aumentada por um factor de cerca de 1,5 nos homens e 1,9 nas mulheres. Este foi o resultado de análises do Estudo de Framingham. Por um lado, existe um risco aumentado de insuficiência cardíaca com um risco triplicado de descompensação cardíaca; por outro, existe um risco quíntuplo de insulto cerebrovascular ou embolia sistémica. Utilizando a pontuação CHA2DS2-VASc, o risco de AVC pode ser estimado individualmente e de forma um pouco mais precisa.
Opções de tratamento e indicação para controlo do ritmo
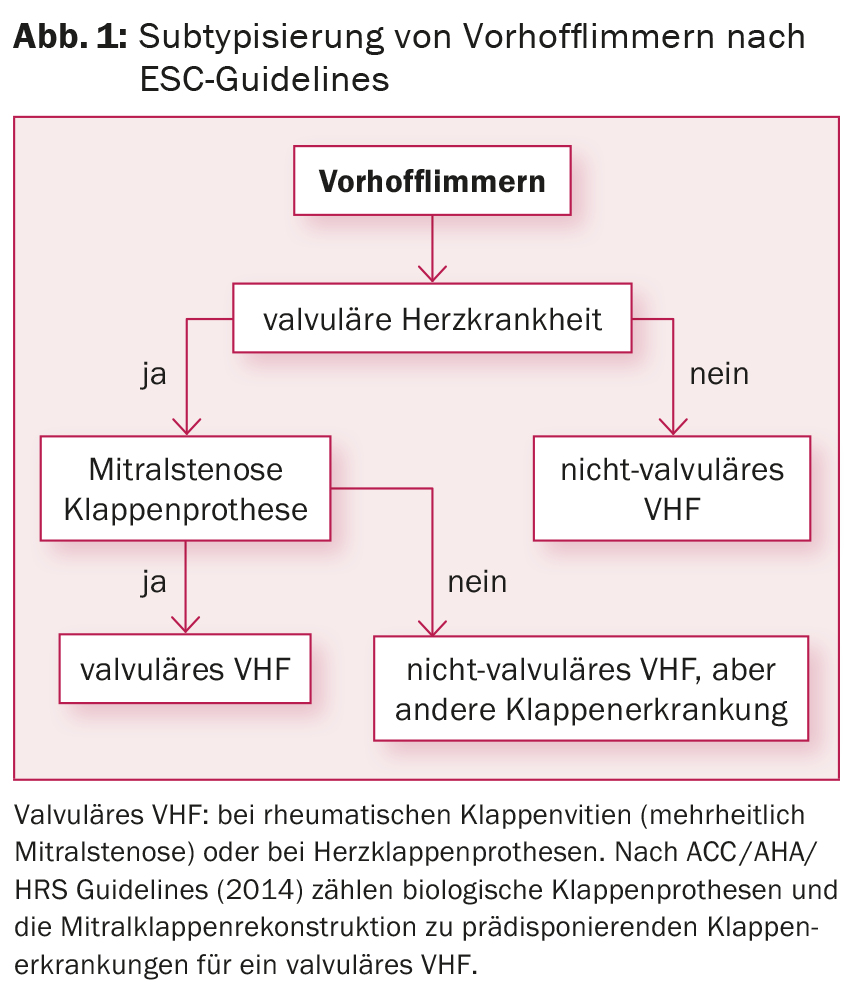
Tendo em conta a estratificação do risco por meio do escore CHA2DS2-VASc, a anticoagulação oral (OAC) com Marcoumar® ou, no caso de fibrilação atrial não-valvar (fig. 1), com um dos novos anticoagulantes (conhecidos como “anticoagulantes”) deve ser iniciada em todos os pacientes com ponto ≥1, independentemente da subtilografia da fibrilação atrial e também no caso do controlo do ritmo. anticoagulantes orais directos [DOAK], por exemplo rivaroxaban, dabigatran, apixaban, edoxaban). Para reduzir os sintomas e prevenir a taquicardiomiopatia (com taxas sustentadas >120 bpm), também se deve procurar o controlo das taxas. Estudos até à data não mostraram diferenças de morbilidade e mortalidade quando se compara o controlo da frequência com o controlo do ritmo [6]. Se a terapia medicamentosa não for bem sucedida, a ablação do nó AV com inserção de marcapasso permanente é uma opção possível para o controlo da taxa, especialmente se estiverem presentes comorbilidades.
O controlo do ritmo é essencial na FA paroxística e persistente, especialmente em doentes sintomáticos, apesar do controlo rigoroso da taxa. Podem ser utilizados dois métodos básicos: a terapia medicamentosa a longo prazo com medicamentos antiarrítmicos e a abordagem invasiva utilizando procedimentos de ablação. Na situação aguda de instabilidade hemodinâmica, isto também pode ser conseguido por electroconversão (ECV). Se for preferível o tratamento rítmico ao controlo da frequência, este deve ser iniciado o mais rapidamente possível após o diagnóstico, uma vez que se torna mais difícil manter o ritmo sinusal com o aumento da duração da FA [7,8].
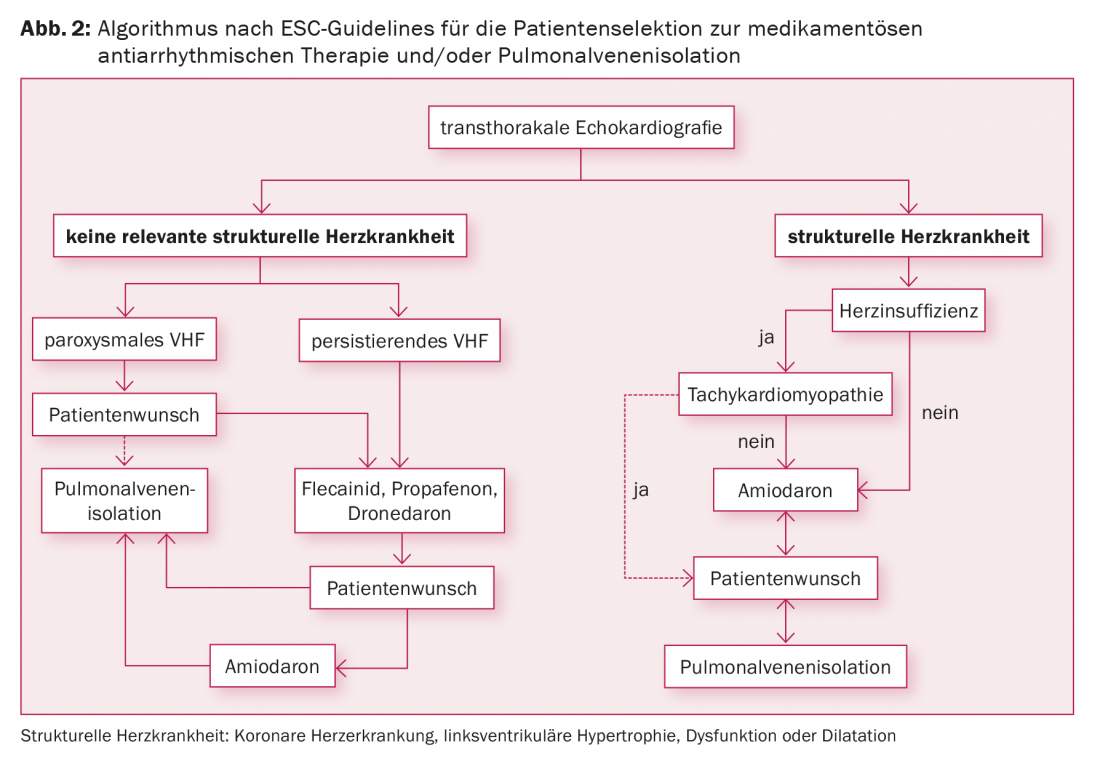
As indicações para o isolamento das veias pulmonares incluem fibrilação atrial sintomática apesar da terapia antiarrítmica, fibrilação atrial sintomática e o desejo do paciente de não ter de tomar medicamentos antiarrítmicos, e fibrilação atrial sintomática em combinação com contra-indicações a medicamentos antiarrítmicos (Fig. 2) . Faltam actualmente dados mostrando a prevenção de eventos cardioembólicos por ablação de cateteres. O desejo de parar a CEM não é, portanto, uma indicação de isolamento das veias pulmonares de acordo com os estudos actuais, uma vez que a CEM deve ser continuada mesmo após a ablação bem sucedida, dependendo da pontuação CHA2DS2 VASc.
Isolamento das veias pulmonares
Desde o final dos anos 90, sabe-se que mais de 90% dos focos ectópicos (os chamados desencadeadores) para o desenvolvimento da fibrilação atrial são localizados nas veias pulmonares. Inicialmente, foram feitas tentativas para eliminar estes focos activos por ablação local directa. No entanto, isto não é raro, levou à estenose das veias pulmonares. Sabe-se hoje que o isolamento das veias na região onde se juntam ao átrio esquerdo (antro) é suficiente e mais suave. Com base nestas descobertas, o isolamento das veias pulmonares estabeleceu-se como uma estratégia terapêutica invasiva através do desenvolvimento bem sucedido de várias técnicas de ablação e mapeamento com melhorias consecutivas em termos de eficácia e segurança ao longo dos últimos 10-15 anos.
Como regra geral, os pacientes entram no hospital na véspera do exame. No mesmo dia, é realizada uma ecocardiografia transoesofágica e, se necessário, um tomograma computadorizado ou uma ressonância magnética do coração. Estas imagens podem facilitar uma reconstrução tridimensional do átrio esquerdo.
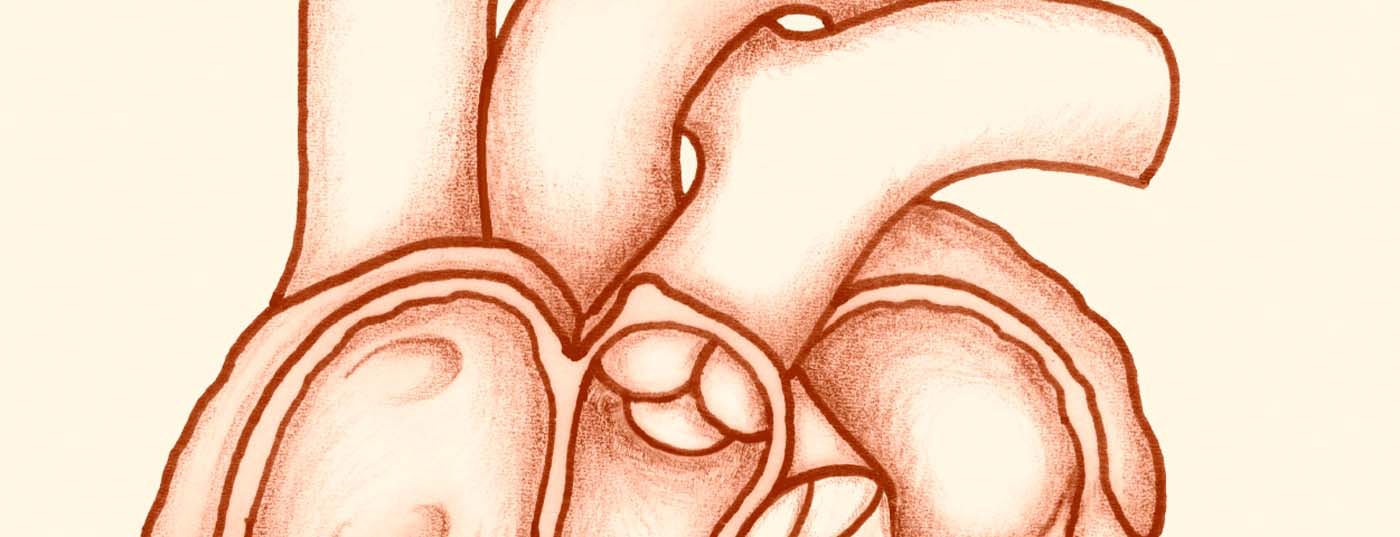
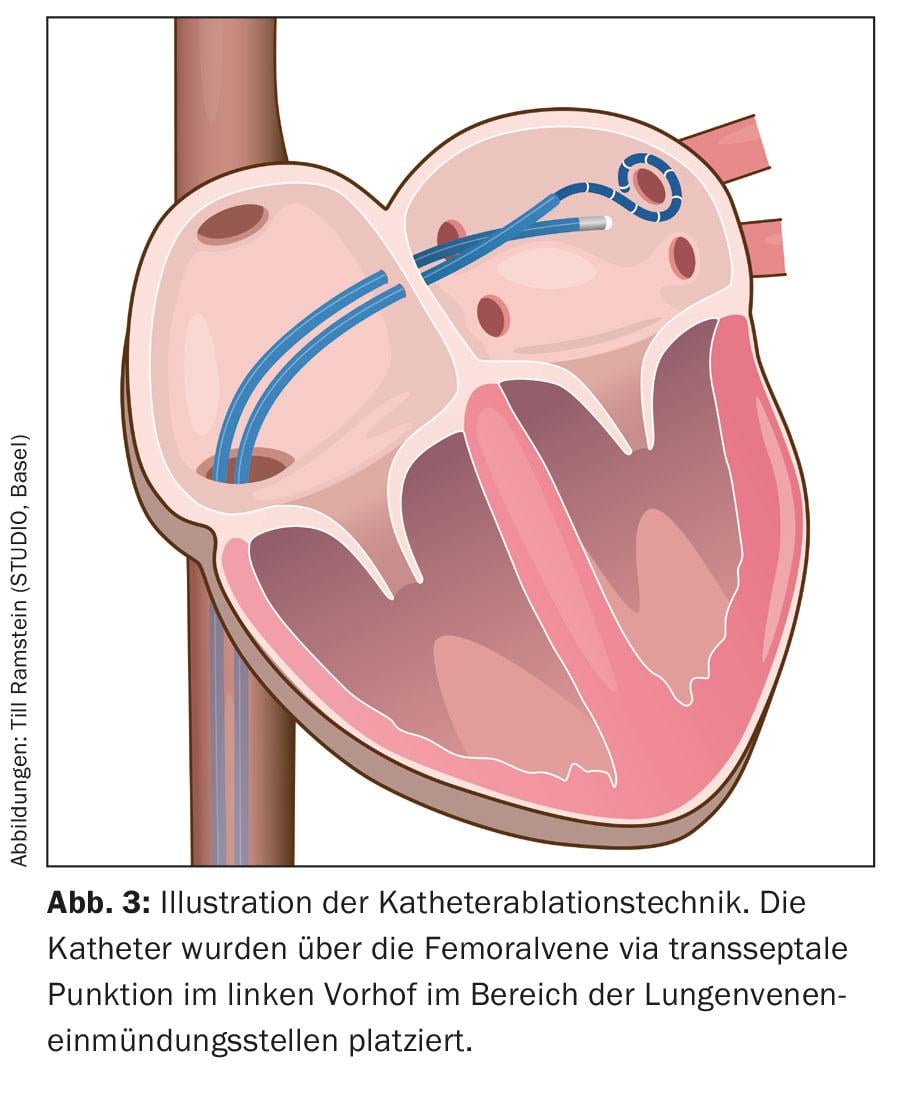
Sob analgesia (anestesia geral não é obrigatória), vários cateteres são inseridos através de um acesso venoso na virilha no átrio direito através da veia cava inferior e finalmente colocados no átrio esquerdo através de uma punção transseptal (Fig. 3) .
Estes cateteres são utilizados para uma reconstrução tridimensional da área de ablação, o chamado mapeamento 3D (Fig. 4). Além dos métodos baseados em raios X que utilizam cateteres cartográficos puros para visualizar a ligação entre as veias pulmonares e o átrio esquerdo, os chamados “métodos de mapeamento electroanatómico”, que utilizam um sistema tridimensional e não principalmente baseado em raios X, foram integrados no procedimento.
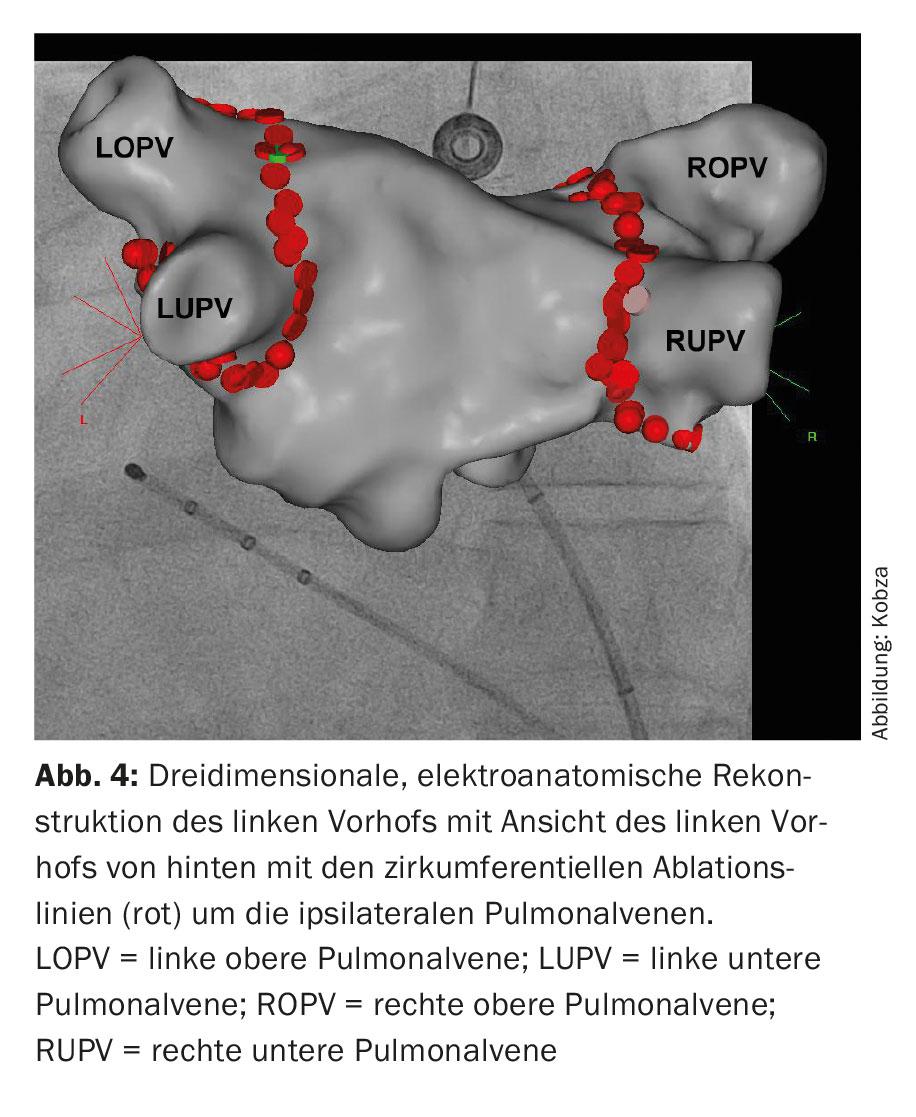
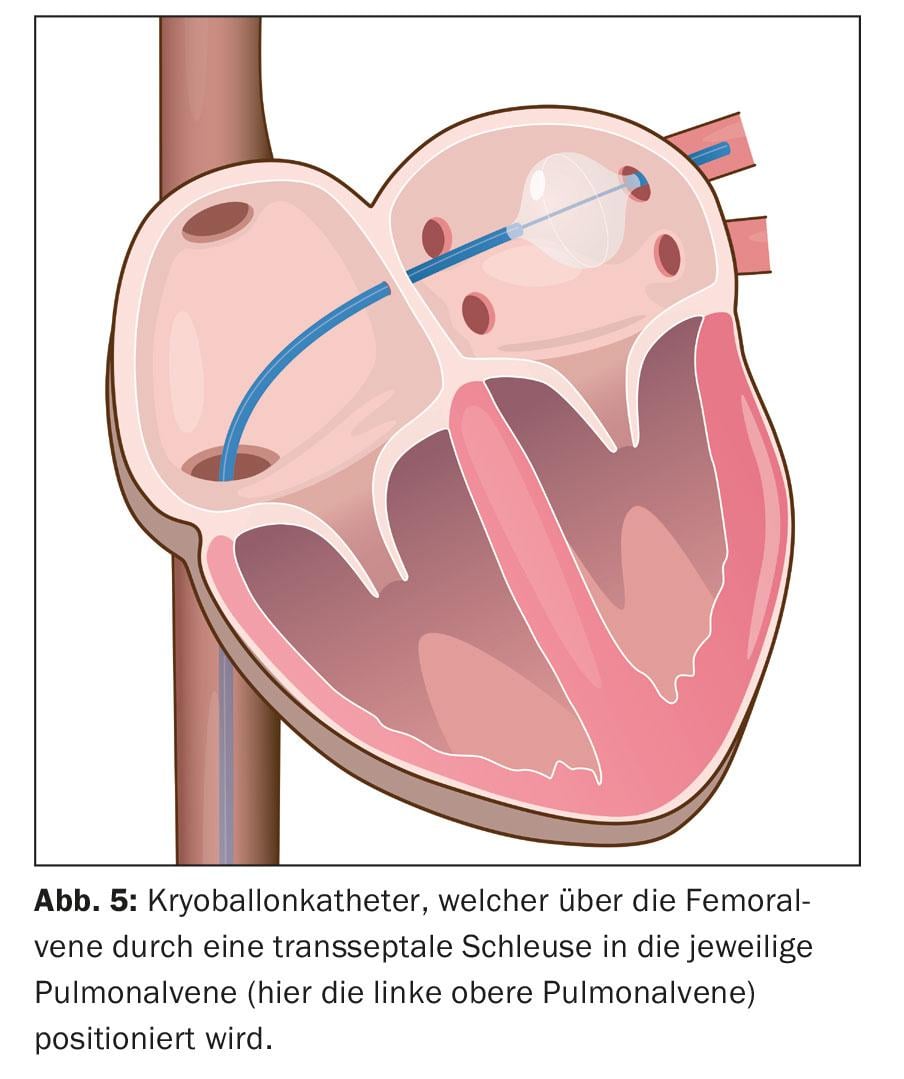
Aqui é possível a integração de imagens da anatomia atrial esquerda reconstruída por TC e ressonância magnética. Posteriormente, a ablação é efectuada. A ablação circunferencial ponto-a-ponto é realizada em pares em torno dos óstios das veias pulmonares ipsilaterais utilizando energia de radiofrequência, uma corrente alternada de alta frequência (“wide area circumferential radiofrequency catheter ablation”, WACA) (Fig. 4). Alternativamente, o isolamento é conseguido através do icing, a chamada ablação de cryoballoon (Fig. 5). São também utilizados novos cateteres de ablação circulares e multipolares. Os procedimentos laser, que também são realizados através de um cateter apoiado por balão, estão também a tornar-se cada vez mais comuns. No entanto, a possível assimetria e variabilidade de tamanho dos orifícios das veias pulmonares e as suas variações anatómicas podem complicar o desenho de tamanho único dos cateteres de ablação assistidos por balão. A ablação por radiofrequência continua a ser a mais comum. Um cateter de cartografia circular é utilizado para controlar o isolamento eléctrico alcançado. O isolamento das quatro veias pulmonares é o princípio fundamental e objectivo primário do procedimento, caso contrário podem ocorrer recidivas de FA, levando ao insucesso do tratamento.
A intervenção dura geralmente 90-180 minutos. Após a remoção de todos os cateteres, é aplicado um penso de pressão. Na maioria dos casos, os pacientes podem ter alta no dia seguinte.
OAK não é descontinuado periintervencionalmente, dado que esta estratégia está associada a menos complicações [9]. Após a intervenção, o OAK é continuado durante pelo menos três meses (devido a cicatrizes na área de ablação) e depois ajustado de acordo com o risco individual de acordo com a pontuação CHA2DS2-VASc.
O sucesso do tratamento
Ainda não foi estabelecido um método óptimo como padrão de ouro para o diagnóstico de possíveis recidivas de fibrilação atrial. Dependendo do centro, os controlos de ECG a longo prazo (24 horas a 7 dias) são efectuados após a intervenção em diferentes intervalos, geralmente após três, seis e doze meses, depois anualmente.
O sucesso depende em grande parte da experiência do centro de implementação. Nos primeiros três meses, as arritmias cardíacas (extra-sístoles atriais e fibrilação atrial) ainda são por vezes observadas, as quais não devem ser consideradas uma recorrência (“período de obturação”). Se depois houver um ritmo sinusal contínuo, o procedimento pode ser descrito como bem sucedido. A taxa de sucesso é de 80-90% em pacientes com fibrilação atrial paroxística sem doença cardíaca estrutural, com 20-30% exigindo uma repetição do procedimento. Na fibrilação atrial persistente ou na presença de doença cardíaca estrutural, a taxa de sucesso é de 60-70%. A terapia de ablação tornou-se assim muito importante, uma vez que mesmo o medicamento antiarrítmico mais eficaz, a amiodarona, consegue uma manutenção do ritmo de aproximadamente 40-50% a longo prazo.
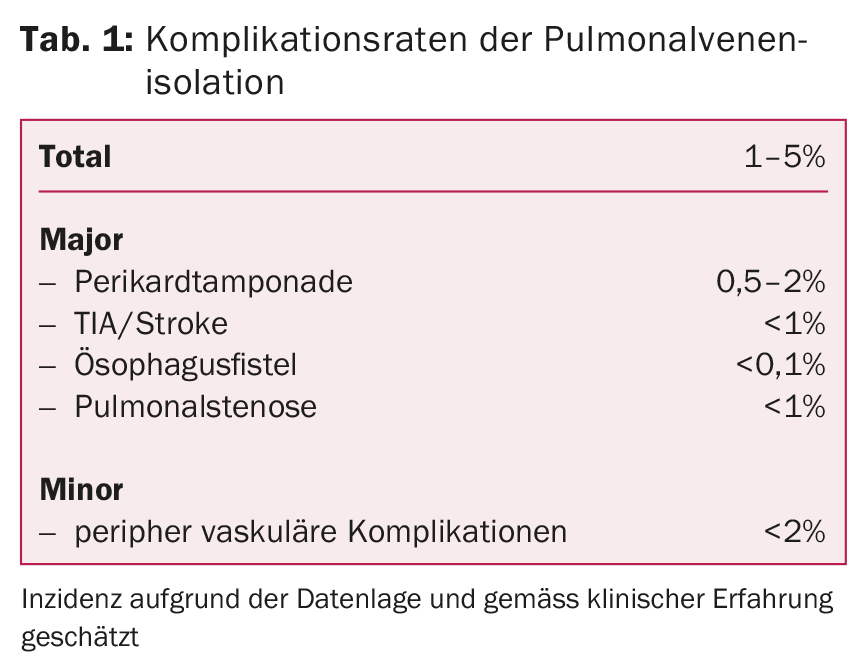
Em centros experientes, este tratamento é muito seguro e associado a poucas complicações. As complicações mais perigosas incluem eventos tromboembólicos (TIA, AVC), tamponamento pericárdico, estenose das veias pulmonares ou fístulas esofagoatriais. Complicações na área do local da injecção, tais como hemorragia secundária, hematoma ou lesões vasculares, podem ocorrer com maior frequência (tab. 1).
Agradecimentos: Um grande obrigado vai para Till Ramstein (STUDIO, Basileia) pela preparação das figuras 3 e 5.
Literatura:
- Cosedis Nielsen J, et al: Ablação por Radiofrequência como Terapia Inicial em Fibrilação Atrial Paroxística. N Engl J Med 2012; 367(17): 1587-1595.
- Wazni OM, et al: Ablação por radiofrequência versus medicamentos antiarrítmicos como tratamento de primeira linha da fibrilação atrial sintomática: Um ensaio aleatório. JAMA 2005; 293: 2634-2640.
- Feinberg WM, et al: Prevalência, distribuição etária, e sexo dos pacientes com fibrilação atrial. Análise e implicações. Arch Intern Med 1995; 155: 469-473.
- Heeringa J, et al: Prevalência, incidência e risco de fibrilação atrial ao longo da vida: o estudo de Roterdão. Eur Heart J 2006; 27: 949-953.
- Sankaranarayanan R, et al: Comparação da Fibrilação Atrial nos Jovens versus a dos Idosos: Uma Revisão. Pratique Cardiol Res 2013; 2013: 976976.
- The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigadores: Uma comparação do controlo da taxa e controlo do ritmo em pacientes com fibrilação atrial. N Engl J Med 2002; 347: 1825-1833.
- Cosio FG, et al: Atraso no controlo do ritmo da fibrilação atrial pode ser uma causa de falha na prevenção de recidivas: razões para a mudança para tratamento antiarrítmico activo na altura ou o primeiro episódio detectado. Europace 2008; 10: 21-27.
- Kirchhof P: Podemos melhorar os resultados em pacientes com fibrilação atrial através de terapia precoce? BMC Med 2009; 7: 72.
- Cappato R, et al: Antagonistas ininterruptos do rivaroxaban vs. antagonistas ininterruptos da vitamina K para ablação do cateter em fibrilação atrial não-valvar. Eur Heart J 2015 Jul 21; 36(28): 1805-1811.
CARDIOVASC 2015; 14(5): 3-6