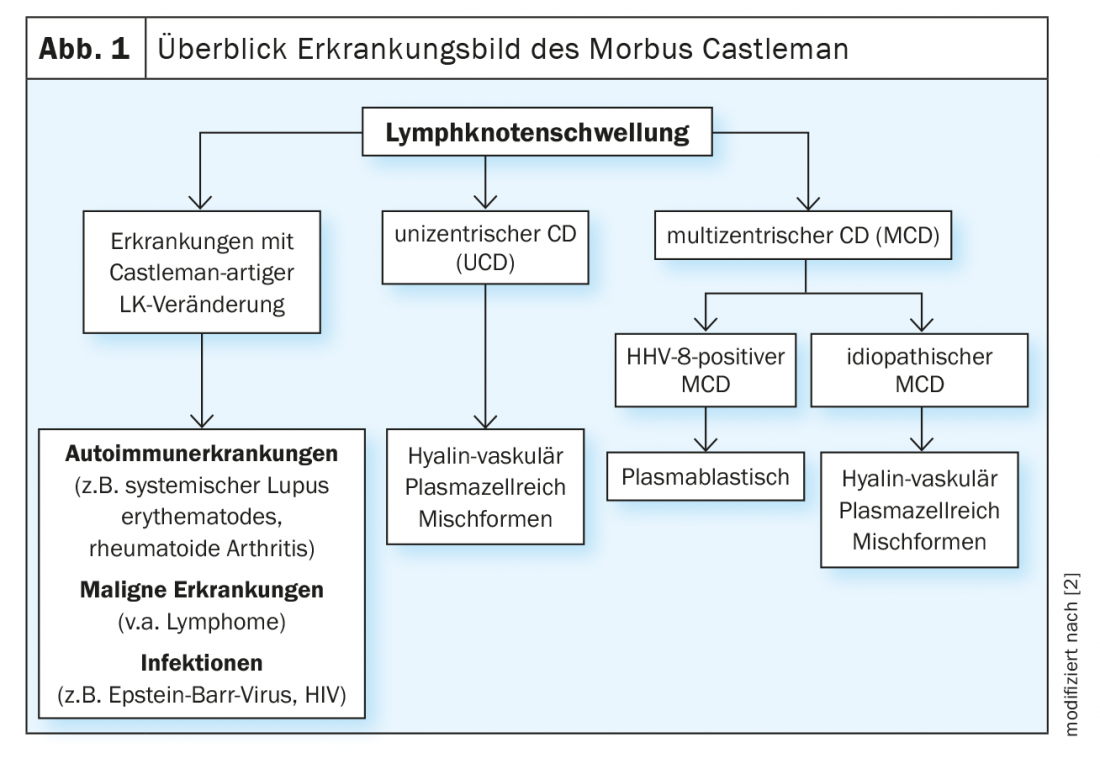
O inchaço periódico, muito doloroso e extenso dos gânglios linfáticos pode também indicar uma doença rara de Castleman. Esta doença rara está dividida em doenças unicêntricas do Castleman (UCD) e formas multicêntricas. A forma multicêntrica é uma doença sistémica grave que não é fácil de diagnosticar.
O inchaço dos gânglios linfáticos ocorre rapidamente e não é um motivo de preocupação per se. Se, por outro lado, houver um inchaço periódico, muito doloroso e acentuado dos gânglios linfáticos, a doença de Castleman também deve ser considerada. Esta doença rara está dividida em doença unicêntrica de Castleman (UCD) e formas multicêntricas e é frequentemente negligenciada. O DCU é uma forma benigna da doença com hiperplasia localizada do tecido linfático [1]. Neste caso, a excisão do gânglio linfático afectado é o método de eleição [2]. No entanto, torna-se mais problemática com a doença multicêntrica do Castleman (MCD). Esta é uma doença sistémica grave com um prognóstico frequentemente desfavorável. Uma produção excessiva de diferentes citocinas, especialmente a interleucina-6 (IL-6), resulta numa sintomatologia heterogénea. Existe uma estreita associação com o vírus do herpes humano 8 (HHV-8). Isto, por sua vez, é largamente congruente com as infecções por VIH. Consequentemente, mais de 90% dos doentes infectados com VIH são também HHV-8 positivos. Pelo contrário, nos doentes seronegativos, a taxa é de apenas 10-15% – o DMC idiopático predomina aqui [3] (Fig. 1).
Epidemiologia
Basicamente, a doença de Castleman é uma doença muito rara, mas a maioria das pessoas não são certamente diagnosticadas correctamente. Por milhão de habitantes, são esperados 2,4 casos, o que corresponde a cerca de 20 casos na Suíça [4]. Com 35,4%, a DMC parece ocorrer menos frequentemente do que a DCU (64,6%) [5]. A incidência é mais elevada em doentes infectados com VIH. Segundo um estudo britânico, são 4,3 casos por 10 000 pacientes-ano, com uma ligeira tendência ascendente nos últimos anos [2,6]. Em estudos observacionais, a mortalidade nos primeiros 5 anos após o diagnóstico foi de 30-35% [7]. De acordo com uma revisão sistémica, a sobrevivência livre de doenças na iMCD após 3 anos foi de 45,7% [8].
Patogénese
A forma multicêntrica com alargamento de numerosos gânglios linfáticos foi descrita pela primeira vez em 1978. Ocorre com mais frequência em doentes seropositivos. O HHV8 é responsável pela doença multicêntrica de Castleman em quase todos os doentes seropositivos e por cerca de metade das doenças em doentes seronegativos [9]. Produzem uma interleucina viral que é muito semelhante à IL-6 humana e tem efeitos semelhantes. Só precisa de se ligar a uma das duas subunidades receptoras da IL-6 para estar activa. Isto explica o efeito significativamente mais amplo nas células-alvo e provavelmente também as típicas “tempestades de citocinas” [10,11,2]. As interleucina-6 e outras citocinas pró-inflamatórias induzem a proliferação de células B e plasmócitos, secreção de factores de crescimento endotelial vascular e angiogénese.
As causas do iMCD, por outro lado, continuam a ser objecto de debate controverso. Os cientistas assumem que uma doença auto-imune inflamatória, uma infecção viral e uma predisposição genética podem ser responsáveis [12]. Além da IL-6, estão envolvidas outras moléculas de sinalização, incluindo VEGF (“factor de crescimento endotelial vascular”), TNF-alfa e interleucina-1 [13]. A proliferação linfocítica na iMCD é geralmente policlonal e uma consequência da hipercitocinemia [14,2]. No entanto, foi observada uma proliferação monoclonal em algumas lesões do subtipo vascular hialino [15,2].
Sintomas e queixas
Os sintomas apresentam-se de forma muito heterogénea, o que muitas vezes dificulta um diagnóstico eficaz. No entanto, a doença é geralmente acompanhada de dor nos gânglios linfáticos afectados. Estas tumefacções ocorrem frequentemente em episódios, especialmente no MCD positivo HHV-8. Além disso, existem claros sintomas B, tais como febre, suores nocturnos e perda de peso. Quase todos os pacientes queixam-se de fraqueza e sensação de doença, náuseas, vómitos e perda de apetite. O baço e o fígado também são aumentados. Há também hepatomegalia, sintomas respiratórios e uma tendência para oedema com hipalbuminemia. Há geralmente anemia hematológica grave, que pode muitas vezes ser acompanhada por trombocitopenia maciça.
Normalmente, a doença progride em episódios que duram alguns dias a semanas, durante os quais os doentes têm frequentemente febre alta e estão gravemente doentes. Entretanto, há períodos mais longos que podem durar semanas, durante os quais os pacientes se sentem muito melhor novamente. O tamanho dos gânglios linfáticos pode quase voltar ao normal. A frequência e intensidade das recaídas geralmente aumentam com o tempo, embora também sejam conhecidos cursos auto-limitados. Contudo, existe um risco significativamente aumentado de linfomas malignos, especialmente subtipos de linfomas bastante raros, tais como linfomas plasmáticos ou linfomas de efusão primária [2,12].
Um iMCD manifesta-se num sintoma de fadiga pronunciado, especialmente nas fases iniciais. Em contraste com o DMC, sintomas como febre, inchaço dos gânglios linfáticos e anemia são muito menos pronunciados e o curso de recaída é menos abrupto. Os sintomas podem variar desde sintomas constitucionais ligeiros a cursos com anasarca e falência de múltiplos órgãos com risco de vida. Um subtipo grave de iMCD, síndrome TAFRO, foi recentemente definido. Este é um complexo sintomático de trombocitopenia, ascite, febre, fibrose reticular na medula óssea e organomegalia com o normal γ-globulina [16]. Além disso, as associações com a síndrome de POEMS, um quadro clínico que consiste em neuropatia periférica, organomegalia, endocrinopatia, gamopatia monoclonal e alterações cutâneas, são comuns [2].
Diagnósticos
A doença de Castleman deve ser diferenciada dos linfomas e outras doenças graves. A forma severa em particular é muitas vezes confundida com linfoma. O exame histopatológico de um gânglio linfático extirpado é obrigatório. Um furo não é normalmente suficiente. A preparação mostra linfadenite reactiva com proliferação de plasmócitos na polpa e alterações regressivas nos centros germinais, que são geralmente estratificadas como peles de cebola e intercaladas com vasos. No MCD HHV-8 positivo, é geralmente vista uma imagem plasmoblástica, muitas vezes com o chamado padrão comido pelas traças na área da zona do manto. O padrão característico da pele da cebola é muitas vezes parcialmente destruído. HHV-8 é detectado através de coloração para LANA-1 (“latency-associated-nuclear-antigen”). O sangue colhido durante um episódio da doença mostra níveis elevados de IL-6 e CRP. A tríade de sintomas B, viraemia do HHV-8 e achados histológicos é útil para o diagnóstico [17].
O diagnóstico da iMCD é muito mais difícil, uma vez que muitas outras doenças têm de ser excluídas. As alterações histopatológicas também se encontram, por exemplo, numa variedade de infecções (incluindo o vírus Epstein-Barr) ou no lúpus eritematoso, artrite reumatóide, síndrome de Sjögren e algumas neoplasias, incluindo linfomas especialmente malignos. Portanto, para além das alterações histopatológicas, os parâmetros clínicos e laboratoriais devem ser sempre tidos em conta. A iMCD é diferenciada em três subtipos histopatológicos: o tipo hialinovascular, o tipo plasmocelular e o tipo misto. Todos ocorrem em cerca de 20-40% dos casos [18]. O tipo hialinovascular caracteriza-se por células dendríticas foliculares displásicas (DCF) e centros germinais atróficos intercalados com vasos hialinos, em torno dos quais os linfócitos estão concentricamente dispostos. No tipo de células plasmáticas, os centros germinais são hiperplásicos e não atróficos e os FDCs e a arquitectura dos gânglios linfáticos são normais [2].
Terapia
A doença Unicêntrica de Castleman tem um prognóstico muito bom, pois o gânglio linfático afectado pode ser removido por cirurgia. A reincidência da doença é extremamente rara. Contudo, uma vez que muitos gânglios linfáticos são afectados na DMC, a intervenção cirúrgica não é eficaz. O tratamento continua a ser difícil. Não há terapia padrão para doentes com doença multicêntrica de Castleman. Conceptualmente, são utilizadas substâncias imunossupressoras e citotóxicas. Os glicocorticóides são eficazes mas muitas vezes não levam ao alívio dos sintomas a longo prazo (Fig. 2).
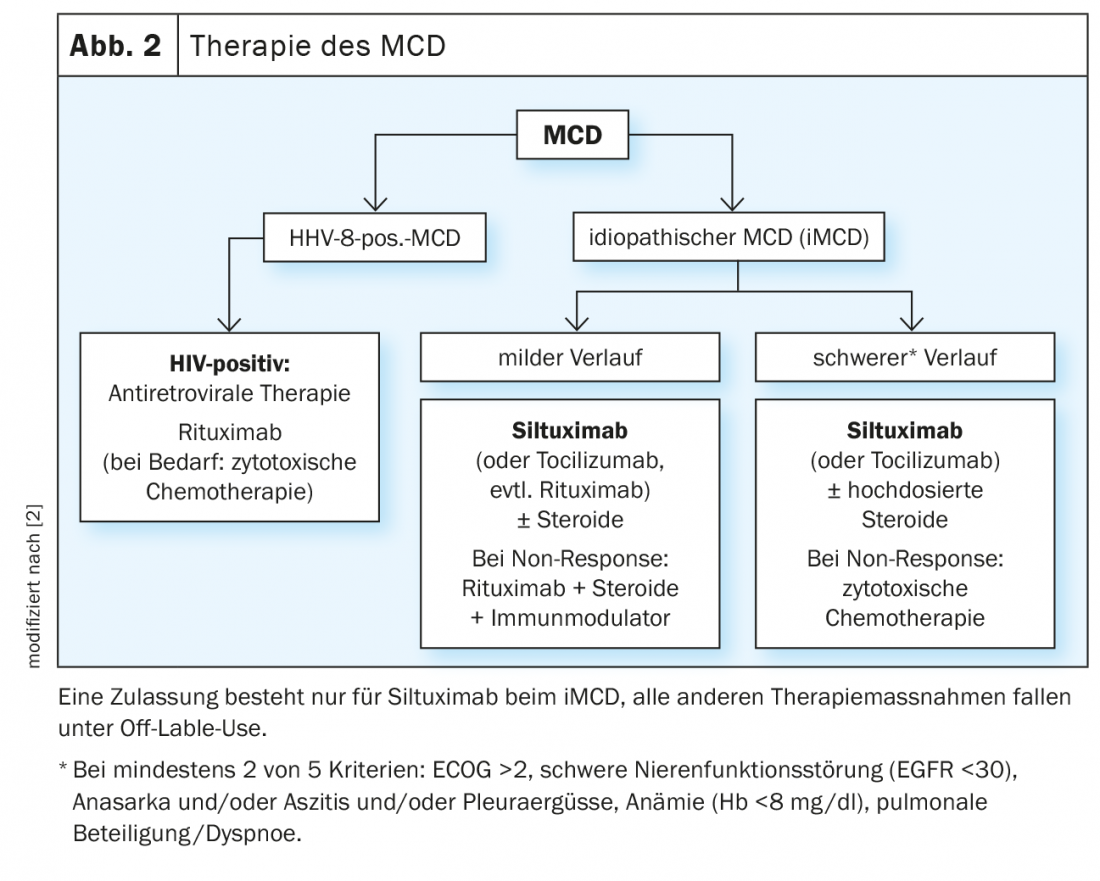
No iMCD, o bloqueio da via de sinalização IL-6 por meio de anticorpos monoclonais como o siltuximab é utilizado principalmente. No MCD HHV-8 positivo, o foco é a eliminação citotóxica das células responsáveis pela sobreprodução de citocinas. As terapias imunomodulatórias são principalmente esteróides, bem como substâncias antivirais como o valganciclovir. Desde 2018, existem pela primeira vez recomendações consensuais para o iMCD [19]. Baseiam-se na experiência com 344 pacientes que foram submetidos a um total de 479 terapias, têm em conta a gravidade da doença, as terapias anteriores e a resposta.
O único medicamento aprovado até agora para o tratamento da iMCD é o siltuximab, um anticorpo monoclonal contra a IL-6 humana. É utilizado para todas as formas de iMCD com ou sem esteróides. No estudo central, 79 pacientes com iMCD foram tratados com siltuximab ou placebo durante três semanas [20,7]. O ponto final primário foi uma resposta duradoura em termos de tamanho do tumor e melhoria da pontuação de um sintoma clínico durante pelo menos 18 semanas. Embora não tenha sido observada qualquer resposta no grupo do placebo, as taxas no grupo do verum foram de 34%. Siltuximab foi globalmente bem tolerado. Os efeitos secundários frequentes e característicos são prurido da pele, infecções do tracto respiratório superior, exantema e edema local, predominantemente de gravidade 1 e 2. Os efeitos secundários graves são fadiga (12%) e suores nocturnos (8%). No entanto, a taxa aqui não foi mais elevada do que com placebo, pelo que estes sintomas são mais susceptíveis de serem atribuídos à doença subjacente [7]. Dados de ensaios recentes mostram agora que os doentes com CDM recém-diagnosticados e pré-tratados respondem igualmente à substância [21]. Um total de 46 doentes pré-tratados e 33 doentes recém-diagnosticados foram randomizados para o anticorpo (n=53) ou placebo (n=26). Com a excepção do subtipo histológico, não houve diferenças significativas nas características de base. A duração média do tratamento foi de 375 bzs. 233 dias. As taxas de resposta tumoral duradoura e de resposta sintomática foram de 34,5% vs. 0% em doentes tratados com siltuximab em comparação com placebo em doentes previamente tratados versus doentes recém-diagnosticados 33,3% vs. 0%. A mediana do tempo para o fracasso do tratamento (TTF) não foi alcançada com siltuximab em nenhum dos subgrupos.
Tocilizumab, um anticorpo contra o receptor IL-6, é considerado uma alternativa ao siltuximab nas recomendações internacionais, mas só é aprovado na Europa para a artrite reumatóide.
O Rituximab, um anticorpo monoclonal contra o CD20, também não está aprovado para o tratamento do DMC. Especialmente os pacientes com MCD HHV-8 positivo parecem responder bem a ele. Em várias séries de casos, foi observada uma melhoria significativa na sobrevivência globala e na sobrevivência sem doenças. As citocinas, mas também as CRP, as imunoglobulinas e a carga viral HHV-8 diminuíram [22,2]. No entanto, em cerca de um terço dos casos, a progressão do sarcoma de Kaposi, que frequentemente acompanha a doença, ocorreu. Aqui, uma combinação com substâncias citostáticas com actividade KS poderia ser útil [23]. Em situações de risco de vida, a esplenectomia deve ser considerada. Reduz o pool de células infectadas com HHV-8 [2].
Mensagens Take-Home
- A doença de Castleman está dividida na forma unicêntrica benigna (UCD) e multicêntrica da doença de Castleman (MCD).
- A DMC é uma doença sistémica que muitas vezes não é reconhecida devido à sua heterogeneidade e ocorrência rara.
- O inchaço doloroso dos gânglios linfáticos ocorre em episódios, frequentemente acompanhados de sintomas B, tais como febre ou suores nocturnos.
- O Siltuximab é actualmente o único medicamento aprovado para o tratamento do DMC idiopático.
Literatura:
- Castleman B, Towne VW: Processos do Hospital Geral de Massachusetts; exercícios clinicopatológicos semanais. N Engl J Med 1954; 251: 396-400
- Hoffmann C, Tiemann M: Doença Multicêntrica de Castleman: Raramente diagnosticada correctamente. Dtsch Arztebl 2019; 116(46): [32]; DOI: 10.3238/PersOnko.2019.11.15.06
- Hoffmann C: Multicentric Castleman’s disease (MCD) – um quadro clínico raro, muitas vezes não reconhecido. Trillium 2015. www.trillium.de/zeitschriften/trillium-krebsmedizin/archiv/ausgaben-2015/heft-12015/multizentrischer-morbus-castleman-mcd-ein-seltenes-oft-verkanntes-krankheitsbild.html (última vez que se acedeu 06.04.2020)
- Robinson D Jr, Reynolds M, Casper C, et al: epidemiologia clínica e padrões de tratamento de doentes com doença multicêntrica de Castleman: resultados de dois centros de tratamento dos EUA. Br J Haematol 2014; 165: 39-48.
- Haap M, Wiefels J, Horger M, et al: Descobertas clínicas, laboratoriais e de imagem na doença de Castleman – O subtipo decide. Blood Rev 2018; 32: 225-234.
- Powles T, Stebbing J, Bazeos A, et al: The role of immune suppression and HHV-8 in the increasing incidence of HIV-associated multicentric Castleman’s disease. Ann Oncol 2009; 20: 775-779.
- www.dgho.de/publikationen/stellungnahmen/fruehe-nutzenbewertung/siltuximab/siltuximab-dgho-stellungnahme-20141006.pdf (último acesso 06.04.2020)
- Talat N, Schulte KM: doença de Castleman: análise sistemática de 416 pacientes da literatura. Oncologista 2011; 16:1316-24
- Fajgenbaum DC, van Rhee F, Nabel CS: HHV-8-negativo, doença multicêntrica idiopática de Castleman: novos conhecimentos sobre biologia, patogénese e terapia. Sangue 2014; 123: 2924-2933. DOI: 10.1182/blood-2013-12-545087.
- Li H, Wang H, Nicholas J. Detecção de ligação directa do herpesvírus humano interleucina-6 (vIL-6) ao receptor gp130 e IL-6 (IL-6R) e identificação de resíduos de aminoácidos de vIL-6 importantes para a sinalização dependente e -independente de IL-6R. J Virol 2001; 75: 3325-3334.
- Moore PS, Boshoff C, Weiss RA, Chang Y: Mimetismo molecular dos genes da via de resposta da citocina humana e citocina pelo KSHV. Ciência 1996; 274: 1739-1744.
- https://medlexi.de/Morbus_Castleman (último acesso 06.04.2020)
- Pierson S, Stonestrom A, Ruth J, et al: A quantificação das proteínas plasmáticas das crises e remissões idiopáticas multicêntricas da doença de Castleman revela ‘tempestade de quimiocinas’ e separa os subtipos clínicos (abstracto). Sangue 2017; 130(Suplemento 1).Resumo 3592
- Ohyashiki JH, Ohyashiki K, Kawakubo K, et al. Análises genéticas moleculares, citogenéticas, e imunofenotípicas Doença de Castleman do tipo plasmócito. Am J Clin Pathol 1994; 101: 290-295.
- Chang KC, Wang XC, Hung YL: Monoclonalidade e anomalias citogénicas na doença hialina vascular Castleman. Mod Path 2014; 7: 823-831.
- Iwaki N, Fagenbaum D, Nabel CS, et al: Clinicopathologic analysis of TAFRO syndrome demonstra um subtipo distinto de doença multicêntrica multicêntrica de Castleman HHV-8-negativa. Am J Hematol 2016; 91: 220-226.
- Bower M, Pria AD, Coyle C, et al: esquemas de critérios diagnósticos para a doença multicêntrica de Castleman em 75 casos. J Acquir Immune Defic Syndr 2014; 65(2): e80-82.
- Liu AY, Nabel CS, Finkelman BS, et al: Idiopathic multicentric Castleman’s disease: a systematic literature review. Lancet Hematol 2016; 3: e163-175.
- van Rhee F, Voorhees P, Dispenzieri A, et al: Internacional, directrizes de tratamento consensual baseadas em provas para a doença idiopática multicêntrica de Castleman. Sangue 2018; 132: 2115-2124.
- van Rhee F, Wong RS, Munshi N, et al: Siltuximab para a doença multicêntrica de Castleman: um ensaio aleatório, duplo-cego, controlado por placebo. Lancet Oncol 2014; 15: 966-974, DOI: 10.1016/S1470-2045(14)70319-5.
- van Rhee F, Rossi J, Simpson D et al. A doença multicêntrica de Castleman recém-diagnosticada e previamente tratada responde igualmente ao siltuximab. Br J Haematol. 2021; 192(1):e28-e31.
- Bower M, Veraitch O, Szydlo R, et al: mudanças de citocinas durante a terapia rituximab na doença multicêntrica Castleman associada ao VIH. Sangue 2009; 113: 4521-4524.
- Uldrick TS, Polizzotto MN, Aleman K, et al: Rituximab plus liposomal doxorubicina em doentes infectados com HIV com doença multicêntrica Castleman associada ao KSHV. Sangue 2014; 124: 3544-3552.
InFo ONCOLOGY & HEMATOLOGY 2022; 10(2): 10-13











