Se os doentes com carcinoma hepatocelular (HCC) preencherem determinados critérios relativos ao tamanho do tumor, número de tumores e metástases, o transplante hepático pode ser uma opção terapêutica sensata. Os órgãos disponíveis são atribuídos de acordo com a gravidade da doença hepática. Para pacientes em lista de espera para um transplante, podem ser realizadas terapias de transição locais para controlo de tumores: quimioembolização transarterial (TACE), ablação por radiofrequência (RFA) e injecção percutânea de etanol (PEI).
O carcinoma hepatocelular (HCC) é a terceira causa mais comum de morte por cancro a nível mundial e a sexta causa mais comum de morte por cancro na Suíça [1]. A incidência está a aumentar ao longo de muitos anos. As principais causas são infecções com vírus da hepatite B e C (HBV, HCV) e, mais recentemente, o aumento epidemiológico da esteato-hepatite não alcoólica (NASH). Sem tratamento, o HCC tem um prognóstico desfavorável com uma taxa de sobrevivência de 5 anos inferior a 10%.
A maioria dos doentes desenvolve o CHC no cenário da cirrose hepática, o que torna as estratégias de tratamento óptimas muito mais difíceis. Na última década, foram feitos avanços significativos no conhecimento biomédico sobre a doença e o seu tratamento. As opções de tratamento baseiam-se principalmente em intervenções cirúrgicas (ressecção, transplante hepático) e não cirúrgicas (quimioembolização interventiva-radiológica, ablação loco-regional, quimioterapia). No caso da doença HCC localizada e não multi-focal, a remoção cirúrgica de tumores e o transplante de fígado são a norma de ouro [2,3].
Selecção de doentes com base no tamanho e prognóstico do tumor
O transplante do fígado parece ser a terapia HCC ideal, uma vez que a remoção completa do fígado infestado de tumores corresponde formalmente a uma remoção oncológica de tumores com margens de ressecção negativas. No entanto, no contexto da escassez de órgãos de um doador, o transplante de fígado só é considerado para pacientes cuja probabilidade de sobrevivência é comparável à de um receptor de órgãos sem HCC.
Originalmente, o grupo de Bismuto relatou a extensão do envolvimento tumoral como marcador substituto da biologia tumoral: pacientes com tumores pequenos, uni ou binodulares <3 cm tiveram melhor sobrevivência em caso de transplante em comparação com a ressecção tumoral (83% vs. 18%) [4]. Os doentes com CHC difuso com mais de dois nódulos >3 cm ou trombo venoso portal tiveram uma maior taxa de recorrência com sobrevida consecutiva reduzida. Mazzaferro et al. pacientes estudados com cirrose e CHC não ressecáveis que foram tratados por transplante [5]. Os autores estabeleceram critérios específicos – a base dos chamados critérios de Milão – definidos como um único tumor <5 cm ou ≤3 tumores cada um <3 cm de diâmetro (Fig. 1) . Os pacientes que preenchiam os critérios de Milão mostraram uma melhoria significativa da sobrevivência global e sem recorrência após o transplante.
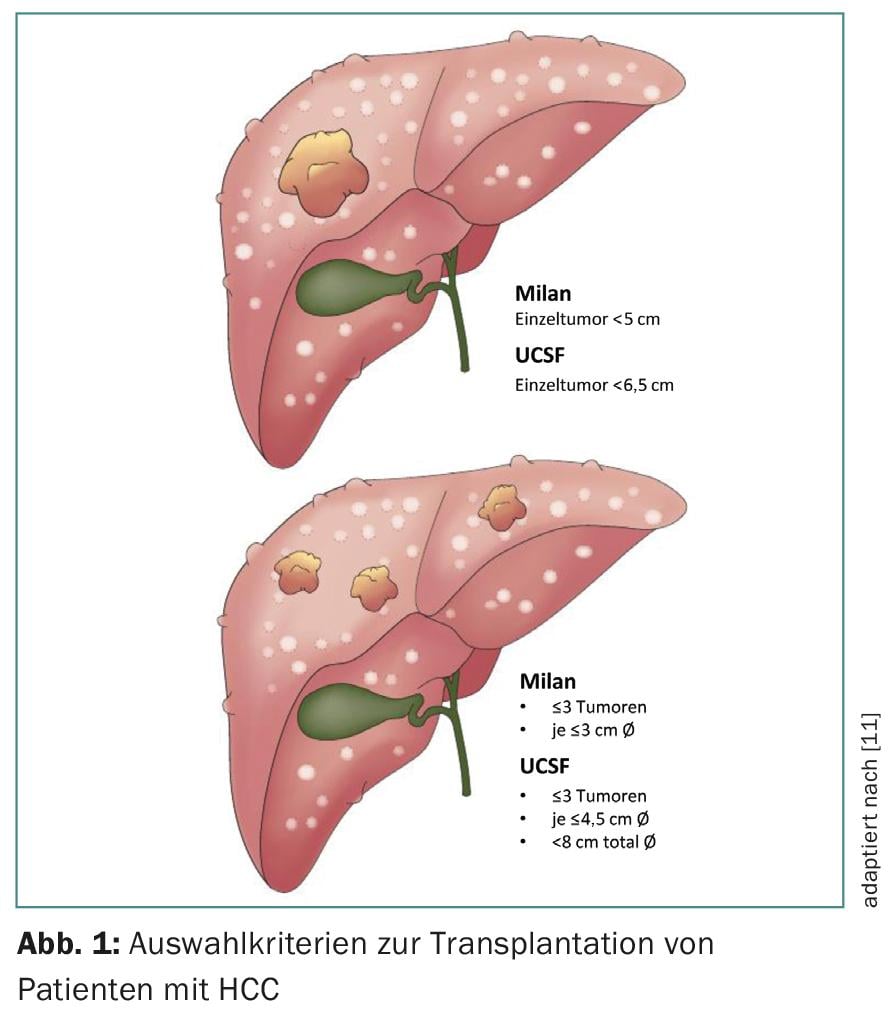
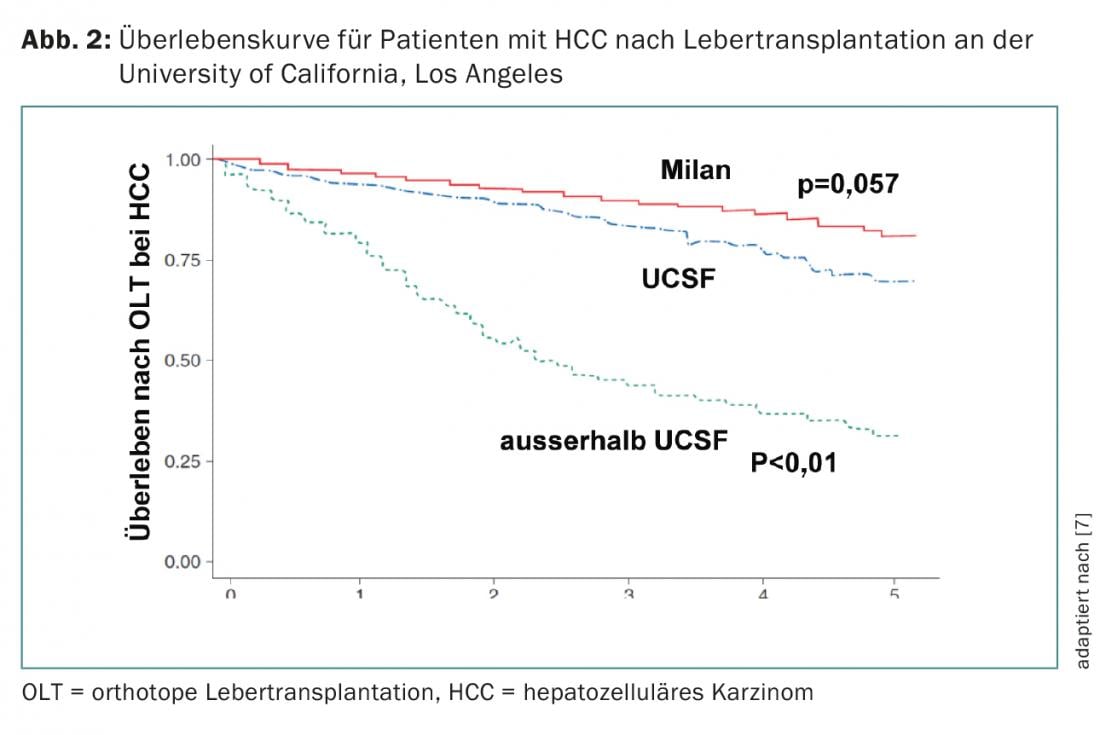
Numerosos estudos relataram excelentes dados de sobrevivência em doentes com CHC transplantados dentro destes critérios. Isto levou alguns peritos a considerar os critérios demasiado restritivos. De facto, um grupo de investigação na Universidade da Califórnia, São Francisco (UCSF) mostrou que os pacientes fora dos critérios de Milão também beneficiam significativamente dos transplantes. Os critérios mais amplos da UCSF são definidos como um tumor único ≤6.5 cm ou ≤3 tumores cada um ≤4.5 cm e soma dos diâmetros totais do tumor ≤8 cm (Fig. 1) [6].
Os pacientes transplantados dentro dos critérios de Milão ou UCSF têm dados de sobrevivência semelhantes (80% vs. 75% de sobrevivência em 5 anos). No entanto, o transplante fora dos critérios da UCSF está associado a uma taxa de sobrevivência de 5 anos bem abaixo dos 50% (Fig. 2) [7]. Independentemente do tamanho e número do tumor, a evidência de invasão do tumor macrovascular significa uma contra-indicação para o transplante hepático.
Distribuição de órgãos de acordo com a gravidade da doença hepática
Os fígados dos doadores são atribuídos de acordo com a gravidade da doença hepática no receptor potencial; a gravidade é avaliada usando um sistema de pontuação de acordo com a pontuação do Model for End-Stage Liver Disease (MELD) [8]. A pontuação MELD é adequada para avaliar a probabilidade de sobrevivência dos pacientes em lista de espera. Tem em conta a função hepática e renal e é calculado a partir dos valores laboratoriais bilirrubina total, Quick e creatinina com valores de 6 – 40.
Quanto maior for a pontuação MELD, que pode variar entre 6 – 40, maior será a prioridade do paciente na lista de espera para uma oferta de órgãos. Contudo, como os doentes com CHC podem ter compensado a cirrose, a pontuação MELD pode subestimar o verdadeiro risco de morte, razão pela qual foram estabelecidos critérios de isenção de MELD para o CHC. Os doentes com CHC na Suíça recebem 14 pontos MELD na lista inicial e mais 1,5 pontos por mês na lista de espera. Um paciente com HCC e função hepática compensada que está na lista de espera há seis meses tem assim uma pontuação MELD de 23 (14 + 9).
Critérios de listagem para transplante de fígado
Os pacientes com CHC são cuidadosamente avaliados antes de um possível transplante de fígado. Isto envolve uma avaliação radiológica do tamanho e número do tumor. A metástase extra-hepática e a invasão vascular devem ser excluídas. A evidência histológica de HCC não é obrigatória: os critérios aceites de HCC sem evidência histológica são o realce arterial seguido de lavagem venosa portal em tomografia computorizada (TC) ou ressonância magnética (RM) se o foco for >1 cm, ou evidência de tumores em angiografia. Para que o transplante seja considerado em todos os pacientes com CHC, é necessária uma avaliação como não-renovável. Reavaliação de três em três meses por RM ou TAC para excluir a progressão da doença para além dos critérios estabelecidos.
Fazer a ponte entre as terapias para os pacientes em lista de espera
Os pacientes com CHC na lista de transplantes de fígado são regularmente reavaliados. No caso da progressão hepática da doença tumoral fora dos critérios de listagem – determinada por imagem e α-fetoproteína (AFP) – em muitos casos ocorre a listagem passiva e tenta-se uma redução. Se a progressão ocorrer apesar das terapias loco-regionais, deve ocorrer a “retirada” da lista de espera de transplantes. Os doentes com CHC podem ter uma pontuação MELD relativamente baixa e permanecer na lista de espera por mais tempo, o que pode fazer com que o cancro progrida e, por conseguinte, o prognóstico após o transplante do fígado seja menos favorável ou mesmo a exclusão da lista.
Os centros de transplantação com longas listas de espera realizam terapias de transição locais para o controlo do tumor nestes pacientes, que consistem na quimioembolização transarterial (TACE), ablação por radiofrequência (RFA) e injecção percutânea de etanol (PEI).
- TACE é uma embolização selectiva do influxo arterial do hepatoma usando agentes quimioterápicos (principalmente cisplatina ou doxorubicina), resultando em danos tumorais isquémicos, combinados com quimioterapia local com baixos efeitos secundários sistémicos. Com este método intervencionista, é possível obter uma redução do tamanho do tumor de 50% para uma necrose tumoral completa. O TACE também reduz a taxa de abandono na lista de espera, bem como a taxa de recorrência de tumores após o transplante de fígado e leva a uma redução.
- Em RFA, uma sonda RFA é colocada percutaneamente no tumor com suporte de imagem, e o tumor é destruído por meio de energia eléctrica alternada de alta frequência. Os resultados são satisfatórios: foram publicados relatórios de uma taxa de desistência de 0% e de uma sobrevivência de 3 anos de até 83%.
- A PEI tem sido a menos investigada como terapia de transição. Ao utilizar uma agulha fina, a PEI é teoricamente menos invasiva e portanto menos arriscada para a sementeira de tumores. Com um espectro favorável de efeitos secundários da PEI, podem ser alcançados resultados bem sucedidos com até 80% de necrose tumoral. No entanto, como são necessários vários tratamentos, a maioria da PEI foi substituída pela RFA.
Em caso de tamanho e número de tumores limítrofes após terapia de transição, o paciente é listado como inactivo para obter biologia do tumor por ressonância magnética, TAC e AFP. Se não for observada qualquer progressão do tumor após um período de espera inactivo de três meses na lista, o paciente é activamente listado.
Ressecção tumoral versus transplante de fígado
O transplante do fígado é claramente superior à ressecção em termos de sobrevivência sem recaídas durante 5 anos e é certamente a melhor opção terapêutica em pacientes cirróticos com pequeno CHC. Devido à escassez de órgãos doadores, bem como à fase frequentemente avançada da doença fora dos critérios, o transplante só pode ser oferecido numa população selectiva de HCC. Portanto, a ressecção continua a ser o tratamento de escolha para os pacientes cirróticos com função hepática compensada (Child-Pugh stage A) sem hipertensão portal [9].
A terapia combinada de ressecção e transplante de fígado pode ser considerada em três cenários clínicos diferentes:
- Terapia primária com transplante de salvados para recidiva de tumores (Fig. 3)
- Procedimento de diagnóstico para avaliação histopatológica do tumor no que diz respeito à invasão vascular, bem como satélites tumorais com selecção consecutiva e adequada de candidatos a transplante
- Terapia de transição antes do transplante para assegurar o controlo do tumor dentro dos critérios de Milão ou UCSF [10].
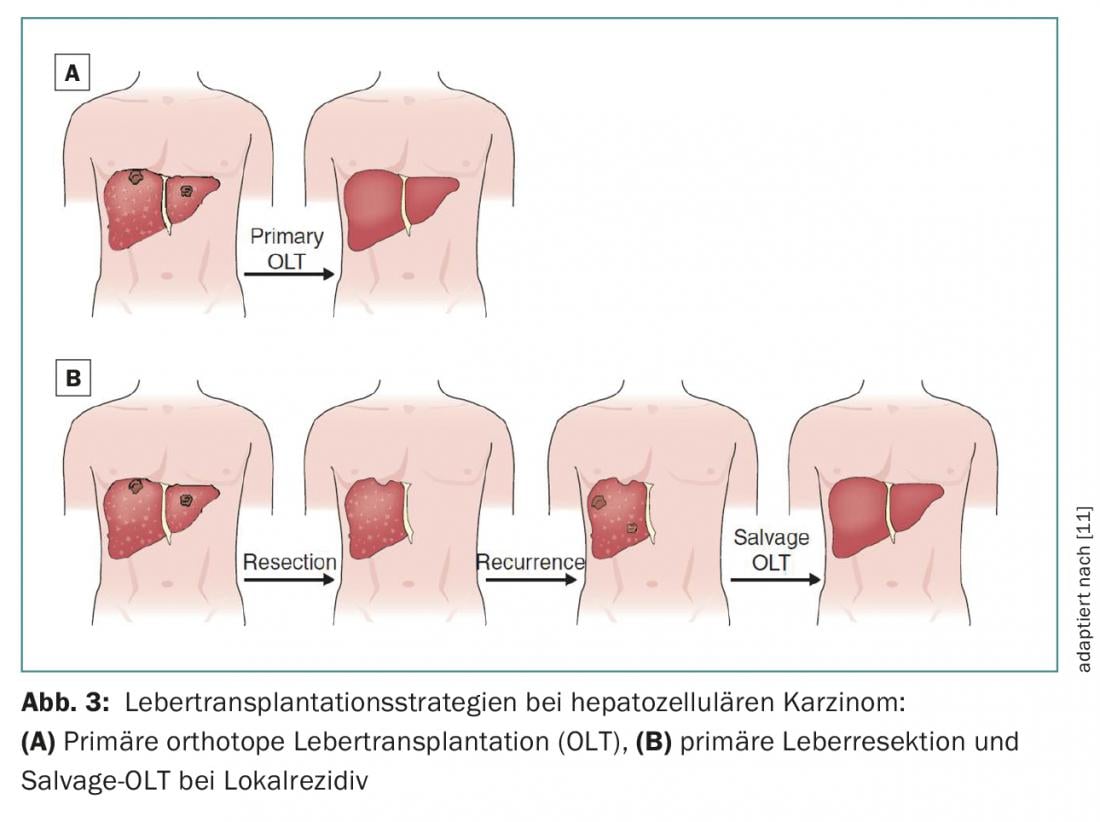
Os doentes com HCC com função hepática não compensada (Child-Pugh B ou C) e/ou hipertensão portal devem ser tratados principalmente com transplante hepático se a doença tumoral estiver dentro dos respectivos critérios de transplante aceites (Fig. 3).
Transplante de fígado vivo
Outra forma de contrariar a escassez de órgãos de doadores é a possibilidade de doação de fígado vivo (hemi-fígado direito ou esquerdo) de um doador saudável, o que leva a uma sobrevivência equivalente à doação cadavérica. No entanto, a morbilidade por vezes relatada de cerca de 40% dos doadores não é isenta de preocupações.
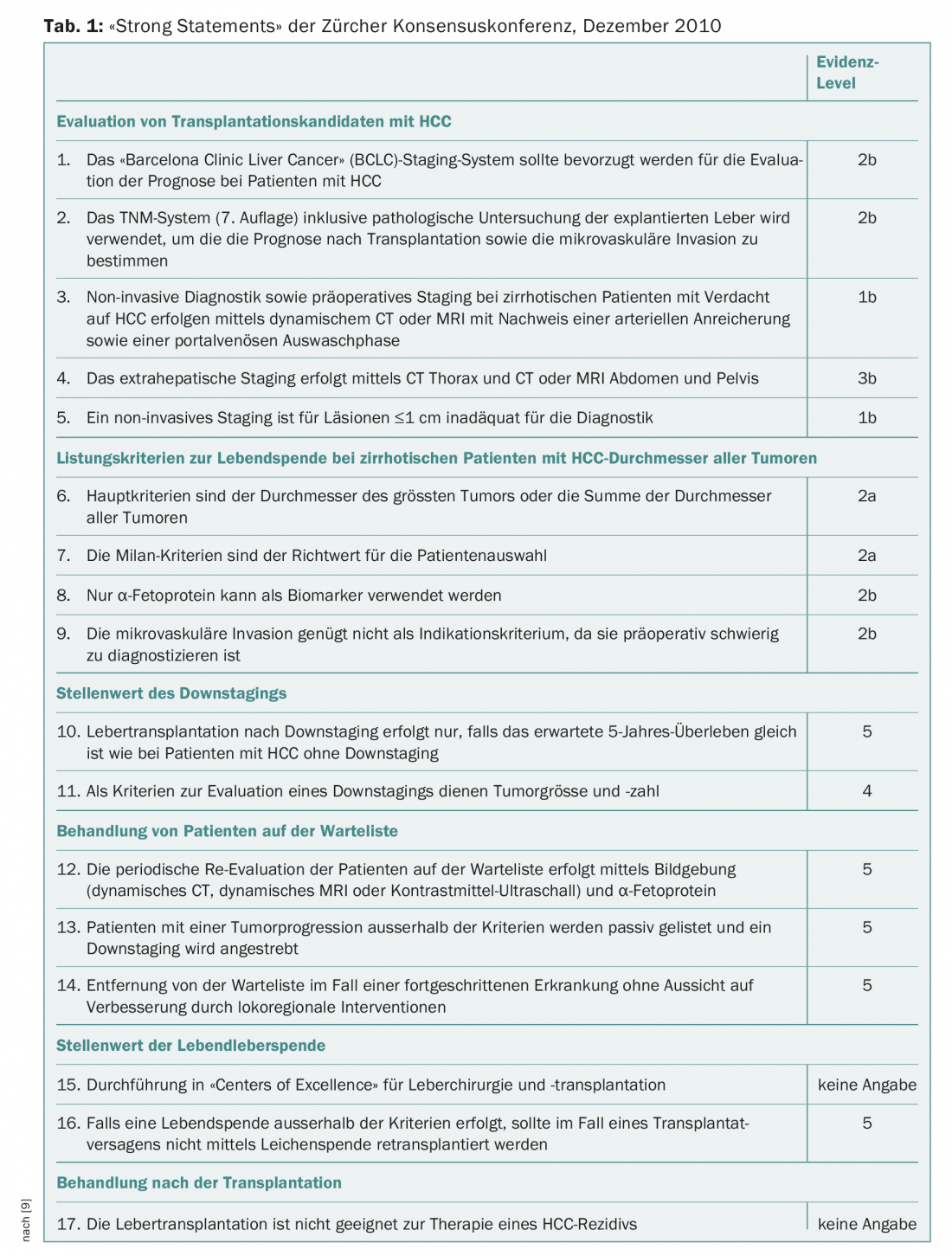
As directrizes internacionais recomendam o transplante de fígado vivo em pacientes com CHC onde a sobrevivência esperada de 5 anos é idêntica ao transplante de dádiva cadavérica. Os critérios de Milão são utilizados como uma orientação para a selecção de doentes. Os transplantes de fígado vivo só devem ser realizados em centros altamente especializados com grande experiência e especialização em cirurgia hepática e transplante de fígado. Se uma doação em vida for feita fora dos critérios, não deve ser retransplantada por doação cadavérica em caso de falha do enxerto (Tab. 1) [3].
Recomendações internacionais para transplante de fígado para HCC
Em Dezembro de 2010, realizou-se em Zurique uma conferência de consenso com peritos internacionais. O objectivo era elaborar a prática actual de transplante de fígado para HCC e desenvolver directrizes internacionalmente aceites. Foi formulado um total de 37 declarações e recomendações. Estes relacionam-se com as áreas de avaliação dos candidatos a transplante de fígado, critérios para a listagem de pacientes cirróticos e não cirróticos, papel da redução de tumores, tratamento de pacientes em lista de espera, valor da doação de fígado vivo e tratamento pós-transplante. As 17 recomendações mais importantes (“declarações fortes”) estão resumidas no Quadro 1 [3].
Mensagens Take-Home
- O transplante do fígado via cadavérico ou doação em vida é uma possível opção de tratamento para pacientes com CHC e doença hepática em fase terminal (ESLD).
- Foram definidos critérios específicos (Milão, UCSF) para a selecção de doentes, com base no tamanho e número do tumor. A evidência de invasão de tumores macrovasculares é uma contra-indicação ao transplante de fígado.
- A disfunção hepática é determinada pelo Modelo de Doença Fígada em Fases Finais (MELD); contudo, o valor de MELD em doentes com CHC pode ser o mesmo que em indivíduos saudáveis, razão pela qual os critérios de isenção de MELD foram estabelecidos para o CHC.
- Os pacientes em lista de espera para transplante beneficiam de terapias de transição que consistem na quimioembolização transarterial (TACE), ablação por radiofrequência (RFA) e injecção percutânea de etanol (PEI).
Literatura:
- Parkin DM, et al: Global cancer statistics 2002. CA Cancer J Clin 2005; 55(2): 74-108.
- Dutkowski P, et al: Challenges to Liver Transplantation and Strategies to Improve Outcomes. Gastroenterologia 2015 Fev; 148(2): 307-323.
- Clavien PA, et al: Recommendations for liver transplantation for hepatocellular carcinoma: an international consensus conference report. Lancet Oncol 2012; 13(1): e11-22.
- Bismuto H, et al: Ressecção do fígado versus transplante para carcinoma hepatocelular em pacientes cirróticos. Ann Surg 1993; 218(2): 145-151.
- Mazzaferro V, et al: Transplante de fígado para o tratamento de pequenos carcinomas hepatocelulares em pacientes com cirrose. N Engl J Med 1996; 334(11): 693-699.
- Yao FY, et al: Transplante de fígado para carcinoma hepatocelular: a expansão dos limites do tamanho do tumor não tem um impacto negativo na sobrevivência. Hepatologia 2001; 33(6): 1394-1403.
- Duffy JP, et al: Os critérios de transplante de fígado para carcinoma hepatocelular devem ser expandidos: uma experiência de 22 anos com 467 pacientes na UCLA. Ann Surg 2007; 246(3): 502-509; discussão 509-511.
- Malinchoc M, et al: Um modelo para prever a má sobrevivência em pacientes submetidos a shunts intra-hepáticos transjugulares de portos-sistémicos. Hepatologia 2000; 31(4): 864-871.
- Clavien PA, et al: Estratégias para uma cirurgia hepática mais segura e transplante de fígado parcial. N Engl J Med 2007; 356(15): 1545-1559.
- Chua TC, et al: Ressecção hepática para carcinoma hepatocelular transplantável para doentes dentro dos critérios de Milão e UCSF. Am J Clin Oncol 2012; 35(2): 141-145.
- Agopian V, Petrowsky H: Transplante de fígado para tumores malignos. In: Fong Y, Poon R, Tang ZY, Dupuy D, Berlin JD (eds): Cancro Hepatobiliar. People’s Medical Publishing House-USA, Ltd, 2014, 293-316.
InFo ONCOLOGY & HEMATOLOGY 2015; 3(5): 12-16