A quimioterapia oral é uma opção baseada em provas na terapia medicamentosa do carcinoma metastásico da mama. Tanto o perfil favorável do efeito secundário como a autonomia do paciente assegurada pela forma oral de administração têm um efeito favorável na qualidade de vida. A adesão do paciente influencia significativamente a tratabilidade com um fármaco citostático oral e, portanto, tem um impacto na segurança e no resultado do tratamento. Um acompanhamento rigoroso com consultas médicas regulares, bem como a promoção da responsabilidade pessoal, contribuem significativamente para melhorar a adesão.
Até à data, a quimioterapia para o carcinoma mamário metástático tem sido administrada principalmente por via intravenosa. No entanto, as formas de dosagem oral de medicamentos citostáticos, se utilizados correctamente, podem ser associados a benefícios significativos para os doentes, prestadores de cuidados de saúde e pagadores. A preferência dos pacientes e a sua capacidade de implementar a terapia prescrita são factores importantes, bem como a biodisponibilidade e a relação custo-eficácia.
Citostáticos orais como a ciclofosfamida, metotrexato, vinorelbina e capecitabina têm sido utilizados durante muito tempo na terapia do carcinoma metastático da mama, sendo a capecitabina e a vinorelbina predominantemente utilizadas nos últimos anos. A selecção representativa de dados convincentes sobre quimioterapia oral poderia no futuro contribuir para persuadir os médicos oncologicamente activos a ultrapassar as reservas ainda generalizadas contra esta forma de terapia. Este artigo destina-se a fornecer uma visão geral das características especiais de indicação, selecção de pacientes e aplicação.
Desvantagens da quimioterapia intravenosa
Com 5518 novos casos e 1376 mortes por ano, o carcinoma da mama é o cancro mais comum nas mulheres na Suíça [1]. Na situação metastática, a mediana da sobrevivência global é de 20-28 meses [2]. A terapia paliativa no cancro da mama metastásico implica a restauração e manutenção da qualidade de vida, bem como a redução das queixas relacionadas com o tumor. O prolongamento da vida que pode ser alcançado através de uma terapia optimizada deve ser apenas um objectivo terapêutico secundário.
Apesar dos abundantes dados de estudo sobre a eficácia e praticabilidade dos citostáticos orais, predominam as prescrições de citostáticos intravenosos. As razões para tal são preocupações por parte dos oncologistas que tratam os oncologistas relativamente à aderência, biodisponibilidade e benefício terapêutico para os doentes [3]. O uso de quimioterapia intravenosa está associado a um esforço adicional considerável para o paciente, o prestador de serviços e o prestador de serviços. Devido ao empenho em clínicas ambulatórias oncológicas, os pacientes passam uma proporção não negligenciável do seu tempo em instalações médicas para aplicação citostática, o que, por sua vez, tem influência na qualidade de vida. A prescrição médica de citostáticos para aplicações i.v. está associada ao esforço administrativo, dependendo da instalação médica. Além disso, os recursos adicionais do sistema de saúde devem ser utilizados através da utilização de enfermeiros e locais de aplicação [4]. As vantagens da quimioterapia oral devem, portanto, ser incluídas no processo de tomada de decisão ao ponderar e seleccionar a quimioterapia. As preparações vinorelbina oral e capecitabina serão examinadas mais detalhadamente a seguir no que diz respeito às suas propriedades e modo de aplicação.
Vinorelbina oral
A vinorelbina oral (Navelbine Oral®) é uma substância comprovada com um lugar firme na terapia do carcinoma metastásico da mama. A vinorelbina pertence aos alcalóides da vinca e inibe a mitose por inibir a polimerização da tubulina. Pode ser utilizado como monosubstância, mas também em combinação com capecitabina ou trastuzumab (Herceptin®). A Vonorelbine tem uma taxa de resposta de 26% mesmo após pré-tratamento com antraciclinas e taxanas [5]. Os efeitos secundários mais comuns da vonorelbina oral são náuseas, vómitos e mielo-toxicidade. Isto requer o uso rotineiro de terapia antiemética (por exemplo, antagonistas HT3) e monitorização regular por meio de contagem diferencial de sangue. A náusea também pode ser evitada tomando as pastilhas após uma pequena refeição.
Capecitabina
Capecitabina (Xeloda®) é um antimetabolito que é transformado intracelularmente como um pró-fármaco pela timidina fosforilase à sua substância activa 5-fluorouacil (5-FU). Para além da monoterapia, existe a opção de combinação com taxanos, vinorelbina e – no HER2-overexpressor do carcinoma da mama – com trastuzumab ou lapatinibe. A combinação com o inibidor de angiogénese bevacizumab (Avastin®) também é possível. Em pacientes que foram pré-tratados com taxanas ou antraciclinas, podem ser alcançadas taxas de resposta até 30% com monoterapia capecitabina [6]. Os efeitos secundários mais comuns incluem queixas gastrointestinais como a diarreia e a síndrome do pé-mão (eritrodisestesia palmar-plantar, PPE). Uma vantagem é que quase não é de esperar qualquer mielototoxicidade, e é por isso que a capecitabina prova ser um parceiro favorável na terapia combinada. Tal como com a vinorelbina, a alopecia não ocorre com a capecitabina.
Dosagem e curso da terapia
A capecitabina é administrada numa dose de 2500 mg/m2 de superfície corporal, dividida em duas doses diárias, nos dias 1-14. Segue-se um intervalo de uma semana entre a terapia e o 21º dia. No dia 22, começa o ciclo seguinte. Os pacientes recebem uma consulta de três em três semanas, na qual o estado geral e o hemograma são avaliados. Os comprimidos estão disponíveis em doses únicas de 500 mg ou 150 mg cada. No interesse de simplificar a terapia, devem ser prescritos preferencialmente 500 mg comprimidos. A dose calculada deve ser arredondada para baixo. O número de ciclos depende da resposta à terapia e da tolerabilidade. As agendas terapêuticas especiais ajudam na ingestão diária estruturada de comprimidos e simplificam a comunicação entre médico e paciente durante as consultas tri-semanais.
A vinorelbina oral é inicialmente tomada na dose 60 mg/m2 de superfície corporal uma vez por semana. Se bem tolerado, pode ser feito um aumento da dose para 80 mg/m2 a partir da quarta semana. Os comprimidos estão disponíveis nas dosagens 20 mg e 30 mg. As consultas médicas, incluindo a contagem diferencial de sangue, devem ser feitas semanalmente. À semelhança da capecitabina, o número de ciclos é determinado pela resposta e tolerabilidade. Existe também um passaporte terapêutico para a vinorelbina. A terapia metronómica (50 mg absolutos nos dias 1, 3 e 5 todas as semanas) ainda é controversa e ainda não foi aprovada sob esta forma na Suíça [7].
Gestão de efeitos colaterais
Para a profilaxia ou terapia de náuseas e vómitos, recomenda-se a administração de um antagonista HT3 (por exemplo, granisetron 2× 4 mg) nos dias 2 e 3 após a ingestão como coadjuvante da vinorelbina oral. Os EPI sob capecitabina devem ser tratados generosamente, mesmo nas fases iniciais, com creme gorduroso contendo ureia. Toxicidades mais graves com vinorelbina oral e capecitabina requerem geralmente uma pausa na terapia até que os sintomas tenham regredido. O recomeço da terapia com vinorelbina oral deve ser iniciado com min. 60 mg/m2 de superfície corporal. A dose deve ser de novo aumentada rapidamente. Para capecitabina, é utilizado um regime adaptado à toxicidade para o recomeço do tratamento (tab. 1).
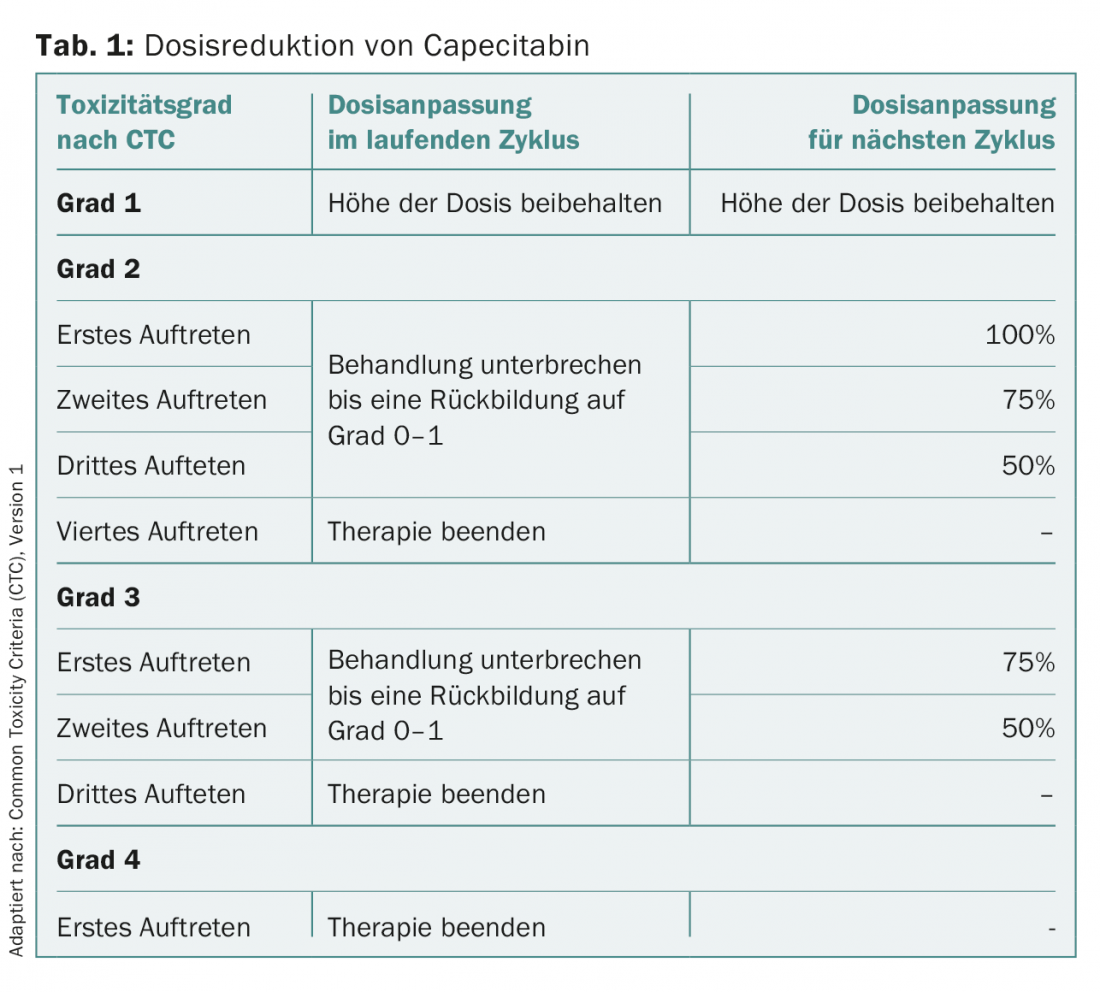
Selecção de doentes adequados
O uso correcto de drogas citostáticas orais não é apenas da responsabilidade dos terapeutas, mas também depende do comportamento dos pacientes. A utilização correcta é o factor chave para alcançar o máximo benefício terapêutico para o paciente. A tomada da dose prescrita no momento prescrito e a comunicação precisa dos efeitos secundários observados só podem ser garantidos se os pacientes concordarem com a terapia prescrita e estiverem convencidos do sentido da terapia. Isto inclui a vontade da paciente de aderir às recomendações terapêuticas acordadas com o médico, na medida das suas possibilidades, e um comportamento concordante do paciente e do médico. É assim o princípio do maior denominador comum, também referido como “tomada de decisão partilhada” na língua anglo-americana. Este processo serve para estabilizar o paciente. São vistos como maduros – também com as suas ambivalências – assumem um papel activo dentro de um processo (de tratamento) e tornam-se especialistas treinados para a sua doença. As suas decisões são aceites.
Prever a adesão é uma das medidas pré-terapêuticas mais importantes para decidir a favor ou contra a quimioterapia oral. Para além dos doentes aderentes (Aderentes), existem Aderentes Parciais, Utilizadores Excessivos, Utilizadores Eráticos, Desistentes Parciais e Desistentes. Os aderentes exclusivos tomarão o medicamento em toda a sua extensão no momento certo, de acordo com os acordos, enquanto os utilizadores em excesso tomarão doses demasiado elevadas na esperança de aumentar o efeito e, assim, correrão o risco de efeitos secundários perigosos. O consumo de medicamentos dos utilizadores Eratic está sujeito a fortes flutuações no ciclo terapêutico com efeitos negativos sobre o prognóstico.
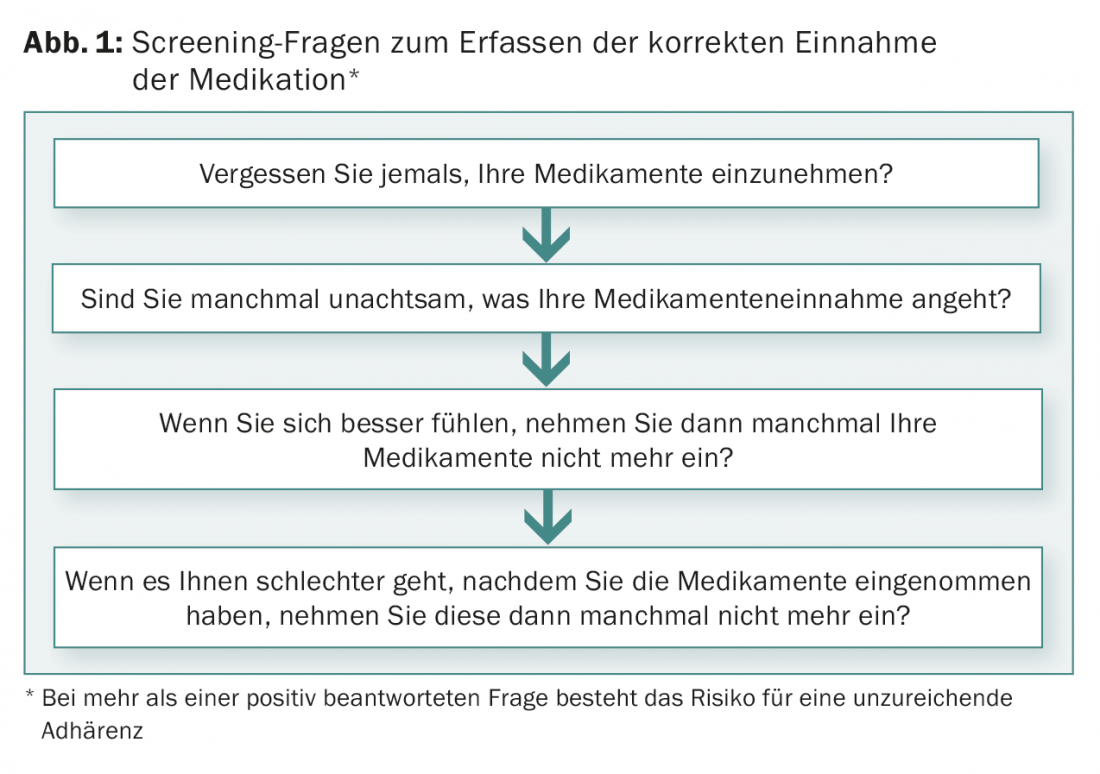
Estão disponíveis vários testes para avaliação pré-terapêutica da aderência. Um procedimento simples consiste na formulação de quatro perguntas (Fig. 1). Se uma destas perguntas for respondida afirmativamente, é altamente provável que haja uma falta de adesão [8].
Resumo
A quimioterapia oral tem sido parte integrante do espectro do tratamento medicamentoso do carcinoma metastático da mama durante vários anos. Há provas clínicas suficientes de eficácia tanto em combinação com outros agentes como em monoterapia; isto também se aplica às linhas avançadas de terapia. As vantagens da aplicação oral são o tempo reduzido passado nas instalações médicas e a natureza menos invasiva da terapia. Já não são necessárias perfurações de veias ou portos, e com elas a dor e o risco de extravasamento ou infecção associados. Apesar da doença grave, os pacientes têm mais autonomia e, portanto, também mais vida quotidiana e normalidade. A baixa procura de recursos humanos e espaciais reflecte-se na redução dos custos terapêuticos para o sistema de saúde.
Um pré-requisito importante é a adesão do paciente, que deve ser verificada e mantida com esclarecimentos pré-terapêuticos, consultas regulares, comunicação simpática do paciente e utilização completa de diários terapêuticos.
Literatura:
- www.bfs.admin.ch/bfs/portal/de/index/themen/14/02/05/key/02/05.html, incidência estimada com base nos dados dos 12 registos de cancro SG/AR/AI, BS/BL, ZH/ZG, GE, VD, NE, VS, GR/GL, TI, JU, FR, LU/OW/NW/UR.
- Gerber B, Freund M, Reimer T: Recurrent Breast Cancer: Treatment Strategies for Maintaining and Prolonging Good Quality of Life (Câncer de mama recorrente: Estratégias de tratamento para manter e prolongar a boa qualidade de vida). Dtsch Arztebl Int 2010; 107(6): 85-91.
- O’Neill VJ, Twelves CJ: Tratamento do cancro oral: desenvolvimentos na quimioterapia e mais além. Br J Cancer 2002; 87: 933-937.
- Husseini F, et al: Capecitabine vs. Mayo Clinic and de Gramont 5-FU/LV regimens for stage III colon cancer: cost-effectiveness analysis in the French setting. Ann Oncol 2006; 17 (suppl 6): 64 (para 133).
- Martin M, et al: Gemcitabine plus vinorelbine versus vinorelbine monotherapy in patients with metastatic breast cancer previously treated with anthracyclines and taxanes: Resultados finais do ensaio da fase III do Grupo Espanhol de Investigação do Cancro da Mama (GEICAM). Lancet Oncol 2007; 8: 219-225.
- Fumoleau P, et al: Estudo multicêntrico, fase II que avalia a monoterapia capecitabina em doentes com cancro da mama metastástico antraciclínico e taxano pré-tratado. Eur J Cancer 2004; 40: 536-542.
- Briasoulis E, et al: Ensaio de selecção de doses de monoterapia metrónica de vinorelbina oral em doentes com cancro metastásico: Um estudo clínico translacional de grupo cooperativo de oncologia helénico. BMC Cancer 2013; 13: 263.
- Miaskowski C, et al: Adherence to oral endocrine therapy for breast cancer: a nursing perspective. Clin J Oncology Nursing 2008: 12(2): 213-221.
InFo ONCOLOGy & HEMATOLOGy 2016; 4(1): 19-21