Os pacientes com doença pulmonar obstrutiva crónica (DPOC) são susceptíveis a infecções pulmonares, que exacerbam significativamente os sintomas (especialmente a dispneia). No entanto, os dados epidemiológicos são praticamente inexistentes.
Os doentes com doença pulmonar obstrutiva crónica (DPOC) são susceptíveis a infecções pulmonares, que exacerbam significativamente os sintomas, especialmente a dispneia. No entanto, os dados epidemiológicos sobre tais infecções-exacerbatidas pela COPD (AECOPD) são escassos [1].
COPD (GOLD II-IV) tem uma prevalência (>40 anos) de cerca de 5,9%. Esta população de doentes experimenta cada uma entre 0,6-2,7 exacerbações agudas por ano [2]. A deterioração respiratória aguda representa um risco de mortalidade significativo para os pacientes com DPOC; cerca de 10% dos pacientes com AECOPD que são hospitalizados morrem. Na maioria dos casos (cerca de 60%), a AECOPD é desencadeada por infecções, cerca de metade das quais são virais e metade bacterianas. Em cerca de 30% dos casos, não é possível encontrar nenhum factor desencadeante. É importante lembrar que substâncias nocivas inaladas, tais como nicotina e óxidos de azoto, podem desencadear uma exacerbação.
A deterioração respiratória aguda pode, evidentemente, também ser desencadeada por outros factores, de modo que os diagnósticos diferenciais podem incluir insuficiência cardíaca, pneumotórax, derrame pleural, embolias pulmonares ou novas arritmias para além de pneumonia aguda [3]. Num estudo com 1016 doentes, os motivos de admissão hospitalar por suspeita de AECOPD foram 48% de infecções respiratórias, 26% de insuficiência cardíaca, 3% de carcinoma brônquico, 1% de embolia pulmonar, e 1% de pneumotórax [4]. As opções terapêuticas durante a AECOPD não estão actualmente normalizadas e, em alguns casos, só são eficazes numa medida limitada. Por conseguinte, a prevenção de uma exacerbação é de grande importância.
Os pacientes com DPOC com exacerbações repetidas têm uma qualidade de vida e esperança de vida reduzidas (cerca de 10% dos pacientes hospitalizados com AECOPD morrem). A prevenção de uma exacerbação pode ser conseguida, por exemplo, através de micolíticos orais e broncodilatadores. É interessante neste contexto que a gravidade de uma exacerbação seja reduzida, mas não a mortalidade [5]. As opções de imagem para AECOPD são discutidas abaixo. No entanto, um dos focos será a avaliação do risco diagnóstico da AECOPD em doentes com DPOC.
Imagiologia
Os doentes com DPOC em particular não conseguem suster a respiração por muito tempo e têm dificuldade em ficar deitados de costas. A fim de obter ainda imagens “nítidas” do tórax, a imagem deve, portanto, ser tirada o mais rapidamente possível. Duas modalidades de exame preenchem estes requisitos: raio-X e tomografia computorizada (TC). No estudo PROVIDI, as possibilidades do CT para prever a AECOPD foram investigadas em pormenor [6].
Tórax de raio-x
O exame radiológico inicial de um paciente com AECODP é um raio-X torácico, se possível na posição de pé em 2 planos [2]. Isto pode ser utilizado para excluir doenças de diagnóstico diferencial, tais como pneumonia, pneumotórax, derrame pleural ou insuficiência cardíaca. Em cerca de um quinto dos presumíveis doentes com AECOPD, o diagnóstico muda, principalmente devido à pneumonia, e consequentemente a terapia [3,7–9].
Os raios X do tórax em doentes com DPOC mostram alterações características em comparação com indivíduos saudáveis. Em particular, a hiperinflação acentuada é evidente, com baixos diafragmas, alargamento do espaço retroesternal e alargamento dos espaços intercostais. A silhueta cardíaca é normalmente bastante estreita e existe um padrão vascular pulmonar rarefeito. No decurso de uma exacerbação da infecção, há frequentemente um espessamento das paredes brônquicas, o que leva a uma ventilação significativamente reduzida das secções periféricas dos pulmões (Fig. 1).
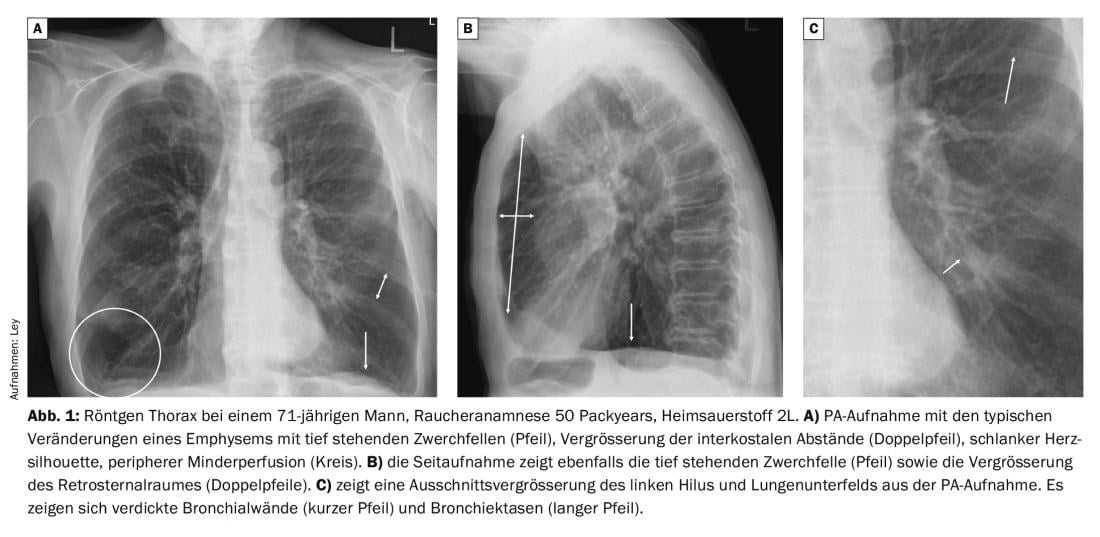
Como já foi mencionado acima, constatações relevantes como a pneumonia são encontradas em cerca de 20% dos doentes. No caso de uma infecção bacteriana típica, vê-se uma compressão bidimensional de um segmento, lóbulo ou o pulmão inteiro (Fig. 2).

Um estudo recente de doentes não hospitalizados com AECOPD mostrou uma infiltração em 20% dos casos [10]. Muitos agentes patogénicos foram identificados, por exemplo, Haemophilus e Streptococcus. Curiosamente, não houve diferenças na colonização pulmonar entre os doentes com DPOC com exacerbação e aqueles sem DPOC. Por outro lado, a pneumonia era mais frequente nos meses de Inverno. Por conseguinte, concluiu-se que as exacerbações e pneumonias em doentes com DPOC partilham desencadeadores infecciosos comuns e representam uma entidade contínua em vez de entidades separadas.
Tomografia computorizada (CT)
Uma TC do tórax com foco no parênquima pulmonar pode ser realizada sem administração de contraste intravenoso. A admissão em paragem respiratória é desejável mas nem sempre pode ser realizada por doentes com AECOPD. Por vezes, uma posição plana do supino na mesa de exames de TC é dificilmente possível, e depois manter a respiração durante 4-10 segundos (dependendo do dispositivo de TC) é também um enorme desafio para os pacientes. Quando se trata de excluir o embolismo da artéria pulmonar, a administração i.v. de KM é indispensável. Foram estabelecidas camadas de 1 mm como a espessura da camada para ambas as questões.
As alterações fenotípicas da DPOC podem ser classificadas num fenótipo de enfisema e num fenótipo respiratório [11]. A dilatação brônquica é quando o lúmen do brônquio é 110-150% do lúmen da artéria pulmonar que o acompanha. Mais de 150% é chamada ectasia. Além disso, a falta de afinação na periferia é encontrada na bronquiectasia. A bronquiectasia pode ser cilíndrica, varicosa e cística em configuração.
A parede brônquica é avaliada na razão entre o diâmetro interior e o exterior: Se a razão for 0,5-0,8, chama-se espessamento suave da parede, <0,5 denota espessamento severo da parede. Além disso, os pacientes com histórico de tabagismo têm frequentemente brônquios que são obstruídos pelo muco.
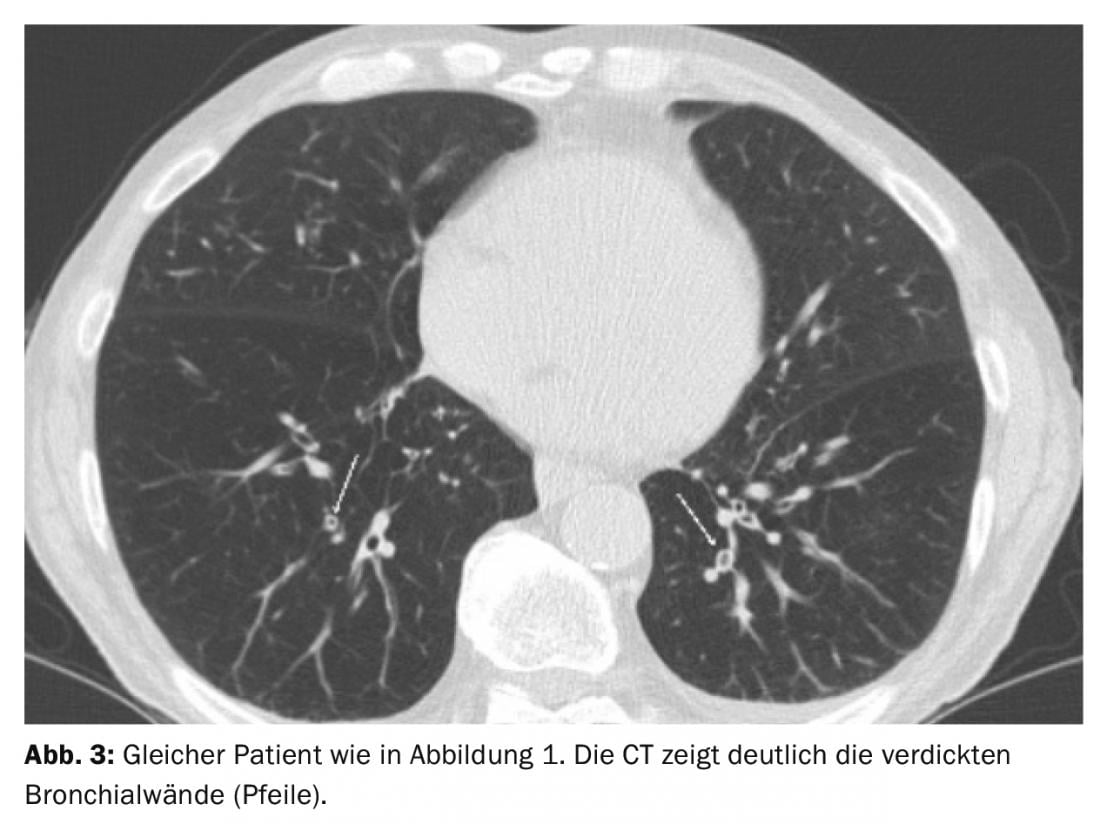
Os pacientes com um tipo de via aérea parecem particularmente susceptíveis à AECOPD. O TAC mostrou que o espessamento da parede brônquica era significativamente mais frequente na AECOPD do que no intervalo “normal” (Fig. 3) [12]. No entanto, o acordo entre os leitores para a avaliação do espessamento da parede brônquica é fraco.
Como mencionado inicialmente, a prevenção de uma exacerbação é um objectivo importante. Para tal, devem ser identificados os doentes com uma maior susceptibilidade a uma exacerbação. O Estudo COPD Gene identificou 833 pacientes que tiveram 0-1 exacerbações e 169 pacientes com mais de 2 exacerbações [13]. Isto mostrou que com cada mm de aumento da espessura da parede brônquica ao nível do segmento, a taxa de exacerbação anual aumentou num factor de 1,84. Os doentes com mais de 35% de enfisema mostraram um aumento de 1,18 vezes na taxa de exacerbação por cada 5% de aumento do enfisema. Estes dados sugerem que a fenotipagem de rotina de pacientes com DPOC usando TC é apropriada.
Para além da espessura da parede, a dilatação brônquica é também altamente relevante para a exacerbação. A bronquiectasia aumentou significativamente o risco de exacerbação (odds ratio 4,99) e foi o mais forte preditor entre vários parâmetros (Fig. 4) [14]. A detecção ou conhecimento da bronquiectasia também tem clara relevância terapêutica, como por exemplo a antibiose i.v. para P. aeroginosa pode ser indicada se a bronquiectasia estiver presente [1]. A colonização bacteriana em tais bronquiectasias durante a exacerbação sugere frequentemente patogénios atípicos, especialmente micobactérias. Foi aqui demonstrado que as micobactérias foram detectadas mais frequentemente em doentes com exacerbações pouco frequentes de DPOC do que em doentes com exacerbações frequentes [14].

Para além das vias respiratórias periféricas, as vias respiratórias centrais, traqueia e brônquios principais, desempenham também um papel importante na limitação do fluxo aéreo. Os pacientes com DPOC criam uma pressão negativa significativa na traqueia e nos brônquios principais durante a inspiração. Dois factores (individualmente ou em conjunto) levam ao colapso expiratório das vias aéreas centrais (ECAC) [15].
Com o tempo, os suportes de cartilagem podem amolecer, resultando em malacia. Esta traqueobroncomalácia tem uma prevalência de 5-10% em doentes com DPOC [16]. Além disso, há um aumento da curvatura da membranacea pars. Se isto levar a uma redução de lúmen de >50%, fala-se de um “colapso dinâmico excessivo das vias aéreas” (EDAC) (Fig. 5).
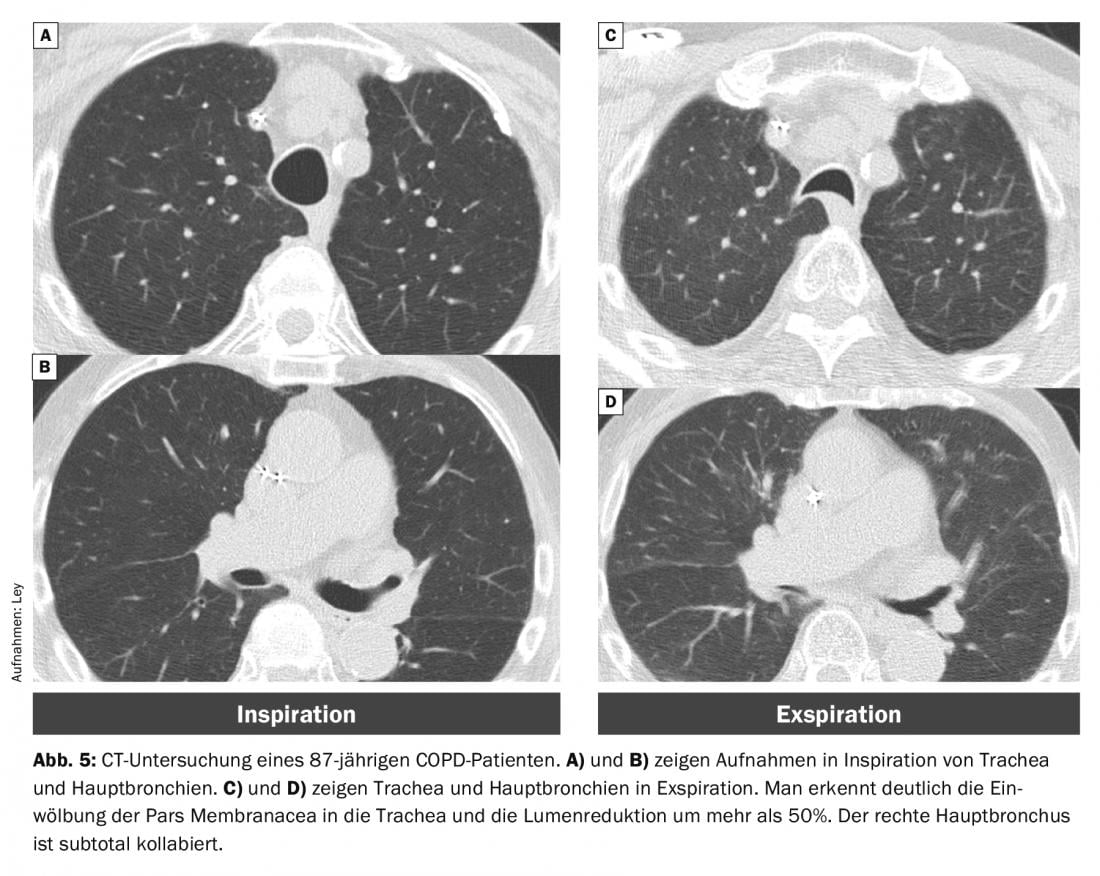
É bem conhecido que os doentes com DPOC apresentam um colapso respiratório significativamente mais elevado do que os doentes normais. No entanto, isto não desempenha um papel relevante na génese de uma exacerbação, uma vez que a instabilidade das vias aéreas não difere entre COPD estável e COPD exacerbada [15].
Contudo, também parece haver uma correlação entre a gravidade do enfisema e as exacerbações [17]. Os pacientes foram recrutados a partir de uma população de rastreio do cancro do pulmão. O fenótipo COPD do tipo enfisema ou não-emfisema foi determinado. Os doentes com enfisema fenótipo eram significativamente mais graves (previsão FEV1: 61% vs. 90%) do que os doentes com não enfisema COPD. Portanto, não é realmente surpreendente que as exacerbações fossem mais frequentes no grupo de pacientes mais gravemente doentes do que na população quase saudável.
Um efeito global é a ventilação das regiões pulmonares individuais. O hélio hiperpolarizado pode ser utilizado para visualizar a ventilação regional em ressonância magnética (MRI). Os defeitos de ventilação são regularmente encontrados em doentes com DPOC. Em doentes com DPOC ligeira a moderada, a extensão dos defeitos de ventilação foi correlacionada com o número de exacerbações [18]. Os defeitos de ventilação voltaram a estar correlacionados com a extensão da destruição parenquimatosa (enfisema) e da doença das vias aéreas – ou seja, um fenótipo misto de COPD. Uma vez que os exames de ressonância magnética de ventilação só podem ser realizados em centros individuais em todo o mundo e a avaliação do parênquima pulmonar/via aérea é limitada, foram criados mapas de ventilação utilizando a TC. Para este efeito, foram examinados conjuntos de dados inspiratórios e expiratórios de CT da coorte de Gene da COPD [19]. Utilizando um registo não-rígido, os dados foram sobrepostos. Assim, poderiam ser criados mapas de deformação regional. Surpreendentemente, os pacientes com exacerbações crescentes (≥6/ano) tinham uma ventilação mais homogénea do que os pacientes sem exacerbações.
Os conjuntos de dados de CT também oferecem a possibilidade de segmentar estruturas anatómicas, por exemplo, as vias aéreas, devido à alta resolução espacial. Estes dados segmentados podem então ser utilizados, por exemplo, para simular fluxos respiratórios e resistências regionais. 42 pacientes com DPOC foram examinados por TC durante uma exacerbação e 6-8 semanas no curso [20]. As vias respiratórias foram segmentadas a partir dos dados do CT e utilizadas para simular os fluxos aéreos. Isto mostrou que durante uma exacerbação há um aumento significativo da resistência das vias aéreas centrais e periféricas. Foi interessante que especialmente a diminuição da resistência das vias aéreas periféricas foi associada à recuperação funcional. Portanto, a inflamação excessiva das vias respiratórias periféricas parece ser um factor crucial no desenvolvimento de uma exacerbação (foram estudadas as vias respiratórias da 4ª-8ª geração brônquica). Isto é, estas regiões devem ser alcançadas terapeuticamente, mas como os fluxos respiratórios são significativamente alterados durante uma exacerbação, devem ser administrados medicamentos orais ou agentes inalatórios de diâmetro extra-pequeno.
Excursus Pulmonary Hypertension
Sabe-se que a DPOC não afecta apenas as pequenas vias respiratórias e alvéolos, mas também as pequenas artérias pulmonares (diâmetro <500 µm). Estas alterações vasculares também se encontram em doentes com DPOC moderada e em fumadores com função pulmonar normal. Por conseguinte, pode esperar-se que a vasculopatia ocorra nas fases iniciais da doença respiratória associada ao fumador. Aproximadamente 4% dos pacientes com DPOC têm hipertensão pulmonar (PH), PH-COPD está listado no grupo 3 da classificação da OMS de PH [21]. Num grande estudo com mais de 54.000 participantes, o PH-COPD foi um factor de risco significativo para o tratamento e mortalidade hospitalar da AECOPD. Por outro lado, um estudo ecocardiográfico mostrou o efeito da exacerbação da função cardíaca direita: Durante a exacerbação o PASP estimado foi de 40 mmHg e após a convalescença de 29 mmHg [22]. No entanto, a ecocardiografia é por vezes difícil na avaliação da PASP em pacientes com DPOC, e o padrão de referência, a cateterização invasiva do coração direito, não pode ser realizada em todos os pacientes com DPOC. Mais uma vez, a TC ajuda com uma medida simples: uma relação entre o diâmetro da artéria pulmonar e a aorta ascendente >1:1 foi claramente associada à ocorrência de AECOPD (odds ratio 4.78) (Fig. 6) [23]. Especificamente, os pacientes do Estudo Gene da DPOC com PA:A ratio >1 tiveram uma exacerbação em 53% dos casos. O diâmetro da artéria pulmonar pode ser determinado em fatias axiais, imediatamente antes da bifurcação [24].

Mensagens Take-Home
- Se houver suspeita de DPOC exacerbada, o raio-X torácico é um método importante para identificar diagnósticos diferenciais.
- A avaliação do estado e caracterização da DPOC por tomografia computorizada é uma investigação útil para determinar o risco individual de exacerbação.
- Os pacientes com um fenótipo de vias aéreas de COPD (espessamento da parede e dilatação brônquica) são especialmente propensos a exacerbar.
Literatura:
- Hoffken G, Lorenz J, Kern W, et al: (2005) [S3-guideline on ambulant acquired pneumonia and deep airway infections]. Pneumologia 59: 612-664.
- Lange CG, Scheuerer B, Zabel P: (2004) [Acute exacerbation of COPD]. Internista (Berl) 45: 527-538.
- McCrory DC, Brown C, Gelfand SE, Bach PB: (2001) Management of acute exacerbations of COPD: a summary and appraisal of published evidence. Peito 119: 1190-1209.
- Connors AF, Jr, Dawson NV, Thomas C, et al: (1996) Resultados após a exacerbação aguda da doença pulmonar obstrutiva crónica grave. Os investigadores do SUPPORT Study to Understandstand Prognoses and Preferences for Outcomes and Risks of Treatments). Am J Respir Criteria Care Med 154: 959-967
- Wedzicha JA, Calverley PMA, Albert RK, et al: (2017) Prevention of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J 50.
- Jairam PM, van der Graaf Y, Lammers JW, et al: (2015) Descobertas acidentais sobre imagens de tomografia computorizada do tórax estão associadas ao aumento das exacerbações da DPOC e da mortalidade. Tórax 70: 725-731.
- Emerman CL, Cydulka RK: (1993) Evaluation of highyield criteria for chest radiography in acute exacerbation of chronic obstructive pulmonary disease. Ann Emerg Med 22: 680-684
- Snow V, Lascher S, Mottur-Pilson C: (2001) The evidence base for management of acute exacerbations of COPD: clinical practice guideline, part 1. Chest 119: 1185-1189.
- Soto FJ, Varkey B: (2003) Evidence-based approach to acute exacerbations of COPD. Curr Opinião Pulm Med 9:117-124
- Williams NP, Ostridge K, Devaster JM, et al: (2018) Impact of radiologically stratified exacerbations: insights into pneumonia aetiology in COPD. Respir Res 19: 143.
- Lynch DA, Austin JH, Hogg JC et al (2015) CT-Definable Subtypes of Chronic Obstructive Pulmonary Disease: A Statement of the Fleischner Society. Radiologia. 10.1148/radiol.2015141579:141579
- Hackx M, Ghaye B, Coche E, et al: (2015) Grave exacerbação da COPD: características do CT. Copd 12: 38-45.
- Han MK, Kazerooni EA, Lynch DA, et al: (2011) Chronic Obstructive pulmonary disease exacerbations in the COPDGene study: associated radiologic phenotypes. Radiologia 261: 274-282.
- Kawamatawong T, Onnipa J, Suwatanapongched T (2018) Relação entre a presença de bronquiectasias e exacerbação aguda em doentes tailandeses com DPOC. Int J Chron Obstruct Pulmon Dis 13: 761-769
- Leong P, Tran A, Rangaswamy J, et al: (2017) Colapso expiratório da via aérea central em COPD estável e durante as exacerbações. Respir Res 18:163
- Patel R, Irugulapati L, Patel V, et al: (2009) The Prevalence of Tracheobronchomalacia in Patients with Asthma or Chronic Obstructive Pulmonary Disease. The Internet Journal of Pulmonary Medicine 12: 1-5.
- Barros MC, Hochhegger B, Altmayer S, et al: (2018) Quantitative computed tomography phenotypes, spirometric parameters, and episodes of exacerbation in heavy smokers: An analysis from South America. PLoS One 13: e0205273.
- Kirby M, Pike D, Coxson HO, et al: (2014) Hyperpolarized (3)He defeitos de ventilação usados para prever exacerbações pulmonares em doença pulmonar obstrutiva crónica ligeira a moderada. Radiologia 273: 887-896.
- Bragman FJ, McClelland JR, Modat M, et al: (2014) Análise multiescala de características de imagem e a sua utilização no estudo de fenótipos susceptíveis de exacerbar a exacerbação da COPD. Med Image Computing Assist Interv 17: 417-424.
- Hajian B, De Backer J, Vos W, et al.: (2018) Alterações na ventilação-perfusão durante e após uma exacerbação da COPD: uma avaliação usando modelação dinâmica de fluidos. Int J Chron Obstruct Pulmon Dis 13: 833-842.
- Medrek SK, Sharafkhaneh A, Spiegelman AM, et al: (2017) A admissão para a Exacerbation COPD está associada ao Diagnóstico Clínico da Hipertensão Pulmonar: Resultados de um Estudo Retrospectivo Longitudinal de uma População de Veteranos. Copd 14: 484-489.
- Ozben B, Eryuksel E, Tanrikulu AM, et al.: (2015) A exacerbação aguda prejudica a função ventricular direita em pacientes com DPOC. Hellenic J Cardiol 56: 324-331.
- Wells JM, Washko GR, Han MK, et al: (2012) Alargamento arterial pulmonar e exacerbações agudas da DPOC. N Engl J Med 367: 913-921.
- Rho JY, Lynch DA, Suh YJ, et al: (2018) Medições CT da vasculatura pulmonar central como preditores de grave exacerbação na DPOC. Medicina (Baltimore) 97: e9542.
- Vogelmeier C, Buhl R, Burghuber O, et al.: (2018) S2k-Leitlinie zur Diagnostik und Therapie von Patienten mit chronisch obstruktiver Bronchitis und Lungenemphysem (COPD). AWMF online.
InFo PNEUMOLOGIA & ALERGOLOGIA 2019; 1(2): 10-14.