A anemia é um factor de risco para a morbidade e mortalidade materna e fetal. A anemia por deficiência de ferro ligeira e a deficiência de ferro sem anemia podem ser tratadas peroralmente durante a gravidez. Intraventualmente, Ferinject® é utilizado como padrão.
A anemia é a doença mais comum na gravidez e o puerpério. A incidência de anemia no início da gravidez na Suíça é de cerca de 18,5% [1]. Até 6,2% têm anemia por deficiência de ferro e 12,3% das mulheres têm anemia de outras causas [1]. Apesar do bom estado nutricional na Suíça, até 32% de todas as mulheres grávidas têm uma deficiência de ferro devido à redução do ferro de armazenamento antes da gravidez e à absorção limitada de ferro. Outra causa importante de anemia é a hemoglobinopatia. A migração na Europa levou a um aumento significativo de hemoglobinopatias, talassaemias e anemias infecciosas na Suíça.
Definição de anemia na gravidez e pós-parto
Segundo a Organização Mundial de Saúde (OMS), “anemia na gravidez” é definida como hemoglobina (Hb) inferior a 110 g/l durante toda a gravidez. Os Centros de Controlo de Doenças (CDC) definem “anemia na gravidez” como Hb abaixo de 110 g/l no primeiro e terceiro trimestres e abaixo de 105 g/l no segundo trimestre [2]. Os diferentes valores limiares podem ser explicados pelo aumento da hemodiluição no segundo trimestre. É feita uma distinção entre anemia de gravidez leve (Hb 100-110 g/l), moderada (Hb 80-100 g/l) e grave (Hb <80 g/l) [2]. Segundo a OMS, fala-se de uma “deficiência de ferro sem anemia” se o valor da ferritina for inferior a 15 μg/l e o valor da hemoglobina estiver dentro da norma. “Anemia pós-parto” é definida como Hb <110 g/l na primeira semana após o nascimento e Hb <120 g/l a partir da segunda semana após o nascimento.
Diagnósticos e diagnósticos diferenciais
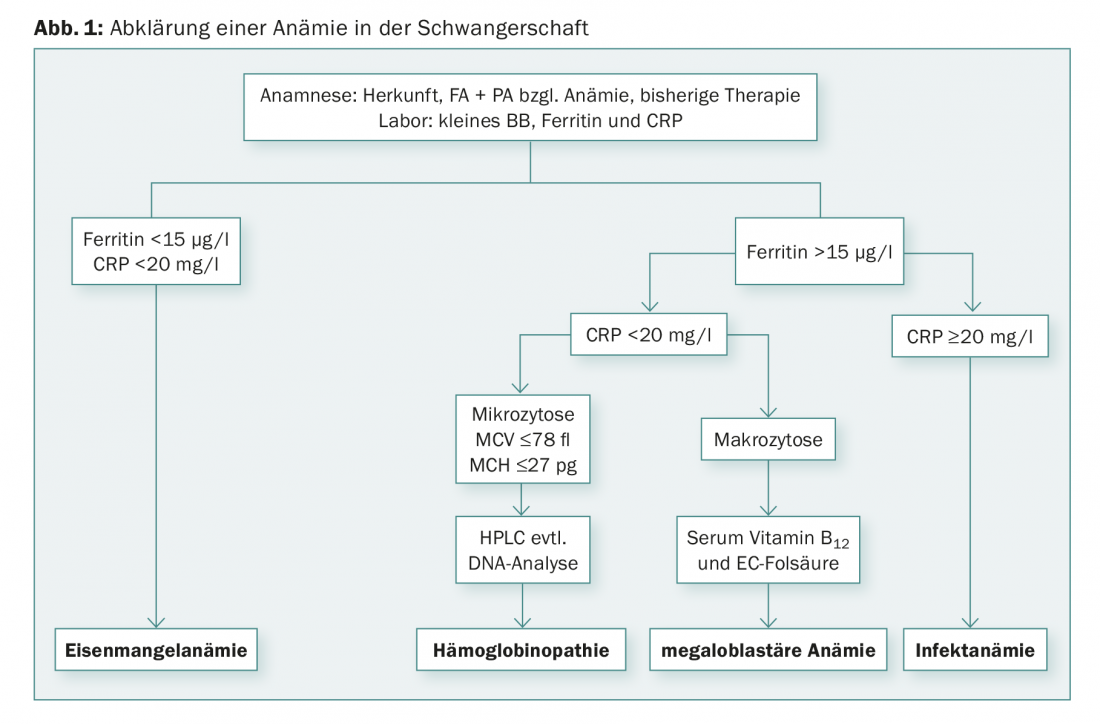
O primeiro exame é o chamado pequeno hemograma. Classicamente, a anemia é classificada com base no volume corpuscular médio (MCV). Em termos de diagnóstico diferencial, falamos de microcítica (MCV reduzido), macrocítica (MCV aumentado) e anemias normocíticas. Para o diagnóstico diferencial de anemia, CRP, ferritina, ácido fólico e vitamina B12 devem ser determinados (Fig. 1) . O actual “padrão de ouro” para detectar estados de deficiência de ferro é a determinação dos níveis de ferritina no plasma, que se correlaciona bem com as reservas de ferro. Um valor de ferritina <15 µg/l é prova de uma deficiência de ferro, independente do valor de hemoglobina [3,4]. O rastreio por determinação da ferritina é recomendado no primeiro trimestre. Se os valores de ferritina estiverem na gama normal, uma deficiência de ferro pode ser praticamente excluída, a menos que se suspeite de uma infecção ao mesmo tempo. Neste caso, os níveis de ferritina podem ser falsamente normais, uma vez que a apferritina, semelhante à proteína C-reactiva, é uma proteína de fase aguda e aumenta durante as infecções, bem como as reacções inflamatórias (por exemplo, pós-operatórias). Em situações clínicas com CRP elevado, a deficiência de ferro pode ser detectada utilizando o receptor (elevado) de transferrina solúvel. A macrocitose significativa (MCV de >100 fl) indica a presença de anemia megaloblástica. A maioria das anemias megaloblásticas na gravidez deve-se à deficiência de ácido fólico, enquanto que as anemias por deficiência de vitamina B12 são menos comuns.
Se houver microcitose marcada no hemograma, ou seja, um MCV <75 fl, um MCH <25 pg ou uma percentagem de microcitos de >15%, com ferritina normal e CRP normal, cromatografia de Hb ou electroforese de Hb deve ser realizada para excluir β-talassemia e hemoglobinopatia [5,6]. O diagnóstico de β-talassemia é feito através da determinação do HbA2, cuja percentagem é aumentada como compensação pela falta de β-correntes (>3,5%). Da mesma forma, a fracção HbF pode ser elevada (não obrigatória). No entanto, se a deficiência de ferro estiver presente ao mesmo tempo, a percentagem de HbA2 pode ser inferior. Pacientes com α-talassemia têm cromatografia Hb normal; o diagnóstico é feito por testes genéticos depois de excluir outras causas de anemia microcítica. Se a talassemia ou hemoglobinopatia for conhecida, o parceiro deve também ser esclarecido a fim de excluir um risco de talassemia homozigotos infantis e hemoglobinopatia. Se ambos os parceiros forem portadores heterozigotos para talassemia ou hemoglobinopatia, é indicado o diagnóstico pré-natal no sentido de amniocentese ou amostragem de vilosidades coriónicas.
Significado clínico
Os riscos maternos e fetais no contexto da anemia por deficiência de ferro devem estar relacionados não só com o grau de anemia e a idade gestacional, mas também com o grau de esgotamento das reservas de ferro [7]. As possíveis consequências da anemia por deficiência de ferro incluem sintomas maternos (palidez, fadiga, lassitude, tontura, dores de cabeça), redução do stress cardiovascular (palpitações, dispneia, hipotensão), aumento do risco de virose, infecções bacterianas e parasitárias, abrupção prematura da placenta, redução das reservas sanguíneas à nascença e, assim, aumento do risco de hemorragia pós-parto e aumento do risco de sintomas pós-parto como fadiga, problemas de amamentação e depressão. (Resumo 1). O feto está em risco aumentado de restrição do crescimento intra-uterino, morte amniótica intra-uterina, nascimento pré-termo, morbilidade neonatal em geral, e atraso do desenvolvimento psicomotor e cognitivo.

Terapia da anemia na gravidez
A terapia depende da causa da anemia. No caso de deficiência de ferro ou de anemia ligeira por deficiência de ferro, as preparações orais de ferro devem continuar a ser o meio de primeira escolha; excepto em doentes que necessitam de ser tratados com eritropoietina ou que sofrem de doença inflamatória intestinal crónica [8]. Na terapia, são utilizados principalmente preparados de ferro II e ferro III por via oral. Estes diferem em tolerabilidade, que pode variar de paciente para paciente. Uma boa informação sobre possíveis efeitos secundários e recomendações precisas de ingestão pode ser útil para melhorar o cumprimento, que normalmente é deficiente. O tratamento com ferro oral é barato e eficaz se seguido rigorosamente e durante um período de tempo suficientemente longo. No entanto, um longo período de tratamento devido à baixa taxa de absorção, bem como a ocorrência de efeitos secundários, prejudica a adesão disciplinada a tal terapia.
Se a terapia com ferro oral não for bem sucedida ou não for tolerada pelo paciente, mudar para o tratamento com ferro intravenoso. Outras indicações para a terapia com ferro intravenoso na gravidez incluem: má adesão, anemia grave, necessidade de altos níveis de hemoglobina periparto ou um rápido aumento da hemoglobina (idade gestacional avançada, expectativa de hemorragia periparto, por exemplo, placenta praevia, distensão uterina, grande fibroma uterino, coagulopatia e Testemunhas de Jeová) (visão geral 2).
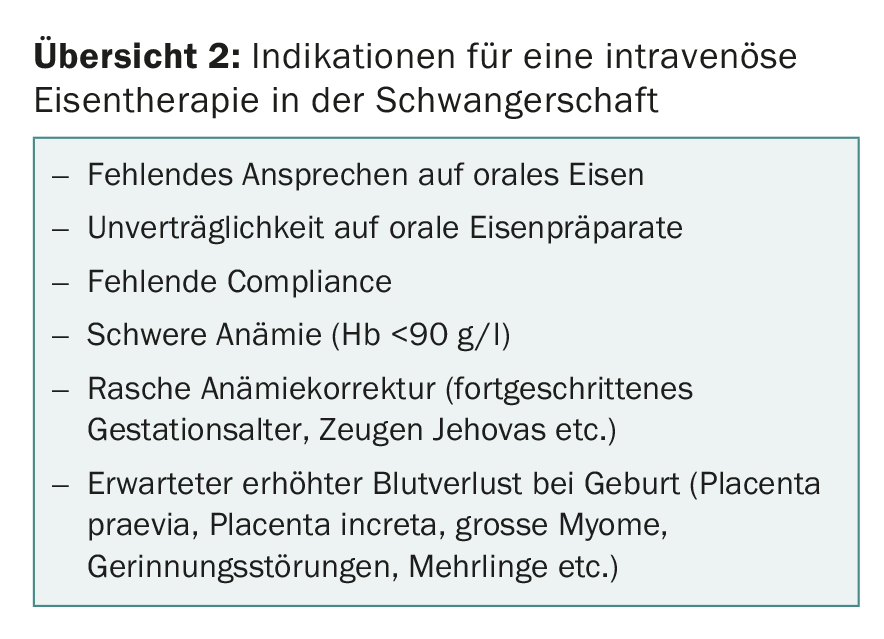
Uma vez que os vários estudos demonstraram que evitar transfusões de sangue perioperatórias e pós-operatórias melhora a morbilidade e mortalidade, a terapia com doses elevadas de ferro intravenoso deve ser sempre considerada no final da gravidez em secções planeadas com perda de sangue esperada elevada (placenta praevia, placenta increta, grandes fibróides, etc.).
A administração de ferro intravenoso está contra-indicada no primeiro trimestre. Actualmente, a terapia padrão do ferro intravenoso na gravidez e pós-parto é a carboximaltose de ferro (Ferinject®) [9,10]. Os dados mostram que a administração intravenosa de carboximaltose férrica (Ferinject®) no segundo e terceiro trimestres de gravidez é tão segura como a sacarose ferrosa (Venofer®) em termos de efeitos secundários maternos e é melhor tolerada em doses mais elevadas. As reacções de intolerância severa após a carboximaltose férrica não foram descritas em nenhum estudo. A dosagem é determinada em função do nível de hemoglobina e do peso corporal. Dentro de duas semanas, o aumento da hemoglobina deve ser de 10-20 g/l; se necessário, pode ser dada uma segunda infusão. O objectivo da terapia é um valor de hemoglobina de pelo menos 110 g/l. Em casos especiais, a terapia do ferro pode ser combinada com eritropoietina humana recombinante (rhEPO). Deve notar-se que se trata de um medicamento “fora de uso” e a cobertura dos custos pela companhia de seguros de saúde deve ser esclarecida antecipadamente.
Terapia da anemia pós-parto
O nadir do valor de Hb pós-parto é atingido 48 horas após a distribuição primária do volume de plasma. Basicamente, a terapia depende da gravidade da anemia e da condição da mulher em trabalho de parto. Em anemia leve (Hb 95-110 g/l), recomenda-se a terapia com ferro peroral de cerca de 80-200 mg de ferro por dia. Em caso de moderada (Hb 85-95 g/l), anemia grave (Hb <85 g/l) e intolerância à terapia com ferro peroral, recomenda-se o tratamento com ferro intravenoso como primeira escolha. Em Hb <80 g/l, a administração de rhEPO para além da carboximaltose parenteral de ferro pode ser considerada. No entanto, a evidência de eficácia adicional da rhEPO em combinação com a terapia com ferro intravenoso, em comparação com a terapia com ferro intravenoso por si só, é muito limitada. Se o Hb for <60 g/l, deve ser realizada uma transfusão de sangue estrangeiro dependendo dos sintomas clínicos.
Mensagens Take-Home
- A deficiência de ferro é a causa mais comum de anemia em todo o mundo. O rastreio é recomendado no primeiro trimestre por determinação da ferritina.
- Outra causa importante de anemia é a hemoglobinopatia genética. A clarificação de β-talassemia e hemoglobinopatia é realizada com cromatografia de hemoglobina ou electroforese de hemoglobina.
- A anemia, dependendo da sua gravidade, é um factor de risco significativo em termos de morbidade e mortalidade materna e fetal.
- Em primeiro lugar, a anemia ligeira por deficiência de ferro e a deficiência de ferro sem anemia durante a gravidez devem ser tratadas com terapia do ferro peroral.
- Para a terapia com ferro intravenoso na gravidez e o puerpério, é utilizada a carboximaltose padrão de ferro (Ferinject®), que é muito bem tolerada.
Literatura:
- Bencaiova G, Burkhardt T, Breymann C: Anemia – prevalência e factores de risco na gravidez. Eur J Intern Med 2012 Set; 23(6): 529-533.
- Centros de Controlo de Doenças (CDC): Critérios do CDC para a anemia nas crianças e nas mulheres em idade fértil. MMWR Morb Mortal Wkly Rep 1989; 38(22): 400-404.
- Breyman C: Anemia por deficiência de ferro na gravidez. Perito Rev Obstet Gyn 2013; 8(6): 587-596.
- Milman N: Ferro na Gravidez – Como assegurar um estatuto adequado de ferro na mãe e no filho? Ann Nutr Metab 2011; 59: 50-54.
- Merlo CM, Wuillemin WA: Prevalência e causas de anemia numa prática familiar urbana. Prática 2008; 97(5): 713-718.
- Lopez A, et al: Anemia por deficiência de ferro. Lancet 2016; 387(10021): 907-916.
- Breymann C: Anemia. In: Schneider H, Husslein P, Schneider KTM (eds.): Obstetrícia. Springer Verlag 1999; 371-385.
- Swiss Medical Board: Tratamento oral ou parenteral de deficiência de ferro. Relatório de 24 de Outubro de 2014.
- Breymann C, et al.: Carta de peritos n.º 48 do SGGG. Diagnóstico e terapia da anemia por deficiência de ferro na gravidez e no pós-parto. Versão actualizada de 11.01.2017 (substitui a Carta de Peritos n.º 22).
- Breymann C, et al.; investigadores FER-ASAP: Carboximalose férrica vs. ferro oral no tratamento de mulheres grávidas com anemia por deficiência de ferro: um ensaio internacional, aberto, randomizado e controlado (FER-ASAP). J Perinat Med 2017 24 de Maio; 45(4): 443-453.
InFo ONCOLOGY & HEMATOLOGY 2018; 6(2): 28-32.











