Quanto mais um doente com EM é limitado nas diferentes áreas da vida pela sua crescente incapacidade, pior se torna o seu estado de saúde. Na Suíça, um tratamento oral de EM, teriflunomida, acaba de ser aprovado, o que levou a uma redução significativa do risco de progressão da deficiência em dois estudos da fase III.
A 5 de Novembro de 2013, foi anunciado que a terapia com EM teriflunomida, disponível em forma oral, tinha recebido autorização de comercialização do Swissmedic sob o nome de Aubagio® [1]. Aubagio® é indicado numa dose de 14 mg/dia para o tratamento de pacientes adultos com esclerose múltipla recorrente. No congresso ECTRIMS deste ano, os peritos tinham defendido uma escolha precoce e adequada de terapia adaptada às necessidades de cada paciente. Neste contexto, é também importante considerar o factor de aderência ao tratamento ao escolher uma terapia, razão pela qual os peritos acolhem favoravelmente a disponibilidade de outras opções de tratamento, incluindo as orais.
Risco significativamente menor de progressão da deficiência
A teriflunomida inibe a proliferação de linfócitos activados ao inibir a biossíntese de novo da pirimidina [2]. Além disso, parece ter vários efeitos anti-inflamatórios e imunomoduladores. Nos dois estudos fase III TEMSO (“TEriflunomide Multiple Sclerosis Oral”) e TOWER (“Teriflunomide Oral in people With relapsing remitting multiplE scleRosis”), teriflunomide reduziu significativamente a taxa anual de recidivas e o risco de progressão da deficiência em comparação com placebo (Fig. 1) [3, 4].
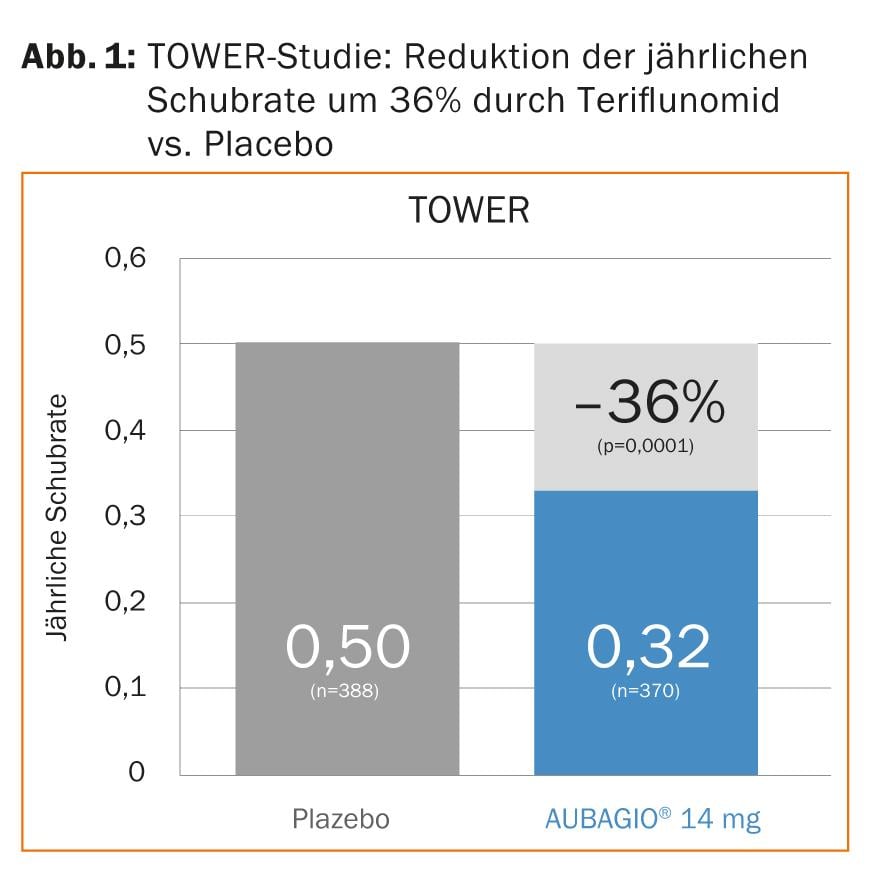
Com TEMSO e TOWER, foi assim confirmada, pela primeira vez em dois ensaios da fase III, uma redução do risco de progressão da deficiência. Uma análise conjunta dos dados de TEMSO e TOWER apresentados na ECTRIMS também mostrou que se poderiam obter resultados comparáveis em doentes com elevada actividade da doença (>2 recaídas no ano anterior) [5].
A maioria dos efeitos secundários experimentados com teriflunomida nas duas experiências foram leves a moderados, resolvidos espontaneamente e raramente levaram à descontinuação do tratamento. Os dados da fase de extensão do TEMSO estão agora disponíveis para um período de tratamento de até oito anos [6]. Confirmam a baixa taxa de recidivas contínua e a tolerabilidade do tratamento.
Nova opção de tratamento bem-vinda
Ludwig Kappos, MD, Basileia, Suíça, afirmou no comunicado de imprensa sobre a nova aprovação da teriflunomida: “O facto de a teriflunomida 14 mg ter mostrado um efeito positivo na progressão da deficiência em dois ensaios clínicos fase III sublinha a importância deste composto como uma nova opção de tratamento para doentes com EM recorrente-remitente. Como nova opção de tratamento oral, uma vez por dia, com um efeito secundário bem descrito e perfil de segurança, a teriflunomida poderia ser uma opção de tratamento atractiva para pacientes insatisfeitos com os medicamentos injectáveis tradicionais”.
Literatura:
- Comunicado de imprensa Genzyme a Sanofi Company, 5 de Novembro de 2013.
- Papadopoulou A, Kappos L, Sprenger T: Teriflunomida para terapia oral em esclerose múltipla. Especialista Rev Clin Pharmacol 2012; 5: 617-28.
- O’Connor PW, et al: Ensaio aleatório de teriflunomida oral para recidiva de esclerose múltipla. N Engl J Med 2011; 365: 1293-1303.
- Kappos L, et al: A eficácia e segurança da teriflunomida em doentes com EM recorrente: resultados de TOWER, um estudo fase III, controlado por placebo. Apresentação oral: 28º Congresso do Comité Europeu de Tratamento e Investigação em Esclerose Múltipla 2012.
- Kappos L, et al: Dados de eficácia conjunta de dois ensaios de placebo controlados por placebo fase 3 de teriflunomida oral, uma vez por dia. Ectrims 2013, Abstract P618.
- Freedman M, et al: Segurança e eficácia a longo prazo da teriflunomida em pacientes com formas recidivantes de esclerose múltipla no ensaio de extensão TEMSO. Ectrims 2013, Abstract P544.
- Miller A, et al: TOPIC principais resultados: eficácia e segurança da teriflunomida oral uma vez por dia em doentes com síndrome clinicamente isolados. Ectrims 2013, Abstract 99.
InFo Neurologia & Psiquiatria 2013; 11(6): 48











