As crianças e adolescentes afectados por psoríase e/ou artrite psoriásica sofrem muitas vezes muito. Especialmente quando os sintomas são graves, a qualidade de vida das pessoas afectadas e das suas famílias é muitas vezes significativamente reduzida. Para esta população de doentes, as terapias sistémicas eficazes e toleráveis são uma componente importante da gestão individual de doenças.
Secukinumab liga-se à interleucina-17A de citocinas (IL-17A) e inibe a interacção com o seu receptor. Desta forma, o princípio activo desdobra-se em efeitos anti-inflamatórios e imunomoduladores. Cosentyx® (secukinumab) foi aprovado para adultos na Suíça desde 2015 para o tratamento sistémico da psoríase em placas e agora também recebeu aprovação para o tratamento da artrite psoriásica. Recentemente, o anticorpo anti-IL17A demonstrou ser uma opção de tratamento eficaz e segura também em doentes pediátricos com psoríase. Nesta população de doentes, há necessidade de uma expansão do espectro do tratamento. “Viver com psoríase é um desafio e pode ser muito stressante para as crianças e jovens”, diz Randy Beranek, Presidente e CEO da Fundação Nacional de Psoríase [1]. “A expansão das opções de tratamento para esta população de doentes é um passo na direcção certa para reduzir o peso da psoríase em placas” [1].
EMA e Swissmedic: autorização de Cosentyx® para psoríase em placas juvenis
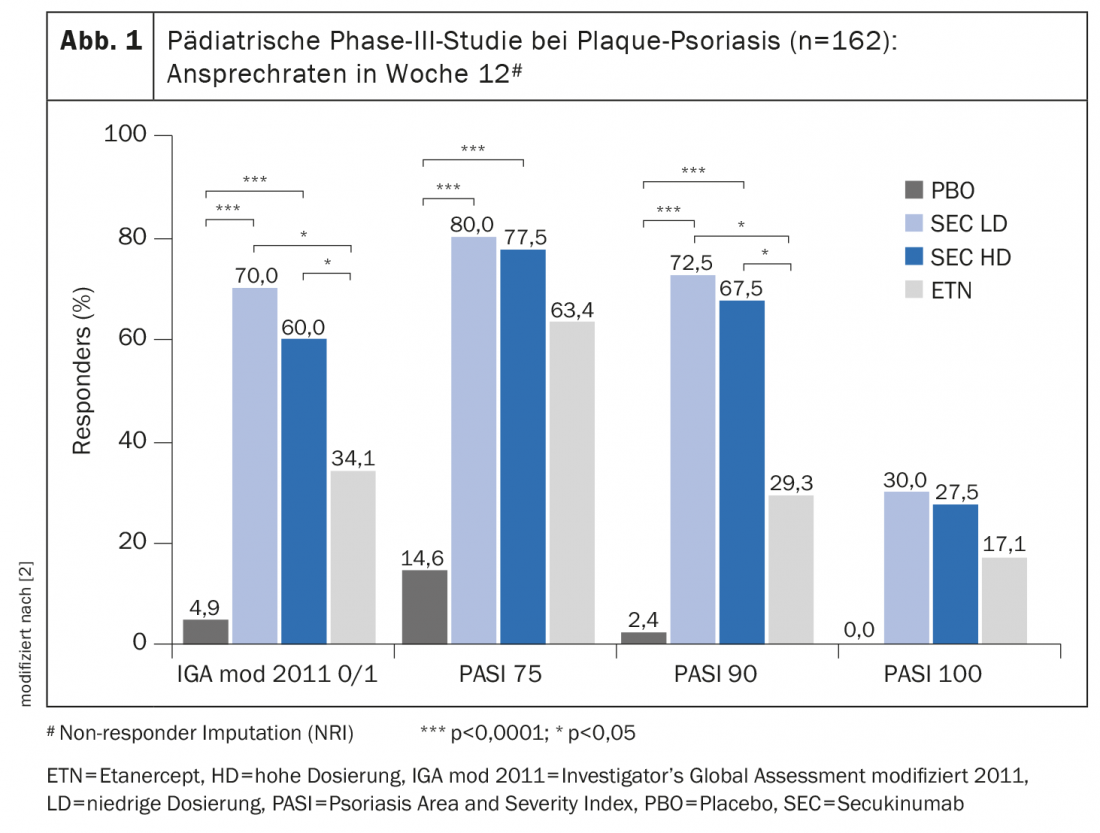
Ao tratar crianças e adolescentes, é particularmente importante alcançar o melhor equilíbrio possível entre os benefícios e os riscos de uma terapia de sistema. Secukinumab foi investigado num ensaio clínico aleatório duplo-cego (NCT02471144) em 162 crianças e adolescentes dos 6 aos <18 anos com psoríase grave em placas [2]. Secukinumab alcançou uma eficácia significativamente melhor em comparação com placebo e etanercept (caixa). A segurança do secukinumab foi investigada neste e noutro estudo da fase III. O segundo estudo é um estudo de rótulo aberto em 84 doentes (faixa etária também 6 a <18 anos) com psoríase de placa moderada a grave [1]. O perfil de segurança relatado nestes dois estudos num total de 2874 pacientes-anos foi consistente com os sinais de segurança de secukinumab relatados em pacientes adultos com psoríase em placas [3]. “No estudo pediátrico central, a maioria dos pacientes tratados com Cosentyx® conseguiu uma pele sem lesões ou quase sem lesões com um perfil de segurança consistente com os ensaios clínicos anteriores em adultos. Devido à natureza sistémica desta doença, Cosentyx® é uma opção de tratamento complementar bem-vinda para famílias que enfrentam esta condição desafiante”, disse John Browning, MD, Professor Assistente de Pediatria e Dermatologia, University of Texas Health Science Center, San Antonio (EUA) [1].

Na Suíça, a extensão da indicação para o tratamento da psoríase em placas em crianças e adolescentes com idade igual ou superior a 6 anos teve lugar em Janeiro de 2021. Esta decisão seguiu-se à aprovação pela Comissão Europeia da secukinumab para o tratamento de primeira linha da psoríase de placa moderada a grave em crianças e adolescentes alguns meses antes. A dose recomendada depende do peso corporal (Tab. 1) e é administrada como injecção subcutânea com doses iniciais às semanas 0, 1, 2, 3 e 4, seguidas de doses de manutenção mensais [3]. Cada dose de 75 mg é administrada como uma injecção subcutânea de 75 mg e a dose de 150 mg é administrada como uma injecção subcutânea de 150 mg cada.
A FDA dá luz verde para utilização na artrite psoriásica juvenil (JPsA)
A IL-17A não só é relevante para a patogénese da psoríase em placas, como também desempenha um papel patogénico fundamental na artrite psoriásica (PsA). Na Suíça, Cosentyx® (secukinumab) só foi até agora aprovado para adultos com PsA que são elegíveis para terapia do sistema [3]. Uma vez que também tinham sido alcançados êxitos notáveis de tratamento na população de doentes pediátricos com PsA em ensaios da fase clínica III, foi apresentado no ano passado à Agência Europeia de Medicamentos (EMA) um pedido de autorização de introdução no mercado para uma extensão da indicação. Nos EUA, Cosentyx® já foi aprovado pela FDA no final de 2021 para o tratamento de crianças e adolescentes com artrite relacionada com a entesite (ERA) e artrite psoriásica (PsA) [4]. No ensaio clínico central JUNIPERA, foi demonstrada uma redução do risco de recaídas agudas, bem como uma melhoria da actividade da doença tanto em relação à ERA como à PsA em doentes pediátricos durante um período de observação de 2 anos, numa comparação com placebo. O perfil de segurança era consistente com os sinais de segurança da secukinumab relatados em estudos anteriores [4,5]. Cosentyx® foi aprovado pela FDA para crianças e adolescentes com ERA e PsA, respectivamente, numa dose ajustada ao peso de 75 mg (15-50 kg pb) ou 150 mg (>50 pb), como injecção subcutânea de 4 em 4 semanas, após uma dose inicial de carga. “Os resultados do estudo JUNIPERA fase III mostram que os doentes pediátricos tratados com secukinumab mostraram uma resposta significativa durante todo o período de estudo. Esta aprovação é uma boa notícia para os pacientes que lutam com sintomas dolorosos, tais como inflamação das articulações e dedos dos pés e das mãos inchados”, disse Hermine Brunner, MD, Cincinnati Children’s Hospital (EUA) [4]. “Os sintomas de PsA e ERA podem ser angustiantes para crianças e jovens com estas condições crónicas e interferir com a sua vida diária”, disse Tiffany Westrich-Robertson, CEO, International Foundation for Autoimmune & Autoinflammatory Arthritis (AiArthritis). “É encorajador que exista agora uma opção de tratamento complementar para esta população de doentes carenciada”.
Literatura:
- “Novartis Cosentyx recebe aprovação da FDA para tratamento de crianças e adolescentes com psoríase de placa moderada a grave”, Novartis, 01.06.2021
- Bodemer C, et al: Secukinumab demonstra elevada eficácia e um perfil de segurança favorável em doentes pediátricos com psoríase crónica grave em placas: Resultados de 52 semanas de um ensaio aleatório e controlado de dupla fase 3. J Eur Acad Dermatol Venereol 2021; 35: 938-947. doi: 10.1111/jdv.1700
- Swiss Drug Compendium, https://compendium.ch, (último acesso 07.04.2022)
- “Novartis Cosentyx® recebe aprovação da FDA para o tratamento de crianças e adolescentes com artrite relacionada com entusiasmo e artrite psoriásica”, Novartis, 23.12.2021
- Menter A, et al: Joint American Academy of Dermatology-National Psoriasis Foundation guidelines of care for the management and treatment of psoriasis in pediatric patients. J Am Acad Dermatol 2020; 82(1): 161-201.
PRÁTICA DA DERMATOLOGIA 2022; 32(2): 36-37