As opções de tratamento para doentes com psoríase na infância e adolescência são muito mais limitadas em comparação com o espectro de tratamento para adultos. Mas os doentes pediátricos também podem beneficiar de um tratamento específico. Isto é demonstrado, entre outras coisas, pelos dados de ensaios clínicos correspondentes sobre secukinumab. Os dados a longo prazo da fase de extensão dos estudos de registo também foram convincentes.
A aprovação do secucinumab em doentes pediátricos pela UE baseou-se nos resultados de um programa de estudos de fase III em que o secucinumab conduziu a uma cicatrização rápida e duradoura das lesões cutâneas nos participantes do estudo com idades compreendidas entre os 6 e os <18 anos com psoríase em placas moderada a grave [1]. A biologia não só provou ser eficaz, como também foi geralmente bem tolerada [2,3]. O perfil de segurança correspondeu ao dos doentes adultos com psoríase.
| Terapia direcionada para a psoríase em placas juvenil |
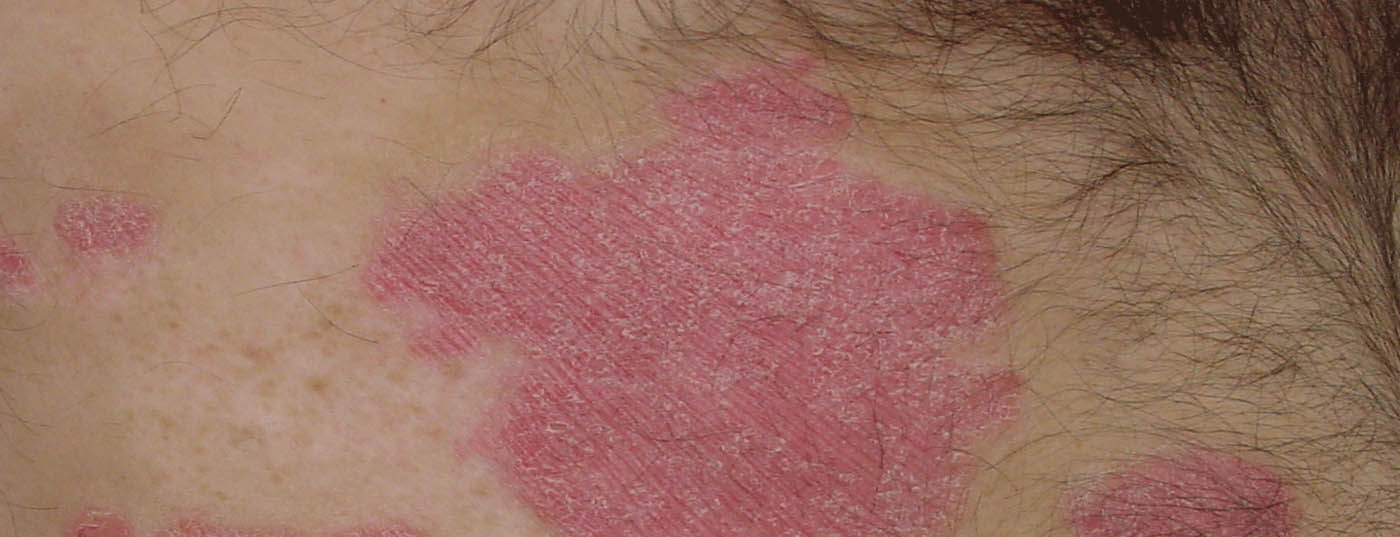
| Cerca de 1% das crianças e adolescentes são afectados pela psoríase em placas [8–12]. A psoríase está frequentemente associada a comorbilidades metabólicas, cardiovasculares, gastrointestinais e psicológicas e a uma qualidade de vida significativamente reduzida. Nos doentes pediátricos, pensa-se que o impacto da psoríase na qualidade de vida é semelhante ao da asma ou da artrite [7]. |
| Embora estejam disponíveis muitas terapêuticas eficazes e bem toleradas para o tratamento da psoríase nos adultos, as opções de tratamento para os doentes pediátricos e adolescentes são muito mais limitadas [8–12]. Vários agentes biológicos direcionados foram recentemente aprovados na UE para o tratamento da psoríase em placas pediátrica, incluindo o secukinumab (Cosentyx®), um antagonista da IL-17A cujas propriedades farmacológicas foram amplamente estudadas [13]. A IL-17 é uma citocina pró-inflamatória importante envolvida na patogénese da psoríase. A IL-17A está sobre-regulada na pele psoriática lesional e não lesional [14]. |
Resposta clínica sustentada durante um período de tratamento de 2 anos
O primeiro dos ensaios da fase III incluiu doentes pediátricos que tinham sido diagnosticados com psoríase crónica grave com pelo menos três meses de antecedência e que eram elegíveis para terapia sistémica [2]. Na linha de base, os participantes do estudo tinham uma pontuação PASI* ≥20, uma pontuação IGA# de 4 e um envolvimento da área de superfície corporal (BSA**) ≥10%. A idade média era de 13,5 anos, a maioria (77,2%) tinha ≥12 anos. O total médio da BSA foi de 40% e a duração média da psoríase em placas foi de 5,22 anos. A artrite psoriásica comorbida estava presente em 8,6% dos pacientes [2]. Os doentes foram distribuídos aleatoriamente por diferentes grupos de dosagem de acordo com o peso corporal (PC): dosagem baixa (DL): 75 mg para PC 50 kg e 150 mg para PC ≥50 kg, dosagem alta (HD): 75 mg para PC 25 kg, 150 mg para PC 25 a 50 kg e 300 mg para PC ≥50 kg. No braço de tratamento comparador, foi administrado etanercept (s.c) 0,8 mg/kg pb (até um máximo de 50 mg).
* PASI = Índice de Gravidade da Área de Psoríase
# IGA = Avaliação Global do Investigador Modificada 2011
** BSA = Área de Superfície Corporal
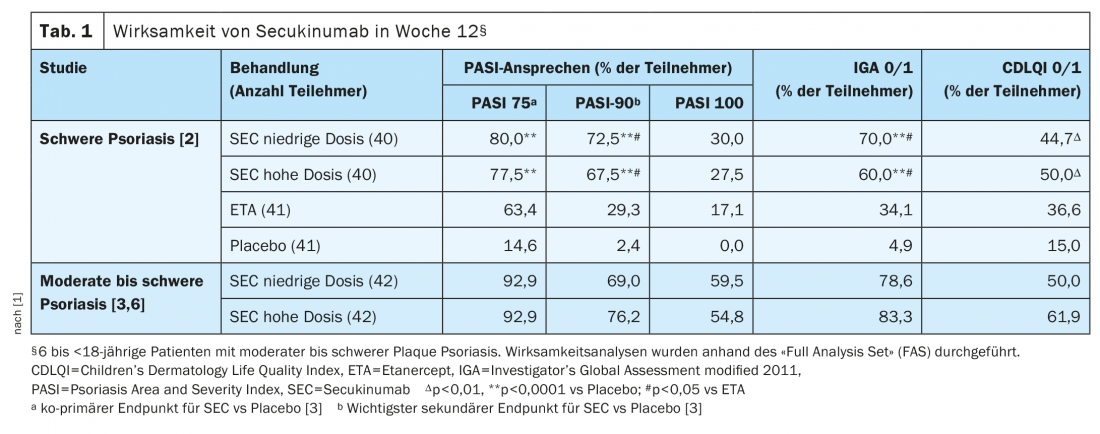
A eficácia clínica do secukinumab já era evidente na semana 4. Na semana 12, as taxas de resposta PASI-75, IGA 0/1 e PASI-90 foram significativamente mais elevadas com secukinumab em dose baixa e alta do que com placebo (Tabela 1). E em comparação com o etanercept, o secukinumab (LD e HD) mostrou taxas de resposta IGA 0/1 e PASI-90 significativamente mais elevadas e taxas de resposta PASI-75 e PASI-100 numericamente mais elevadas na semana 12 (Tab. 1). <Em doentes com um peso corporal ≥25 a 50 kg, as taxas de resposta PASI-75/90/100 e IGA 0/1 à semana 12 foram numericamente mais elevadas com secukinumab em dose elevada (n=15) do que nos grupos de secukinumab em dose mais baixa (n=17) [2]. No mesmo período, a pontuação média de PASI melhorou a partir da linha de base em 82,9% no grupo de secukinumab de dose baixa e 79,9% no grupo de secukinumab de dose alta, em comparação com 29,3% no grupo de placebo e 74,2% com etanercept [2]. Tanto as taxas de resposta PASI como a resposta IGA 0/1 persistiram com secukinumab até à semana 104. Na semana 52, a proporção com resposta PASI-75 foi numericamente mais elevada nas doses altas e baixas em comparação com o etanercept (87,5% e 87,5% vs. 68,3%).
Taxas de resposta IGA 0/1 de mais de 80% na semana 52
<18 Jahren, die seit mindestens drei Monaten von einer mittelschwer bis schwer ausgeprägten Plaque-Psoriasis betroffen waren und für eine systemische Therapie geeignet waren [3]. Einschlusskriterien waren ein PASI-Score>O segundo dos ensaios clínicos pivotais controlados e aleatorizados incluiu doentes com idades compreendidas entre os 6 e os 12 anos, pontuação IGA >3 e envolvimento da BSA >10%. Na linha de base, 72,6% dos doentes tinham psoríase moderada e 27,4% tinham psoríase grave. A idade média dos pacientes foi de 12,6 anos e 60,7% dos pacientes tinham entre 12 e <18 anos de idade. A participação média da BSA foi de 30%. Também neste estudo, os pacientes receberam doses baixas (DL) ou altas de secukinumab (HD), dependendo do peso corporal e da gravidade da doença. No subgrupo LD, os doentes com um peso corporal (PC) <50 kg foram tratados com 75 mg e aqueles com um PC ≥50 kg com 150 mg de secukinumab. No grupo HD, os doentes com um PC <25 kg receberam uma dose de secukinumab de 75 mg, os doentes com um PC entre 25 a <50 kg receberam uma dose de 150 mg e os doentes com um PC ≥50 kg receberam 300 mg.
O secukinumab foi administrado nas semanas 0, 1, 2, 3 e 4 e, posteriormente, de 4 em 4 semanas. Foram utilizados dados placebo de ensaios controlados anteriores em doentes adultos e pediátricos com psoríase em placas para as análises do ponto final primário e do ponto final secundário principal. O endpoint co-primário foi a proporção de doentes que alcançaram uma resposta PASI-75 e uma resposta IGA 0/1 na semana 12 com secukinumab em comparação com placebo (documentado a partir de estudos anteriores) [3].
Na semana 12, tanto o secukinumab em dose baixa como em dose alta foram superiores às taxas de resposta ao placebo de PASI-75, IGA 0/1 e PASI-90 documentadas em estudos anteriores. A probabilidade estimada de um efeito positivo do tratamento foi de 1 (100%) [3]. [3,4]As taxas de resposta PASI-75 e IGA 0/1 aumentaram até à semana 24 (grupos LD: 95,2% e 88,1%; grupos HD: 95,2% e 92,9%) e persistiram até à semana 52 (LD: 88,1% e 85,7%; HD: 90,5% e 83,3%). As taxas de resposta PASI 90/100 na semana 52 foram 76,2/52%/52,4% no grupo de secukinumab em baixa dose e 83,3/69%/69,0% no grupo de secukinumab em alta dose [4]. As taxas de resposta PASI90 nas semanas 32, 48 e 52 foram numericamente mais elevadas nos grupos de alta dose de secukinumab em comparação com o grupo de dose mais baixa. As taxas de resposta PASI-100 da semana 32 à semana 52 mostraram um padrão semelhante. Globalmente, o secukinumab provou ser eficaz em todos os subgrupos, independentemente do peso corporal (<25 kg, 25 a <50 kg e ≥50 kg) e da idade (6 a <12 anos e 12 a <18 anos) [5].
| Cosentyx® para doentes pediátricos: Alargamento do espetro terapêutico |
| O secukinumab (Cosentyx®) demonstrou ser um tratamento eficaz para crianças e adolescentes com psoríase em placas moderada a grave, com uma tolerabilidade geralmente boa. É uma adição valiosa às opções de tratamento limitadas para esta população de doentes e recebeu a aprovação da EMA em 2020. |
| As terapêuticas dirigidas com produtos biológicos oferecem várias vantagens em relação às terapêuticas sistémicas convencionais, incluindo uma dosagem menos frequente, uma maior eficácia e uma menor necessidade de monitorização laboratorial. |
| Tal como outros medicamentos biológicos aprovados para a psoríase vulgar pediátrica, o secukinumab é administrado por injeção subcutânea.
Ao contrário do etanercept, que é administrado uma vez por semana, e do adalimumab, que é administrado de 2 em 2 semanas, o intervalo de dose do secukinumab na terapêutica de manutenção é de 4 semanas. A administração menos frequente e a possibilidade de tratamento em casa são factores que podem ter um efeito favorável na adesão ao tratamento. |
| para [1,7] |
Perfil de segurança comparável ao dos adultos
O perfil de tolerabilidade do secukinumab nos doentes pediátricos era consistente com os dados de segurança observados nos doentes adultos com psoríase. O Secukinumab foi geralmente bem tolerado, sendo a nasofaringite o acontecimento adverso (EA) mais comummente notificado. As taxas de AEs de interesse especial eram geralmente baixas. Não foram identificados novos sinais de segurança durante os períodos de tratamento de 52 e 104 semanas do estudo de extensão.
Literatura:
- Blair HA: Secukinumab: A Review in Moderate to Severe Pediatric Plaque Psoriasis. Pediatric Drugs 2021; 23: 601–608.
- Bodemer C, et al.: Secukinumab demonstrates high efficacy and a favourable safety profile in paediatric patients with severe chronic plaque psoriasis: 52-week results from a phase 3 double-blind randomized, controlled trial. J Eur Acad Dermatol Venereol 2020; 35(4): 938–947.
- Magnolo N, et al.: A phase III open-label, randomized multicenter study to evaluate efficacy and safety of secukinumab in pediatric patients with moderate to severe plaque psoriasis: 24-week results. J Am Acad Dermatol 2021; S0190-9622(21)02509-3
- Reich A, et al.: Secukinumab treatment demonstrated high efficacy and safety in paediatric patients with moderate-to-severe plaque psoriasis: 52-week results from a randomised trial [abstract no. P121 plus poster]. Pediatr Dermatol 2021; 38(Suppl. 1): 57–58.
- Szepietowski JC, et al.: Secukinumab demonstrated consistent efficacy across age and weight subgroups in pediatric patients with psoriasis: analyses from two phase 3 pediatric studies [abstract no. 78 plus poster]. In: Society for Pediatric Dermatology. 2021.
- Beissert S, et al. Secukinumab improves quality of life of paediatric patients with moderate-to-severe plaque psoriasis: 52-week results from a phase III, randomised study [abstract no. P080 plus poster]. Pediatr Dermatol. 2021;38(Suppl. 1): 43.
- Cordoro KM: Toward optimal care of the pediatric patient with psoriasis: the new AAD-NPF management guideline. J Psoriasis Psoriatic Arthritis 2020; 5(1): 7–11.
- Nogueira M, Paller AS, Torres T: Targeted therapy for pediatric psoriasis. Paediatr Drugs 2021; 23(3): 203–212.
- Wu JJ, et al.: Treatment of psoriasis with secukinumab in challenging patient scenarios: a review of the available evidence. Dermatol Ther 2020; 10(3): 351–364.
- Menter A, et al.: Joint American Academy of Dermatology-National Psoriasis Foundation guidelines of care for the management and treatment of psoriasis in pediatric patients. J Am Acad Dermatol 2020; 82(1): 161–201.
- Eisert L, et al.: S2k guidelines for the treatment of psoriasis in children and adolescents – short version part 1. J Dtsch Dermatol Ges 2019; 17(8): 856–870.
- Haulrig MB, Zachariae C, Skov L: Off-label treatments for pediatric psoriasis: lessons for the clinic. Psoriasis (Auckl) 2021; 11: 1–20.
- Informações sobre medicamentos, www.swissmedicinfo.ch,(último acesso em 26 de novembro de 2021)
- Blauvelt A, Chiricozzi A: The immunologic role of IL-17 in psoriasis and psoriatic arthritis pathogenesis. Clin Rev Allergy Immunol 2018; 55(3): 379–390.
DERMATOLOGIE PRAXIS 2021; 31(6): 28–29