As terapias sistémicas orientadas estão a tornar-se cada vez mais importantes tanto no carcinoma da tiróide diferenciado anaplásico como no carcinoma da tiróide diferenciado radio-refractário avançado. Nos últimos anos, estas provaram ser opções eficazes na presença de alterações RET, TRK e BRAF. Apenas recentemente, os inibidores TRK larotrectinib e entrectinib, bem como os inibidores RET selpercatinib e pralsetinib foram aprovados na Suíça.
O mais tardar com a aprovação dos inibidores específicos RET (Rearranged During Transfection) e TRK (Tropomyosin Receptor Kinase), chegou também a terapia personalizada do cancro no tratamento do carcinoma da tiróide. Por exemplo, os tumores radioiodinfractários avançados estão a ser tratados com cada vez mais sucesso com substâncias específicas. Por um lado, estas provaram ser uma opção terapêutica eficaz na presença de alterações RET, TRK e BRAF. Por outro lado, podem servir para induzir uma rediferenciação do tumor – e assim uma renovada vulnerabilidade à radioiodina. Para além das substâncias visadas, a imunoterapêutica está também a ser cada vez mais utilizada, especialmente para o carcinoma anaplástico da tiróide. Com estes novos desenvolvimentos, a importância das análises genéticas moleculares no carcinoma da tiróide tem aumentado significativamente nos últimos dois anos. A investigação actual não se centra apenas no desenvolvimento futuro do tratamento de primeira linha, mas também na avaliação de opções terapêuticas para linhas de tratamento posteriores, que têm sido pouco estudadas até à data.
Carcinoma da tiróide diferenciado radioiodinfractário: Quem é quem?
Os tumores diferenciados, especialmente os tumores papilares, representam cerca de 85% dos 890 carcinomas da tiróide recentemente diagnosticados na Suíça todos os anos [1]. Em 15% dos casos, a doença revela-se recorrente ou metastática [2]. Muitas vezes o tumor já não responde à terapia sistémica com radioiodo e, portanto, é radioiodinfractário. Isto leva a uma deterioração acentuada do prognóstico com uma taxa de sobrevivência de 10 anos de cerca de 10%, em comparação com mais de 50% para a sensibilidade aos radioíodos [3]. Graças a novas abordagens terapêuticas para tumores radioiodinfractários avançados, a perspectiva pode agora também melhorar para as pessoas afectadas cuja doença já não pode ser tratada com radioiodina. Até há pouco tempo, as únicas opções de drogas nestes casos eram os inibidores multikinase sorafenibe e lenvatinibe. Estes são utilizados em doentes sintomáticos ou tumores que são progressivos de acordo com RECIST (Critérios de Avaliação de Resposta em Tumores Sólidos) e para os quais não é possível nenhum tratamento cirúrgico ou radioterapêutico (Directrizes da OMPE). A taxa de resposta (ORR) situa-se entre 12% e 65%, a mediana de sobrevivência sem progressão (PFS) entre 10 e 30 meses – com uma toxicidade não negligenciável [4,5]. Em particular, os efeitos secundários cutâneos, a hipertensão e a diarreia requerem frequentemente reduções de dose que limitam o potencial terapêutico. Isto deve-se, em grande medida, à falta de especificidade das substâncias. Como inibidores multikinase que bloqueiam múltiplas tirosinases, o sorafenibe e o lenvatinibe exibem alguma actividade fora do alvo com as correspondentes consequências para a compatibilidade.
Fusões e mutações genéticas como novos alvos terapêuticos
No decurso dos últimos dois anos, os inibidores mais específicos TRK larotrectinibe e entrectinibe foram aprovados na Suíça na presença de uma fusão genética NTRK (neurotrophic tirosina receptora kinase) como as primeiras substâncias de sempre para o diagnóstico de tumores – ou seja, independentemente da entidade tumoral. Além disso, os inibidores selectivos RET selpercatinib e pralsetinib podem ser utilizados em carcinomas diferenciados da tiróide com fusão RET desde 2021 [6]. Estes desenvolvimentos alteraram significativamente o tratamento do cancro avançado da tiróide radio-refractária. Assim, as fusões NTRK e RET devem ser procuradas especificamente hoje, como a Prof. Christine Spitzweg, MD, Chefe do Centro Interdisciplinar da Tiróide na LMU Klinikum München, salientou na última reunião anual da DGHO, OeGHO, SSMO e SGH/SSH [7]. Se uma fusão correspondente estiver presente, existem opções de tratamento eficazes com os inibidores correspondentes com um perfil de toxicidade significativamente melhorado em comparação com os inibidores multikinase. Segundo o perito de renome mundial, isto também levanta a questão de saber se os inibidores RET e TRK já devem ser utilizados na primeira linha de tratamento, ou seja, antes do lenvatinibe ou sorafenibe. De acordo com a aprovação daEMA (Agência Europeia de Medicamentos), isto não é actualmente permitido na UE, mas está na Suíça [6,8]. Numerosos dados apresentados em congressos recentes apoiam o benefício dos inibidores TRK e RET no carcinoma avançado de tiróide diferenciado com radioiodo refractário, embora faltem ainda ensaios de fase III [7, 9-12]. Para além da utilização para controlo de doenças em casos avançados, existem também relatórios de casos únicos em que inibidores selectivos de RET foram utilizados com sucesso para reintroduzir a capacidade de armazenamento de radioiodios [7,13,14]. Uma tal reindução da absorção de radioiodo também pode ser conseguida utilizando inibidores BRAF e MEK. A base para o armazenamento de iodo e, portanto, a eficácia da terapia com radioiodo é a expressão suficiente do transportador de iodeto de sódio. A via de sinalização BRAF-MEK desempenha aqui um papel importante. Se isto for hiperactivo, como na presença de uma mutação BRAFV600E, há uma expressão reduzida do transportador e, portanto, uma redução na absorção de radioiodo. O resultado final é uma perda da sensibilidade aos radioíodos [7,15,16]. A administração de inibidores de BRAF e/ou MEK pode restaurar isto em alguns casos. Por exemplo, o inibidor BRAF dabrafenib foi demonstrado num estudo piloto como sendo eficaz na reindução da expressão do transportador de iodeto de sódio para a radioterapia [7,17]. Nesta base, a dabrafenib já está a ser utilizada fora do rótulo em alguns centros para rediferenciação; a aprovação oficial ainda não foi concedida [7]. Outros estudos estão actualmente a investigar a administração combinada do dabrafenibe e do inibidor MEK trametinib [7,18,19]. O objectivo da terapia combinada é, para além de uma maior eficácia, a prevenção de mecanismos de fuga.
Também em fases mais avançadas da doença, quando a rediferenciação já não pode ser alcançada, os inibidores de BRAF e MEK representam uma nova opção terapêutica nos tumores mutantes de BRAFV600E [7]. Assim, a taxa de resposta com monoterapia dabrafenibe, bem como com terapia combinada com dabrafenibe mais trametinib após 1-3 tratamentos TKI anteriores é de cerca de 50% [20]. O PFS mediano no ensaio da fase II correspondente foi de 11,4 meses com dabrafenibe e 15,1 meses com o tratamento combinado. Embora o tratamento combinado não fosse claramente superior à monoterapia, os pacientes cuja doença progredia em monoterapia com dabrafenibe beneficiaram da adição de trametinib [7]. Infelizmente, nem os inibidores BRAF nem os inibidores MEK foram ainda aprovados para o cancro da tiróide [6]. Se uma mutação BRAFV600E estiver presente, deve portanto ser pedido um ensaio curativo individual. Se o objectivo é a rediferenciação e subsequente terapia com radioiodios, o timing da terapia é um factor importante que deve ser tido em conta, de acordo com o Prof. Spitzweg. Neste caso, o tratamento deve começar mais cedo, a fim de criar as melhores condições possíveis para a radioterapia. Não existe um consenso claro sobre o momento ideal do tratamento, mas um ensaio de rediferenciação deve ser considerado em todos os doentes com mutação de BRAFV600E [7].
Substância activa alternativa Cabozantinib
Para além dos inibidores-alvo TRK, RET, BRAF e MEK, o inibidor multikinase cabozantinibe está actualmente a ser testado para utilização no carcinoma diferenciado da tiróide com radioiodo refractário [7]. Além do MET e RET, este bloqueia em particular o VEGFR2 (Receptor do Factor de Crescimento Vascular Endotelial 2) [6]. A utilização da segunda e terceira linhas após lenvatinibe e/ou sorafenibe mostrou até agora uma promessa com uma PFS mediana de 12,7 meses e uma sobrevida global (OS) mediana de 34,7 meses em todos os subgrupos [7,21]. O ensaio da fase III COSMIC-311 está actualmente em curso, o que, em análises iniciais, mostra também um benefício PFS significativo do cabozantinib na segunda e terceira linhas de tratamento em comparação com o placebo (HR 0,22, 96% CI 0,13 – 0,36, p<0,0001) [7,22–24]. Tal como com outros inibidores multikinase, a tolerabilidade subótima é um ponto negativo da terapia. No entanto, o cabozantinibe poderia ser uma opção eficaz para a terapia de segunda e terceira linha que tem faltado até agora. A substância foi aprovada para esta indicação nos EUA desde Setembro de 2021; as aprovações da EMA e do Swissmedic estão pendentes [6,7,8].
Em resumo, a terapia de primeira linha com inibidores selectivos TRK e RET em carcinoma da tiróide diferenciado radioiodinfractor avançado – na presença de uma alteração genética correspondente – tornou-se estabelecida nos últimos dois anos. No caso de mutação de BRAFV600E, deve ser considerada uma tentativa de cura individual e, em casos menos avançados, especialmente uma tentativa de rediferenciação usando BRAF e, se necessário, o inibidor de MEK [7]. A análise genética molecular tornou-se muito mais importante com a emergência de alvos cada vez mais específicos. Para os pacientes para os quais não é possível identificar o condutor, o tratamento com lenvatinib ou sorafenib continua a ser a primeira escolha. Na segunda linha de terapia, o cabozantinibe poderá em breve receber aprovação. Os inibidores de pontos de controlo como o pembrolizumab também estão a ser investigados nesta indicação [7].
Desenvolvimentos também no carcinoma anaplásico da tiróide
Devido à sua desdiferenciação, os carcinomas anaplásicos da tiróide também não absorvem iodo – e, portanto, nenhum radioiodo terapêutico . São responsáveis por apenas 1-3% de todos os carcinomas da tiróide, mas são responsáveis por metade das mortes específicas da doença [25]. Classicamente, a terapia consiste na ressecção cirúrgica e radiochemoterapia adjuvante. O prognóstico é sombrio, com um tempo médio de sobrevivência de cerca de quatro a cinco meses, pelo que existe uma grande necessidade clínica de desenvolver novas opções terapêuticas [25]. No entanto, este esforço coloca alguns desafios, sobretudo devido à desdiferenciação e às mudanças que a acompanham no espectro da mutação. Muitas vezes, mais de 100 mutações somáticas diferentes são encontradas na análise genética molecular. Particularmente comuns são as alterações p53, BRAF, RAS e β-catenin, que contribuem para o crescimento agressivo de tumores [25].
As únicas terapias de sistema aprovadas actualmente disponíveis são a quimioterapia usando doxorubicina e o tratamento com inibidores RET e TRK na presença de uma fusão apropriada. Além disso, é utilizada quimioterapia com carboplatina/taxol [25]. No entanto, com taxas de resposta de cerca de 25% e tempos médios de PFS de 3,4 meses com doxorubicina e 4,5 meses com carboplatina/taxol, a eficácia de ambos os regimes de quimioterapia deixa muito a desejar [25]. Enquanto a monoterapia com doxorubicina ou taxol é mais susceptível de ser utilizada em doentes mais velhos, menos aptos, o tratamento com carboplatina/taxol é preferível em doentes mais aptos devido à sua eficácia ligeiramente melhor [25]. Novas abordagens de tratamento incluem o inibidor multikinase lenvatinib em combinação com inibidores de ponto de controlo e inibidores de BRAF – até agora sem aprovação [25].
Cerca de um quarto dos doentes com carcinoma anaplásico da tiróide têm uma mutação de BRAFV600E, que poderá servir como um novo alvo terapêutico no futuro. Por exemplo, um ensaio fase II de terapia combinada com dabrafenibe mais trametinib mostrou remissão parcial em dois terços dos 16 pacientes incluídos [25,26]. O ORR era de 69% e a taxa de PFS a 1 ano era de 79%. Isto representa uma melhoria significativa em relação às opções quimioterápicas anteriores. Os inibidores BRAF podem também ter um lugar no cenário neoadjuvante, representando assim uma opção de tratamento para tumores primariamente inconectáveis [25,27].
Infelizmente, porém, na maioria dos casos, não é possível encontrar um condutor vulnerável. Tal como no caso do carcinoma diferenciado da tiróide resistente aos radioídios, é então possível utilizar inibidores multikinase. Uma vez que estes tumores têm tipicamente uma elevadacarga mutacionaltumoral (TMB ) e uma elevada expressão de PD-L1, a terapia combinada do inibidor multikinase lenvatinib e do inibidor pembrolizumab tem vindo a ganhar cada vez mais atenção nos últimos anos [25]. Num primeiro estudo, seis em cada oito pacientes mostraram uma resposta parcial, apenas um paciente registou progressos durante a terapia [25,28]. Após 16 meses, uma remissão completa pôde mesmo ser observada em metade dos doentes. Com base nestes dados, foram lançados os ensaios ATLEP centrados na Alemanha, que foram apresentados pela Prof. Dra. med. Christine Dierks, Consultora Sénior no Hospital Universitário de Halle, na reunião anual da DGHO 2021 [25]. Os ensaios ATLEP estão a investigar o tratamento combinado de lenvatinibe e pembrolizumab em anaplásicos e cancro da tiróide pouco diferenciado. Os resultados da fase inicial II de 26 pacientes mostraram um ORR de 38,5% aos três meses, e nos primeiros dois anos, dois terços dos pacientes responderam ao tratamento. O PFS mediano foi de 10 meses e o OS mediano foi de 11 meses [25].
Inibidores RET em foco
Os inibidores RET surgiram como uma nova opção terapêutica orientada ao longo dos últimos anos. Até agora, as duas substâncias activas selpercatinibe (LOXO-292) e pralsetinibe (BLU-667) foram aprovadas na Suíça em 2021. Os dois compostos foram desenvolvidos em paralelo e completaram os ensaios da fase inicial I/II (ARROW, LIBRETTO-001) [10,11,34]. Por um lado, podem ser utilizados no carcinoma medular da tiróide com mutação RET na segunda linha de terapia após o vandetanibe, e por outro lado no avançado RET-fusion-positive differentiated thyroid carcinoma [6].
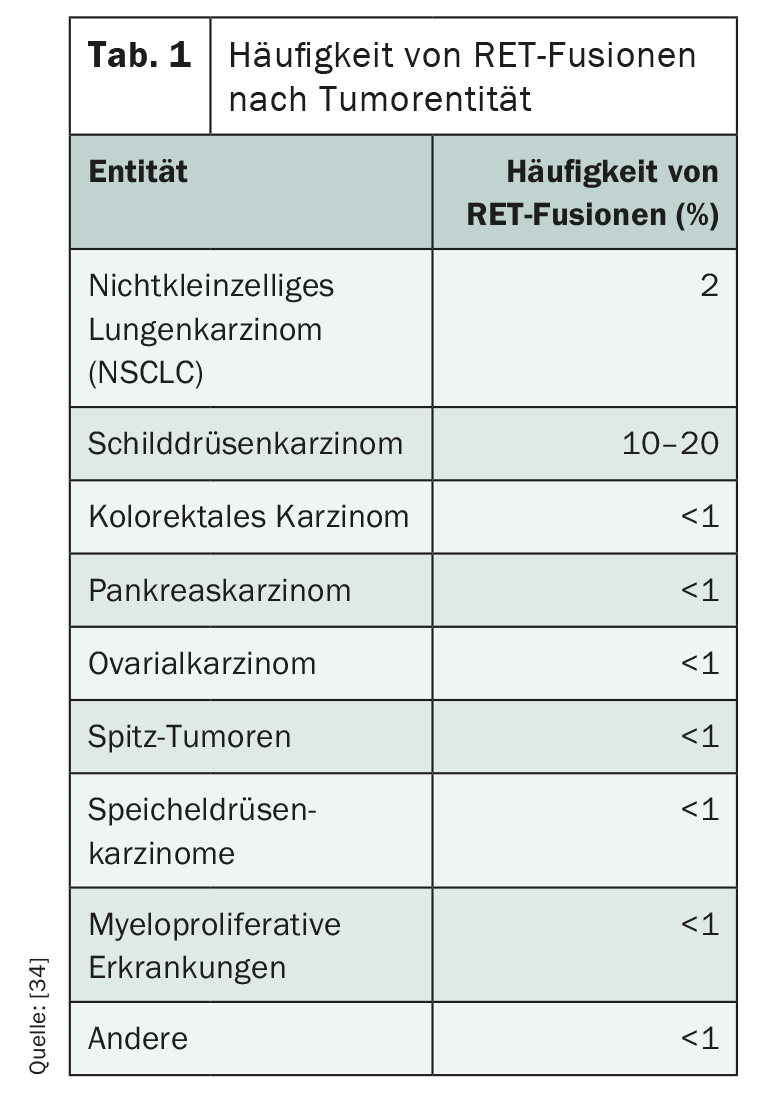
As alterações RET desempenham um papel importante como condutores especialmente nos carcinomas metastáticos da tiróide e dos brônquios, mas também ocorrem noutras entidades (Tab. 1) . Enquanto 1-2% dos carcinomas de pulmão de células não pequenas (NSCLC) têm tal alteração genética, a fusão RET pode ser detectada em 5-10% dos carcinomas papilares da tiróide [29]. As crianças e os jovens adultos são particularmente afectados, e a radiação ionizante é um factor de risco [30,31]. Em contraste com o carcinoma papilífero da tiróide, uma mutação pontual é muitas vezes decisiva para a activação liga-independente da cinase receptora RET no subtipo medular [32]. Enquanto as neoplasias endócrinas hereditárias múltiplas (HOMENS) e o carcinoma medular da tiróide familiar têm sempre mutações da linha germinal RET, as mutações somáticas RET ocorrem em cerca de 60% dos carcinomas medulares da tiróide esporádicos [34]. Na maioria dos casos, a activação das alterações RET exclui outras mutações do condutor [34].
Tanto no carcinoma medular como no papilífero e folicular da tiróide, existe agora uma nova opção terapêutica com os dois agentes activos selpercatinib e pralsetinib, que, com base nos dados actuais, não só é eficaz como também melhor tolerada do que os inibidores da multiquinase utilizados até à data devido à sua maior selectividade.
Além disso, os dois novos medicamentos podem contornar um importante mecanismo de resistência que interfere frequentemente com a terapia com inibidores multiquinase [34]. Assim, o selpercatinibe e o pralsetinib ligam-se à kinase RET através de um novo método. Os resultados da fase III e dos ensaios de primeira linha são esperados ainda este ano e podem levar a que o pralsetinibe e o selpercatinibe também possam ser utilizados na UE como terapia de primeira linha após falha do tratamento com radioiodo [34]. Este já é o caso na Suíça [6]. Se se desenvolver resistência ao selpercatinibe ou ao pralsetinibe, a mudança para a outra substância não é actualmente considerada muito promissora, uma vez que a resistência a ambos os agentes parece ser caracterizada por mutações semelhantes [33].
Os testes para alterações RET atacáveis são hoje obrigatórios, pelo menos para carcinomas metastáticos da tiróide e dos brônquios. O padrão de ouro é NGS (Next Generation Sequencing) [34]. Em caso de falta de disponibilidade, as fusões RET podem ser investigadas por FISH (hibridação in situ da fluorescência) e as mutações pontuais RET por PCR (reacção em cadeia da polimerase) . No entanto, um resultado positivo de FISH ou PCR deve ser validado pela NGS [34]. Actualmente, a biopsia líquida não é um substituto completo para um exame de tecido fino [34]. Nem todas as mutações de pontos RET encontradas na NGS são necessariamente preditivas de uma resposta a uma terapia orientada. Especialmente se o tumor tiver muitas mutações em diferentes genes e não for um carcinoma brônquico ou da tiróide, é aconselhável consultar especialistas antes de considerar o RET como um alvo terapêutico [34].
Literatura:
- Krebsliga Schweiz: Cancro na Suíça: figuras importantes. Situação em Dezembro de 2020. www.krebsliga.ch/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf.
- Gild ML, et al: Orientação clínica para o cancro da tiróide diferenciado por radioiodo refractário. Clin Endocrinol (Oxf). 2018; 88(4): 529-537.
- Durante C, et al.: Resultado a longo prazo de 444 pacientes com metástases distantes do carcinoma papilífero e folicular da tiróide: benefícios e limites da terapia com radioiodoína. J Clin Endocrinol Metab. 2006; 91(8): 2892-2899.
- Schlumberger M, et al: Lenvatinib versus placebo no cancro da tiróide radio-refractária. N Engl J Med. 2015; 372(7): 621-630.
- Brose MS, et al: Sorafenib em iodo radioactivo refractário, localmente avançado ou cancro da tiróide diferenciado metastásico: um ensaio aleatório, duplo-cego, fase 3. Lanceta. 2014; 384(9940): 319-328.
- Informação sobre produtos medicinais do Swissmedic. www.swissmedicinfo.ch (último acesso em 22.10.2021).
- Spitzweg C: Terapia direccionada molecular e novas abordagens terapêuticas no carcinoma da tiróide diferenciado com radioiodo refractário. Reunião Anual das Sociedades Alemã, Austríaca e Suíça de Hematologia e Oncologia Médica; Berlim, 04.10.2021.
- EMA Informação sobre Medicamentos. www.ema.europa.eu/en/medicines/human (último acesso em 22.10.2021).
- Cabanillas ME, et al: Tratamento Larotrectinibe do cancro da tiróide de fusão avançada TRK. ESMO Congress 2020, E-Poster Display, Abstract #1916P.
- Subbiah V, et al: Pralsetinib para doentes com cancro da tiróide avançado ou metastático RET-alterado (ARROW): um estudo multi-curto, aberto, registo, fase 1/2. Lancet Diabetes Endocrinol. 2021; 9(8): 491-501.
- Wirth LJ, et al: Efficacy of Selpercatinib in RET-Altered Thyroid Cancers. N Engl J Med. 2020; 383(9): 825-835.
- Sherman EJ, et al: Selpercatinib eficácia e segurança em doentes com cancro da tiróide alterado por RET: Uma actualização do ensaio clínico. Reunião Anual ASCO 2021, Poster Session Head and Neck Cancer, Abstract #6073.
- Groussin L, et al.: Selpercatinib-Enhanced Radioiodine Uptake in RET-Rearranged Thyroid Cancer. Tiróide. 2021.
- Lee YA, et al: A terapia orientada por fusão NTRK e RET no cancro pediátrico da tiróide produz uma resposta tumoral e uma absorção de radioiodo. J Clin Invest. 2021; 131(18).
- Cabanillas ME, Ryder M, Jimenez C: Targeted Therapy for Advanced Thyroid Cancer: Kinase Inhibitors and Beyond. Endocr Rev. 2019; 40(6): 1573-1604.
- Spitzweg C, et al: Advanced radioiodine-refractory differentiated thyroid cancer: o iodeto de sódio siméter e outros alvos terapêuticos emergentes. Lancet Diabetes Endocrinol. 2014; 2(10): 830-842.
- Rothenberg SM, et al: Redifferenciação do BRAF V600E, refractário de iodo, metástase do cancro papilífero da tiróide com dabrafenibe. Clin Cancer Res. 2015; 21(5): 1028-1035.
- Leboulleux S, et al: MERAIODE: Um ensaio de Redifferenciação Fase II com Trametinib e Dabrafenib seguido de Administração de Iodo Radioactivo para doentes com cancro da tiróide com mutação BRAFV600E (NCT 03244956). Congresso ENDO 2021.
- Leboulleux S, et al: Resultados da terapia combinada para a Re-diferenciação no BRAF e RAS DTC mutado. Reunião Anual do ITOG 2021.
- Shah MH, et al: Resultados do ensaio aleatório da fase II do dabrafenibe versus dabrafenibe mais trametinibe no carcinoma papilífero da tiróide com mutação BRAF. Reunião Anual da ASCO de 2017, Sessão de Discussão de Pôsteres de Câncer de Cabeça e Pescoço, Resumo #6022.
- Cabanillas ME, et al: Cabozantinib As Salvage Therapy for Patients With Tyrosine Kinase Inhibitor-Refractory Differentiated Thyroid Cancer: Results of a Multicenter Phase II International Thyroid Oncology Group Trial. J Clin Oncol. 2017; 35(29): 3315-3321.
- Brose MS, et al: Cabozantinib versus placebo em doentes com cancro da tiróide diferenciado refractário (DTC) por radioiodo (RAI) que progrediram após terapia prévia orientada para VEGFR: Resultados do ensaio da fase 3 COSMIC-311. Reunião Anual da ETA 2021, Sessão Oral 3, Resumo #18.
- Brose MS, et al: Cabozantinib versus placebo em doentes com cancro da tiróide diferenciado com radioiodo refractário que progrediram após terapia prévia orientada para VEGFR: Resultados da fase 3 do ensaio COSMIC-311. Reunião Anual da ASCO 2021, Oral Abstract Head and Neck Cancer, Abstract #6001.
- Capdevila J, et al: Cabozantinib versus placebo em doentes com cancro da tiróide diferenciado com radioiodo refractário que progrediram após terapia prévia orientada para VEGFR: Resultados actualizados do ensaio fase III COSMIC-311 e análises pré-especificadas de subgrupos por terapia prévia. Congresso ESMO 2021, Mini sessão oral – Redes e tumores endócrinos, Resumo #LBA67.
- Dierks C: Terapia do sistema de carcinoma anaplásico da tiróide. Reunião Anual das Sociedades Alemã, Austríaca e Suíça de Hematologia e Oncologia Médica; Berlim, 04.10.2021.
- Subbiah V, et al: Dabrafenib e Trametinib Tratamento em Pacientes com cancro da tiróide local avançado ou metástático BRAF V600-Mutant Anaplásico. J Clin Oncol. 2018; 36(1): 7-13.
- Wang JR, et al: Ressecção Cirúrgica Completa Após Neoadjuvant Dabrafenib Plus Trametinib em BRAF(V600E)- Carcinoma Tiróide Anaplásico Mutilado. Tiróide. 2019; 29(8): 1036-1043.
- Dierks C, et al.: Combinação de Lenvatinib e Pembrolizumab é uma Opção de Tratamento Eficaz para o Carcinoma Tiróide Anaplásico e Mal Diferenciado. Tiróide. 2021; 31(7): 1076-1085.
- Caracterização genómica integrada do carcinoma papilífero da tiróide. Célula. 2014; 159(3): 676-690.
- Vanden Borre P, et al: Pediatric, Adolescent, and Young Adult Thyroid Carcinoma Harbors Frequent and Diverse Targetable Genomic Alterations, Including Kinase Fusions. Oncologista. 2017; 22(3): 255-263.
- Ricarte-Filho JC, et al: Identificação de oncogenes de fusão cinase em cancros da tiróide induzidos por radiação pós-Chernobyl. J Clin Invest. 2013; 123(11): 4935-4944.
- Mulligan LM: RET revisitado: expandindo a carteira oncogénica. Nat Rev Cancer. 2014; 14(3): 173-186.
- Solomon BJ, et al: RET Solvent Front Mutations Mediate Acquired Resistance to Selective RET Inhibition in RET-Driven Malignancies. J Thorac Oncol. 2020; 15(4): 541-549.
- Weiler D, Gautschi O: Carcinomas em idade RET: Novos inibidores RET para o tratamento de tumores sólidos. info@oncologia. 2021; 01: 8-11.
InFo ONCOLOGy & HEMATOLOGy 2022; 10(1): 32-35