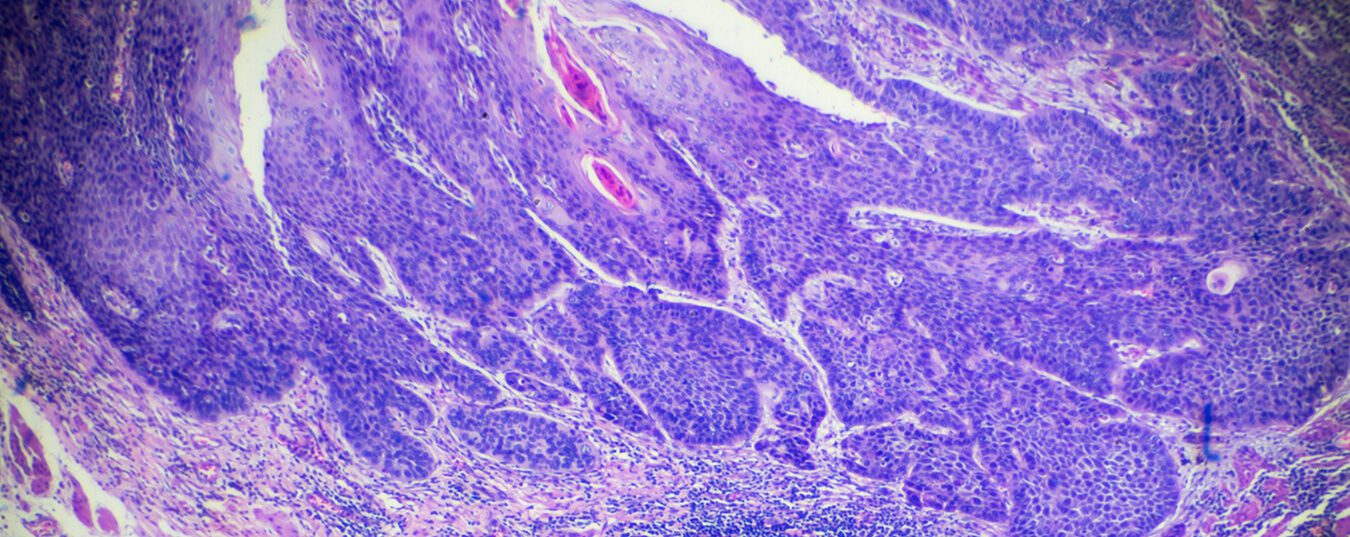
Os carcinomas de esófago são relativamente raros e representam aproximadamente 1% de todos os tumores malignos a nível mundial. Com base na sua localização, é feita uma distinção entre os tumores cervicais e intratorácicos. Histologicamente, manifestam-se como carcinomas escamosos de células e adenocarcinomas. Dependendo do tumor, aplicam-se outras normas terapêuticas.
Os carcinomas de esófago são relativamente raros e representam aproximadamente 1% de todos os tumores malignos a nível mundial. Com base na sua localização, é feita uma distinção entre os tumores cervicais e intratorácicos. Histologicamente, manifestam-se como carcinomas escamosos de células e adenocarcinomas [1]. O carcinoma de células escamosas do esófago é o carcinoma mais comum do esófago a nível mundial e ocorre mais frequentemente na “cintura asiática do cancro do esófago” [2]. Nas nações industrializadas ocidentais, a incidência de adenocarcinomas tem vindo a aumentar de forma constante nas últimas décadas. Entretanto, os adenocarcinomas são aqui responsáveis por 40-50% dos tumores de esófago. O risco de desenvolver cancro do esófago é três a quatro vezes maior para os homens. Na Alemanha, há cerca de 5500 novos casos em homens e 1500 em mulheres todos os anos. Em média, homens e mulheres com a doença têm 67 e 72 anos de idade, respectivamente [3].
Factores e sintomas de risco
Os adenocarcinomas desenvolvem-se geralmente com base na doença de refluxo crónico e a consequente transformação da mucosa em esófago de Barrett [4]. Além disso, o consumo crónico de nicotina, obesidade e acalasia foram identificados como factores de risco [5]. Para carcinomas de células escamosas, o consumo crónico de nicotina e o consumo excessivo de álcool poderiam ser identificados acima de tudo. Contudo, os danos mecânicos devidos a acalasia, lesões ácidas e alcalinas, bem como radioterapia prévia, podem também predispor ao desenvolvimento de carcinoma espinocelular [6].
Os carcinomas precoces são geralmente assintomáticos. Disfagia ou odynophagia, vómitos recorrentes, náuseas, sensação precoce de plenitude, perda de peso, dor torácica e hemorragia ou anemia gastrointestinal ocorrem geralmente apenas em carcinomas localmente avançados [4].

Encenação
A medida mais importante para o diagnóstico primário do carcinoma de esófago é a vídeo-endoscopia de alta resolução [4]. Além de determinar a localização e extensão do tumor e detectar alterações metaplásicas no esófago inferior, pode ser realizada uma biopsia ao mesmo tempo para confirmar o diagnóstico. O ultra-som endoscópico deve ser acrescentado para avaliar melhor a propagação local (Tab. 1-3) [7]. Em carcinoma de esófago recentemente diagnosticado, a tomografia computorizada multidetectores com contraste do tórax cervical e abdómen deve ser realizada como padrão [8]. O PET-CT pode ser realizado em particular em tumores localmente avançados (cT2-4 cN+) para excluir metástases distantes se houver uma intenção potencialmente curativa para a terapia ou se o resultado tiver consequências clínicas [9,10]. Se um tumor localmente avançado estiver em contacto com o sistema traqueobrônquico, o estadiamento deve ser alargado para incluir a broncoscopia flexível [11]. A laparoscopia diagnóstica deve ser realizada para tumores localmente avançados (cT3, cT4) do esófago inferior para excluir metástases peritoneais [12].

Terapia
A decisão de tratamento dos carcinomas do esófago deve ser sempre discutida e tomada numa base interdisciplinar, idealmente no âmbito de uma conferência interdisciplinar sobre tumores. Para além dos factores específicos dos tumores, os factores específicos dos pacientes desempenham também um papel decisivo no processo de tomada de decisão. Existem frequentemente comorbilidades específicas da entidade (cardiovascular, pulmonar, hepática) que podem complicar significativamente a terapia. Mesmo tumores potencialmente ressecáveis podem assim ser funcionalmente inoperacionais [13]. Para além de um estado geral reduzido, os pacientes já têm frequentemente um estado nutricional reduzido [14]. Os cuidados nutricionais dos pacientes devem ser parte integrante dos cuidados interdisciplinares (Fig. 1, 2).

T1a N0 M0 (carcinoma precoce)
A mucosectomia por ressecção endoscópica é considerada o padrão de tratamento do adenocarcinoma pT1 m1-m3 e do carcinoma espinocelular pT1 m1-m2. Para uma avaliação precisa e completa das margens laterais e basais no exame histológico, deve ser realizada uma ressecção em bloco e uma ressecção R0 deve ser destinada a [15]. Em caso de factores de risco como uma ressecção R1 ou uma lesão de Barrett multifocal ou não-ablatável, deve ser realizada uma ressecção cirúrgica. Se um carcinoma espinocelular T1m3 confirmado histologicamente ou um tumor T1b for confirmado após a intervenção, recomenda-se a ressecção cirúrgica com linfadenectomia. No caso de carcinoma G3 confirmado ou na presença de invasão linfática ou venosa ou infiltração submucosa profunda (>500 µm) após ressecção endoscópica, a ressecção cirúrgica deve ser discutida [4].

T1b-T2 N0 M0
O tratamento de escolha nesta fase para os carcinomas torácicos é a ressecção cirúrgica com linfadenectomia. Se a ressecção cirúrgica após a ablação endoscópica de um carcinoma espinocelular T1b sm1-2 for recusada, a radiochemoterapia adjuvante pode ser realizada como alternativa [16]. Se os pacientes não forem elegíveis para ressecção cirúrgica, pode ser realizada radiochemoterapia curativa intencional (RCT). Para carcinomas T2 N0, o neoadjuvant RCT pode ser realizado antes da cirurgia [17].
T3-4 N0/N+ M0
Os carcinomas esofágicos (células escamosas bem como os adenocarcinomas) devem ser tratados a partir de uma fase cT3 e/ou N+ no âmbito de conceitos multimodais. Para além da cirurgia curativa, o neoadjuvant RCT também está disponível [4]. O ensaio CROSS randomizado (n=368 pacientes) foi capaz de mostrar um benefício global de sobrevivência para a TCR pré-operatória tanto para os escamosos como para os adenocarcinomas. A mediana de sobrevivência global foi de 49,4 meses no grupo de pacientes tratados no pré-operatório contra 24,0 meses no grupo de pacientes ressecados apenas (HR 0,66, 95% CI (0,49-0,87), p=0,003) [18]. Os pacientes receberam radiochemoterapia pré-operatória até 41,4 Gy com quimioterapia semanal concomitante composta por carboplatina (AUC 2) e paclitaxel (50 mg/m² KOF) seguida de cirurgia ou cirurgia isolada. O benefício global de sobrevivência foi mais pronunciado no grupo das células escamosas do que no grupo do adenocarcinoma (PECA: 82 vs. 21 meses, FC 0,48, p=0,007; adeno: 43 vs. 27 meses, FC 0,73, p=0,061). Não houve diferença no número de complicações pós-operatórias. As meta-análises confirmaram o benefício da radiochemoterapia neoadjuvante para o escamoso e adenocarcinoma, a partir de uma fase ≥cT3, fazendo da TCR pré-operatória combinada seguida de cirurgia o tratamento de escolha para estes tumores [19,20].
Até agora, não houve indicação de terapia adjuvante após a RCT neoadjuvante e cirurgia. Após a publicação do estudo multicêntrico, fase III aleatorizado CheckMate 577 , esta situação mudou [21]. O estudo investigou se a adição de terapia nivolumab adjuvante após a ressecção R0 na ausência de remissão completa patológica após a TCR pré-operatória pode melhorar a sobrevivência. Foi incluído um total de 794 pacientes que foram aleatorizados para receberem nivolumab ou placebo durante um ano após a cirurgia. O principal desfecho foi a sobrevivência sem doenças. Em mediana, isto foi prolongado por nivolumab de 11 para 22,4 meses (HR 0,69; 95% CI 0,56-0,86, p=0,0003). Ambos os subtipos histológicos beneficiaram igualmente, sendo o efeito mais pronunciado nos carcinomas escamosos celulares do que nos adenocarcinomas (HR 0,61 vs. HR 0,75). Não houve diferença no resultado entre os tumores PD-L1 positivos e PD-L1 negativos. O estudo mostrou também que a imunoterapia era fácil de administrar e que a qualidade de vida dos pacientes não se deteriorava em comparação com o placebo. Neste momento, contudo, ainda faltam dados sobre a sobrevivência global. Uma aprovação para nivolumab em terapia adjuvante foi concedida pela Comissão Europeia de Medicamentos em Setembro de 2021. Uma forte recomendação de tratamento foi também feita pela ASCO para terapia nivolumab adjuvante após radiochemoterapia neoadjuvante e cancro do esófago completamente ressecado sem remissão completa patológica [22].
Após ressecção R1 e falha da radiochemoterapia neoadjuvante, pode ser dada radiochemoterapia pós-operatória para melhorar o controlo local [23].
Os pacientes que são funcionalmente inoperáveis ou cujos tumores são tecnicamente inoperáveis, ou que recusam a cirurgia, devem ser tratados com radiochemoterapia definitiva, independentemente de se tratar de adenocarcinoma ou de carcinoma espinocelular. Relativamente à quimioterapia concomitante à radioterapia, a literatura mostra bons dados para a combinação de carboplatina e paclitaxel, mas alternativamente pode ser utilizada uma combinação de platina e fluoropyrimidina [18,24]. Um artigo francês mostrou recentemente uma eficácia comparável do regime FOLFOX (oxaliplatina + 5-FU) concomitante à radioterapia definitiva em comparação com a quimioterapia concomitante com 5-FU e cisplatina [25]. A radioterapia padrão com quimioterapia concomitante de carboplatina/paclitaxel utilizada na situação pré-operatória parece também ser viável na situação definitiva [26].
Um RCT definitivo deve visar uma dose de radiação de 50,4 Gy. Uma dose superior não melhora o controlo local do tumor nem a sobrevivência global, independentemente do subtipo histológico (escamoso ou adenocarcinoma), de acordo com os dados actuais do ensaio holandês ARTDECO [27].
Para uma cobertura de volume alvo mais conforme e uma melhor protecção dos órgãos em risco (coração, pulmões), a radioterapia deve ser modulada por intensidade (IMRT) [28].
Tumores do esôfago cervical
A terapia padrão para o carcinoma do esófago cervical é a radiochemoterapia definitiva com as especificações de dose acima mencionadas e a terapêutica do sistema. Devido ao aumento das taxas de complicações e perturbações pós-operatórias, a cirurgia não deve ser realizada [29,30].
Cada T, cada N, M1
A primeira escolha na situação metastática é a terapia sistémica, que pode prolongar a sobrevivência do paciente. Contudo, não estão disponíveis estudos de fase III para o carcinoma espinocelular. No entanto, a terapia sistémica é recomendada nas directrizes internacionais [31]. A terapia sistémica deve ser planeada tendo em conta o estado geral, comorbidades, preferência do paciente e toxicidade da terapia. O prognóstico não poderia ser melhorado através da ressecção do tumor primário. Antes do início da terapia sistémica paliativa, a PD-L1 CPS deve ser avaliada como um factor preditivo para a terapia com um inibidor do ponto de controlo imunitário [4]. Na terapia de primeira linha, a quimioterapia deve ser combinada com a imunoterapia [32–34]. Para o carcinoma de células escamosas, a quimioterapia à base de platina/fluoropyrimidina é combinada com pembrolizumab para um CPS ≥10 [4]. Com uma CPS <10, deve ser administrada quimioterapia sistémica paliativa com um derivado de platina em combinação com 5-FU ou taxano [4]. Nos adenocarcinomas, o estatuto HER2 deve ser determinado em adição ao PD-L1 CPS [4]. A terapia do sistema inclui terapia com platina/fluoropyrimidina numa combinação de duas/três drogas para CPS <5 e estado HER2 negativo. Com um PD-L1 CPS ≥5 para nivolumab ou ≥10 para pembrolizumab, a combinação é com um derivado de platina e fluoropyrimidina [4]. Se Her2 estiver sobreexpressa (IHC3+, IHC2+, FISH+), o trastuzumab é adicionado à terapia de primeira linha [35]. A radioterapia percutânea ou braquiterapia para terapia sistémica pode ser considerada se estiverem presentes sintomas locais (hemorragia, estenose, compressão) [36]. A implantação endoscópica de stents metálicos pode ser realizada para alívio rápido da disfagia, embora a radioterapia percutânea simultânea após a implantação de stents metálicos deva ser evitada, uma vez que está associada a uma maior taxa de complicações [31,37].
Mensagens Take-Home
- Padrão de tratamento para adenocarcinoma T1 m1-m3 e carcinoma espinocelular T1 m1-m2: mucosectomia por ressecção endoscópica. Em caso de factores de risco (incluindo R1, lesões de Barrett não-ablatáveis) ◊ ressecção cirúrgica.
- Melhoria do prognóstico através do tratamento de carcinomas de esófago localmente avançados no âmbito de conceitos de terapia multimodal (neoadjuvante RCTx + cirurgia).
- Em células escamosas e adenocarcinoma do esófago após radiochemoterapia neoadjuvante e ressecção completa (R0) sem remissão completa patológica → imunoterapia consolidativa independentemente do estatuto PD-L1.
- Para carcinoma espinocelular metastático distante: quimioterapia à base de platina, em primeira linha também em combinação com inibidores de pontos de controlo (PD-L1 CPS ≥10).
- Para adenocarcinomas metastáticos distantes: quimioterapia combinada com imunoterapia (PD-L1 CPS ≥5) ou positividade HER-2. [Trastuzumab]
- Em caso de radioterapia em neoadjuvante, intenção definitiva ou paliativa: dispensa de implantação de stent metálico.
Literatura:
- Sociedade Alemã de Hematologia e Oncologia Médica e.V. Onkopedia. Carcinoma de esófago. Estado 2022. www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@@guideline/html/index.html; recuperado em 23.11.2022.
- Pakzad R, Mohammadian-Hafshejani A, Khosravi B, et al: The incidence and mortality of esophageal cancer and their relationship to development in Asia. Ann Transl Med 2016 Jan;4(2):29. doi: 10.3978/j.issn.2305-5839.2016.01.11
- Instituto Robert Koch e a Sociedade de Registos Epidemiológicos do Cancro na Alemanha e.V. Cancro na Alemanha para 2017/2018. Berlim, 2021
- Programa de orientação em oncologia (Sociedade Alemã contra o Cancro, AWMF): Diagnóstico e terapia de carcinomas escamosos e adenocarcinomas do esófago; versão longa 3.1, 2022, AWMF número de registo: 021/023OL, www.leitlinienprogramm-onkologie.de/leitlinien/oesophaguskarzinom/ acedido em [23 .11.2022].
- Domper Arnal MJ, Ferrández Arenas Á, Lanas Arbeloa Á: Cancro esofágico: factores de risco, rastreio e tratamento endoscópico em países ocidentais e orientais. Mundo J Gastroenterol. 2015 Jul 14;21(26): 7933-7943.
- Wheeler JB, Reed CE: Epidemiologia do cancro do esófago. Surg Clin North Am. 2012 Out;92(5): 1077-1087. doi: 10.1016/j.suc.2012.07.008.
- Russell IT, Edwards RT, Gliddon AE, et al: Cancer of Oesophagus or Gastricus – New Assessment of Technology of Endosonography (COGNATE): relatório de ensaio pragmático e aleatório. Health Technol Assess 2013 Set; 17(39): 1-170. doi: 10.3310/hta17390.
- Makarawo TP, Negussie E, Malde S, et al: Água como meio de contraste: uma reavaliação utilizando a tomografia computorizada de múltiplas filas de detectores. Am Surg. 2013 Jul; 79(7): 728-733.
- de Gouw DJJM, Klarenbeek BR, Driessen M, et al: Detecting Pathological Complete Response in Esophageal Cancer after Neoadjuvant Therapy Based on Imaging Techniques: A Diagnostic Systematic Review and Meta-Analysis. J Thorac Oncol 2019 Jul; 14(7): 1156-1171. doi: 10.1016/j.jtho.2019.04.004.
- Jiang C, Chen Y, Zhu Y, Xu Y: Revisão sistemática e meta-análise da precisão de 18F-FDG PET/CT para a detecção de metástases linfonodais regionais no carcinoma espinocelular esofágico. J Thorac Dis 2018 Nov;10(11): 6066-6076. doi: 10.21037/jtd.2018.10.57.
- Osugi H, Nishimura Y, Takemura M, et al: Broncoscopia para o estadiamento do carcinoma escamoso esofágico supracarinal: impacto no resultado. Mundo J Surg 2003 Maio; 27(5): 590-594. doi: 10.1007/s00268-003-6784-3
- Findlay JM, Bradley KM, Maile EJ, et.al: Encenação pragmática do cancro do esófago utilizando a teoria da decisão envolvendo ultra-sonografia endoscópica selectiva, PET e laparoscopia. Br J Surg, 2015 102(12): 1488-1499.
- Lagergren J, Smyth E, Cunningham D, Lagergren P: Cancro do esófago. Lancet 2017 25 de Novembro; 390(10110): 2383-2396. doi: 10.1016/S0140-6736(17)31462-9.
- van Stijn MF, Korkic-Halilovic I, Bakker MS, et al: Estado nutricional pré-operatório e resultado pós-operatório em pacientes idosos de cirurgia geral: uma revisão sistemática. JPEN J Parenter Enteral Nutr 2013 Jan; 37(1): 37-43. doi: 10.1177/0148607112445900.
- Pech O, Bollschweiler E, Manner H, et al: Comparação entre a ressecção endoscópica e cirúrgica do adenocarcinoma esofágico da mucosa no esófago de Barrett em dois centros de grande volume. Ann Surg 2011 Jul;254(1): 67-72. doi: 10.1097/SLA.0b013e31821d4bf6
- Minashi K, Nihei K, Mizusawa J, et al: Eficácia da Ressecção Endoscópica e Quimiorradioterapia Selectiva para Carcinoma Esofágico de Células Escamosas de Estágio I. Gastroenterologia 2019 Ago; 157(2): 382-390.e3. doi: 10.1053/j.gastro.2019.04.017.
- Thuss-Patience P, Vecchione L, Keilholz U: Deve o cancro do esófago cT2 receber tratamento neoadjuvante antes da cirurgia? J Thorac Dis 2017 Set; 9(9): 2819-2823. doi: 10.21037/jtd.2017.08.143.
- van Hagen P, Hulshof MC, van Lanschot JJ, et al: CROSS Group. Quimioradioterapia pré-operatória para o cancro esofágico ou juncional. N Engl J Med 2012 31 de Maio; 366(22): 2074-2084. doi: 10.1056/NEJMoa1112088.
- Sjoquist KM, Burmeister BH, Smithers BM, et al: Australasian Gastro-Intestinal Trials Group. Sobrevivência após quimioterapia neoadjuvante ou quimioradioterapia para o carcinoma de esófago ressecável: uma meta-análise actualizada. Lancet Oncol 2011 Jul;12(7): 681-692. doi: 10.1016/S1470-2045(11)70142-5.
- Ronellenfitsch U, Schwarzbach M, Hofheinz R, et al: GE Adenocarcinoma Meta-analysis Group. Quimioterapia perioperatória versus cirurgia primária para adenocarcinoma ressecável do estômago, junção gastroesofágica, e esófago inferior. Cochrane Database Syst Rev 2013 31 de Maio;(5): CD008107. doi: 10.1002/14651858.CD008107.pub2
- Kelly RJ, Ajani JA, Kuzdzal J, et al: CheckMate 577 Investigadores. Nivolumab Adjuvante em Câncer de Junção Esofágica ou Gastroesofágica Ressecada. N Engl J Med 2021 Abr 1; 384(13): 1191-1203. doi: 10.1056/NEJMoa2032125
- Shah MA, Hofstetter WL, Kennedy EB; Painel de Especialistas em Carcinoma Esofágico Localmente Avançado: Imunoterapia em Pacientes com Carcinoma Esofágico Localmente Avançado: ASCO Tratamento de Carcinoma Esofágico Localmente Avançado Actualização Rápida das Directrizes para o Carcinoma Esofágico. J Clin Oncol 2021 Oct 1;39(28): 3182-3184. doi: 10.1200/JCO.21.01831
- Fok M, Sham JS, Choy D, et al: Radioterapia pós-operatória para o carcinoma do esófago: um estudo prospectivo, randomizado e controlado. Cirurgia 1993 Fev;113(2): 138-147.
- Walsh TN, Noonan N, Hollywood D, et al: Uma comparação da terapia e cirurgia multimodal para o adenocarcinoma esofágico. N Engl J Med 1996 Ago 15; 335(7): 462-467. doi: 10.1056/NEJM199608153350702.
- Conroy T, Galais MP, Raoul JL, et al: Fédération Francophone de Cancérologie Digestive e UNICANCER-GI Group. Quimioradioterapia definitiva com FOLFOX versus fluorouracil e cisplatina em doentes com cancro do esófago (PRODIGE5/ACCORD17): resultados finais de um ensaio aleatório, fase 2/3. Lancet Oncol 2014 Mar; 15(3): 305-314. doi: 10.1016/S1470-2045(14)70028-2.
- Honing J, Smit JK, Muijs CT, et al: Uma comparação de carboplatina e paclitaxel com cisplatina e 5-fluorouracil em quimiorradiação definitiva em doentes com cancro do esófago. Ann Oncol 2014 Mar; 25(3): 638-643. doi: 10.1093/annonc/mdt589.
- Hulshof MCCM, Geijsen ED, Rozema T, et al: Randomized Study on Dose Escalation in Definitive Chemoradiation for Patients With Locally Advanced Esophageal Cancer (Estudo ARTDECO). J Clin Oncol 2021 Set 1; 39(25): 2816-2824. doi: 10.1200/JCO.20.03697.
- Zhu WG, Xua DF, Pu J, et al: Um estudo randomizado, controlado, multicêntrico comparando a radioterapia de intensidade modulada mais a quimioterapia simultânea apenas com a quimioterapia em doentes com cancro gástrico com ressecção D2. Radiother Oncol 2012 Set; 104(3): 361-366. doi: 10.1016/j.radonc.2012.08.024.
- Gkika E, Gauler T, Eberhardt W, et al: Resultados a longo prazo da radiochemoterapia definitiva em cancros localmente avançados do esófago cervical. Dis Esophagus. 2014 Set-Out; 27(7): 678-684. doi: 10.1111/dote.12146.
- Grass GD, Cooper SL, Armeson K, et al: Câncer esofágico cervical: um estudo baseado na população. Head Neck 2015 Jun; 37(6): 808-814. doi: 10.1002/hed.23678.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Cânceres de Junção Esofágica e Esofagogástrica Versão 4.2022 – 7 de Setembro de 2022, acedida em. [24 .11.2022]
- Kato K, Shah MA, Enzinger P, et al: KEYNOTE-590: Estudo de fase III de quimioterapia de primeira linha com ou sem pembrolizumab para cancro esofágico avançado. Futuro Oncol 2019 Abr; 15(10): 1057-1066. doi: 10.2217/fon-2018-0609.
- Doki Y, Ajani JA, Kato K, et al: CheckMate 648 Trial Investigators. Terapia Combinada Nivolumab em Carcinoma Esofágico Avançado de Células Escamosas. N Engl J Med 2022 Fev 3; 386(5): 449-462. doi: 10.1056/NEJMoa2111380.
- Janjigian YY, Shitara K, Moehler M, et al: nivolumab de primeira linha mais quimioterapia versus quimioterapia apenas para junção gástrica avançada, gastro-esofágica, e adenocarcinoma esofágico (CheckMate 649): um ensaio aleatório, de rótulo aberto, fase 3. Lancet 2021 Jul 3; 398(10294): 27-40. doi: 10.1016/S0140-6736(21)00797-2.
- Bang YJ, Van Cutsem E, Feyereislova A, et al: ToGA Trial Investigators. Trastuzumab em combinação com quimioterapia versus quimioterapia apenas para o tratamento do cancro de junção gástrico ou gastro-esofágico avançado HER2-positivo (ToGA): uma fase 3, rótulo aberto, ensaio controlado aleatório. Lancet 2010 Ago 28; 376(9742): 687-697. doi: 10.1016/S0140-6736(10)61121-X.
- Amdal CD, Jacobsen AB, Guren MG, Bjordal K: Resultados relatados pelos doentes na avaliação de radioterapia paliativa e quimioterapia em doentes com cancro do esófago: uma revisão sistemática. Acta Oncol 2013 Maio; 52(4): 679-690. doi: 10.3109/0284186X.2012.731521.
- Grünberger B, Raderer M, Schmidinger M, Hejna M: Quimioterapia paliativa para o cancro esofágico recorrente e metastático. Anticancer Res 2007 Jul-Aug; 27(4C): 2705-2714.
InFo ONCOLOGy & HEMATOLOGy 2022; 10(6): 6-11
PD Martin Leu, MD