A determinação do estado de mutação EGFR e translocações EML-ALK em doentes com adenocarcinoma metastático tem consequências terapêuticas e deve ser solicitada aquando do diagnóstico. O tratamento de manutenção com pemetrexia em pacientes com carcinomas epiteliais não epiteliais de placa encontrou o seu caminho na rotina clínica. Um grande desafio é o desenvolvimento secundário da resistência à terapia oral EGFR TKI ou EGFR. Crizotinib. As terapias de segunda linha estabelecidas para doentes com tumores sem “alvo genético” têm uma actividade limitada, e os actuadores preditivos teriam aqui uma importância considerável.
A nível mundial, o cancro do pulmão continua a ser a malignidade mais comum nos homens e a quarta malignidade mais comum nas mulheres. Embora a incidência do cancro do pulmão de células não pequenas (NSCLC) tenha diminuído ligeiramente nos homens em muitos países durante a última década, o NSCLC está a aumentar nas mulheres em vários países industrializados, por exemplo, de 35 para 39 por 100 000 pessoas no Reino Unido entre 1993 e 2008. A mortalidade proveniente do NSCLC na Europa aumentou 10% nas mulheres entre 2007 e 2012 [1]. Esta é uma triste consequência do tabagismo “emancipado”. Cerca de 85-90% de todos os cancros pulmonares envolvem a variante de células não pequenas, e até dois terços de todos os doentes são diagnosticados na fase metastásica. Para maior clareza, este artigo refere-se ao NSCLC e à fase metastática.
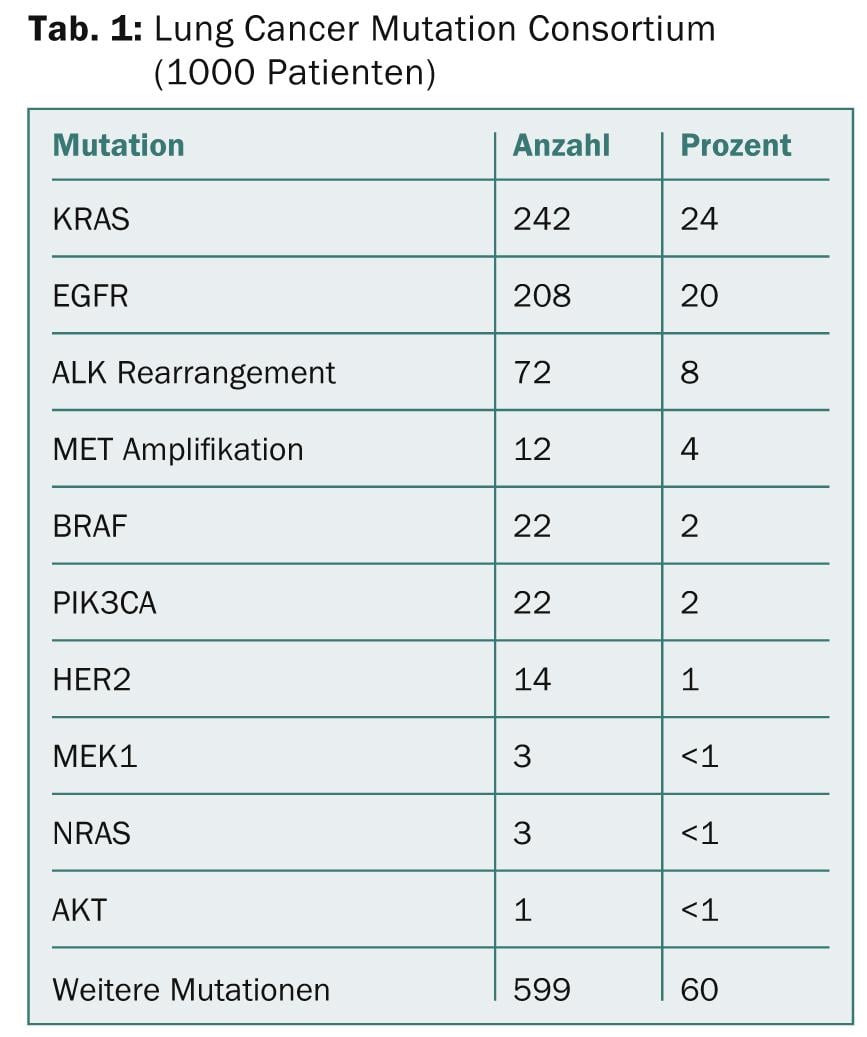
A subclassificação molecular do NSCLC levou à aprovação de potentes medicamentos oncológicos orais em doentes com mutações EGFR activadas (10% dos caucasianos) (erlotinibe, gefitinibe, afatinibe) e em doentes com mutações EGFR (10% dos caucasianos). Tradocações EML-ALK (5% dos caucasianos) (crizotinibe). Outras mutações do condutor no adenocarcinoma (ROS1, RET, HER2, BRAF, KRAS, MET) e carcinoma espinocelular (FGFR1, PIK3CA, DDR2, PTEN) poderiam permitir tratamentos direccionados no futuro [2] (Tabela 1).
Diagnósticos
Para o diagnóstico histopatológico ou citopatológico no caso (frequente) de material tumoral limitado de biópsias com agulha fina ou punção, as recomendações correspondentes foram publicadas em 2011 [3]. Em qualquer caso, a subtilografia em adenocarcinoma ou adenocarcinoma deve ser levada a cabo. O carcinoma espinocelular deve ser visado, e a taxa de tumores que não podem ser mais tipados deve ser limitada a <10%. Nos adenocarcinomas, a determinação primária do estado de mutação EGFR e EML-ALK é recomendada [4].
NSCLC metástático sem provas de activação das mutações EGFR
Tratamento de primeira linha: Tratamento de primeira linha em pacientes sem evidência de activação de mutações EGFR tem em conta o subtipo histológico da doença. Os doentes com adenocarcinomas recebem uma combinação do antifolato pemetrexado e um sal de platina, quer cisplatina na ausência de contra-indicações, quer paraplatina. Em doentes com carcinoma espinocelular do pulmão, o pemetrexado é substituído pela gemzitabina análoga nucleósida ou por um taxano. O tratamento diferenciado de acordo com o histotipo remonta a um ensaio aleatório que mostrou a superioridade da cisplatina/pemetrexa sobre a cisplatina/gemzitabina em adenocarcinomas (sobrevivência global 12,6 vs. 10,9 meses), e vice-versa em carcinomas de células escamosas (10,8 vs. 9,4 meses) [5].
Relativamente à possível adição do anticorpo anti-VEGF bevacizumab à quimioterapia padrão, está a abrir-se uma clara “divisão transatlântica”. O ensaio americano ECOG-4599 mostrou um prolongamento significativo da sobrevivência global de 10,3 para 12,3 meses com a adição de bevacizumab a carboplatina e paclitaxel, com complicações hemorrágicas ocorrendo em 4,4% dos doentes tratados com bevacizumab [6]. No estudo comparativo europeu randomizado AVAiL, bevacizumab foi combinado com cisplatina e gemzitabina sem resultar numa melhoria significativa ou clinicamente relevante na sobrevivência [7]. Apesar destes dados, bevacizumab foi aprovado na Suíça apenas em combinação com cisplatina/gemzitabina, e a sua utilização no NSCLC é limitada.
Pacientes idosos e com um estatuto de desempenho limitado: Referimo-nos normalmente a pacientes com uma idade de pelo menos 70 anos como “idosos”. É mais provável que estes pacientes tenham disfunções orgânicas e um estado de desempenho prejudicado ou que estejam a tomar medicamentos potencialmente interactivos. O desenvolvimento epidemiológico nos países ocidentais explica a importância especial deste grupo de doentes em forte crescimento.
Um ensaio aleatório abordou a questão do tratamento óptimo de primeira linha de pacientes com idades compreendidas entre os 70 e 89 anos com um nível de desempenho de até 2 [8]. Isto mostrou que a quimioterapia combinada com carboplatina e paclitaxel semanal era superior à monoterapia com gemzitabina ou vinorelbina, e levou a uma melhoria na sobrevivência de 6,2 a 10,3 meses. As complicações relacionadas com a quimioterapia não foram mais frequentes do que com a monoterapia. Globalmente, preferimos portanto uma terapia combinada à base de platina também em pacientes mais velhos, bem como em pacientes seleccionados com um estado de desempenho de 2 e com pelo menos um bom funcionamento dos órgãos. As monoterapias são recomendadas no caso de pacientes idosos com estado de desempenho 2 ou comorbidades substanciais.
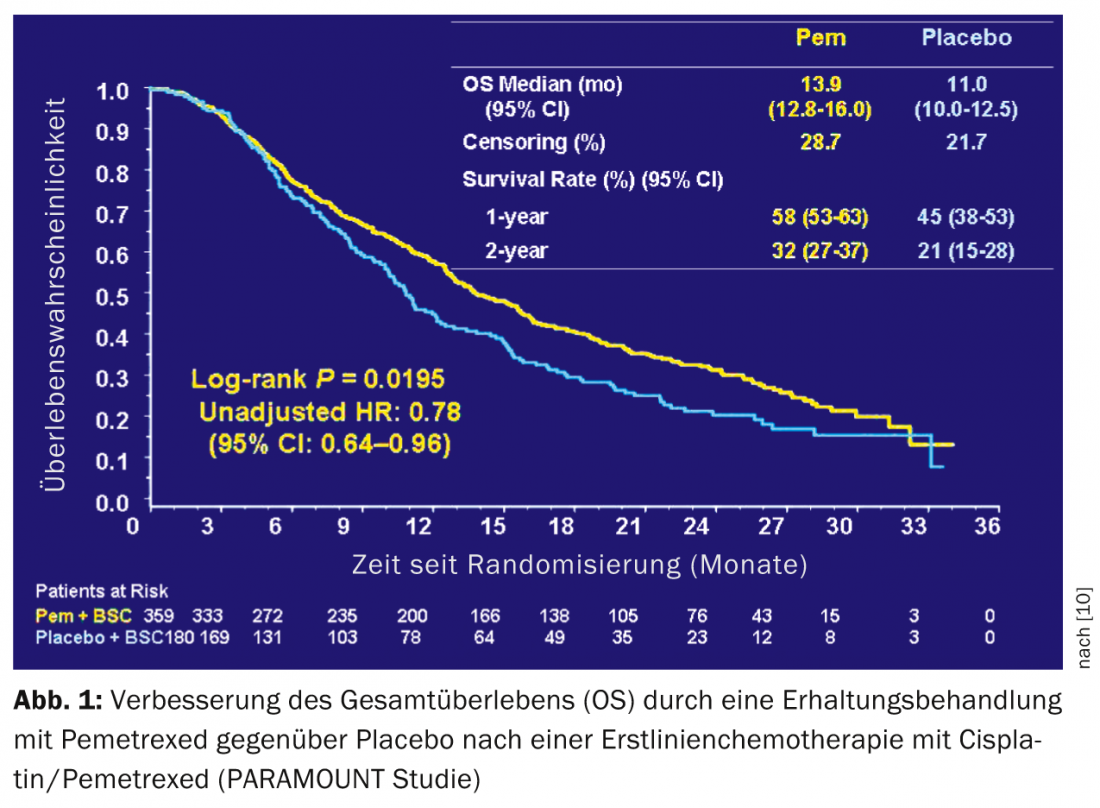
Terapia de manutenção: Dois ensaios randomizados demonstraram o benefício clínico da terapia de manutenção após quatro ciclos de quimioterapia à base de platina [9,10]. O SATURN mostrou uma melhoria significativa mas pequena na sobrevivência de 11 a 12 meses com tratamento de manutenção com erlotinibe. Este benefício também foi demonstrado em doentes com EGFR do tipo selvagem. PARAMOUNT mostrou uma melhoria na sobrevivência de 11,0 para 13,9 meses com tratamento de manutenção com pemetrexed após quatro ciclos de cisplatina/pemetrexed em doentes com carcinoma não-químico de células do pulmão (Fig.1). O tratamento de manutenção com pemetrexed tornou-se uma estratégia comum neste grupo de doentes, sobretudo devido à boa tolerância ao pemetrexed.
Terapia de segunda linha: Em média, os pacientes com NSCLC metastáticos experimentam a progressão da doença cinco meses após o início da terapia de primeira linha, e muitos destes pacientes são elegíveis para uma segunda linha de terapia. Os medicamentos oncológicos mais utilizados são o pemetrex, o docetaxel e o inibidor anti-EGFR da tirosina quinase erlotinib. Enquanto o docetaxel e o erlotinibe não têm restrições de subtipo histológico, o pemetrexed só é aprovado para diferenciação predominantemente adenocarcinoma. O ensaio TAILOR publicado em 2013 mostrou um benefício de sobrevivência da terapia docetaxel de segunda linha sobre o erlotinibe em doentes com NSCLC metastático e EGFR de tipo selvagem (8,2 vs. 5,4 meses) [11]. No entanto, o benefício de sobrevivência no estudo TAILOR é estatisticamente significativo e a relevância clínica dos resultados é controversa.
NSCLC metástático com activação das mutações EGFR
A procura de activação de mutações EGFR em doentes com adenocarcinoma metastático ou, no caso de carcinoma espinocelular, em “poucos fumadores” (<15 pack-years) é recomendada no diagnóstico [4]. Em pacientes com mutações EGFR activadas, a terapia de primeira linha com um inibidor oral anti-EGFR da tirosina quinase (erlotinibe, gefitinibe) deve ser preferida à quimioterapia. O EURTAC mostrou uma melhoria substancial na sobrevivência sem progressão em pacientes com mutações EGFR activadas tratadas com erlotinibe versus quimioterapia combinada à base de platina (9,7 e 5,2 meses, respectivamente) [12]. Foram apresentados resultados comparáveis no ensaio asiático IPASS (gefitinib) [13] e no ensaio LUX-Lung-6 (afatinib) [14]. Apesar do exantema acneiforme frequente durante o tratamento com inibidores anti-EGFR de tirosina cinase, a tolerância subjectiva é muito boa em geral, e o tratamento apropriado também pode ser considerado em pacientes com um estado de desempenho >2. O inibidor irreversível anti-EGFR tirosina quinase afatinibe foi aprovado pela EMA em Setembro de 2013; a aprovação Swissmedic foi concedida em Janeiro de 2014.
NSCLC metástático com translocações EML-ALK (ALK+)
Cerca de 5% de todos os caucasianos com NSCLC têm uma translocação EML-ALK (ALK+). Os primeiros dados randomizados sobre crizotinibe vs quimioterapia em pacientes com ALK+ NSCLC após falha da quimioterapia de primeira linha (PERFIL 1007) mostraram uma melhoria substancial na sobrevivência sem progressão de 3,1 a 7,7 meses [15] (Fig. 2).
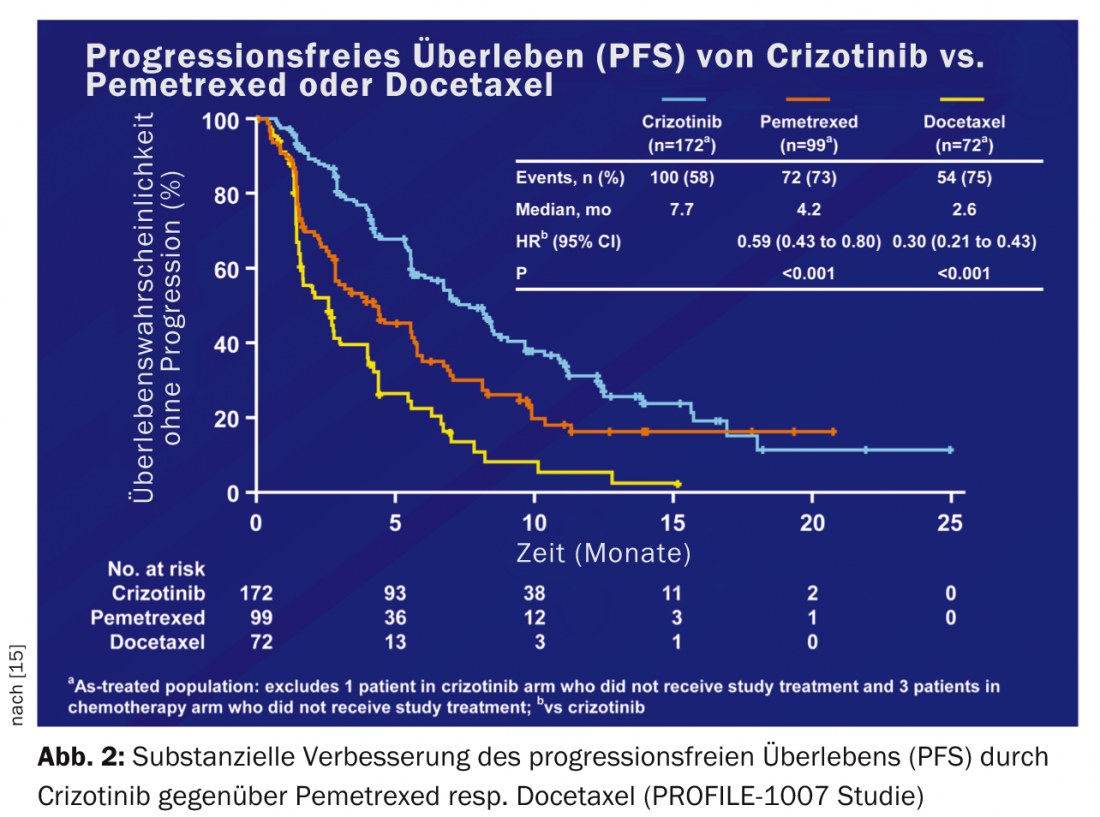
Devido ao inevitável desenvolvimento da resistência, existem actualmente esforços intensivos para desenvolver inibidores ALK de segunda geração. Os compostos mais avançados são o inibidor oral de ALK/EGFR AP26113 e os inibidores puros de ALK LDK378 e CH5424802. Para além da boa actividade em tumores ALK+ resistentes, estas substâncias têm também a vantagem da mobilidade do SNC.
PD Dr. med. et rer. nat. Markus Joerger
Literatura:
- Malvezzi M, et al: Previsões europeias de mortalidade por cancro para o ano 2012. Ann Oncol 2012; 23: 1044-1052.
- Ujhazy P, Herbst R: Terapia personalizada. J Thorac Oncol 2012; 7: S401-403.
- Travis WD, et al: International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma. J Thorac Oncol 2011; 6: 244-285.
- Peters S, et al: Cancro do pulmão metástático não de pequenas células (NSCLC): Directrizes de Prática Clínica da OMPE para diagnóstico, tratamento e acompanhamento. Ann Oncol 2012; 23 Suppl 7: vii56- 64.
- Scagliotti GV, et al: Estudo de fase III comparando cisplatina mais gemcitabina com cisplatina mais pemetrex em quimioterapia – pacientes ingénuos com cancro do pulmão em fase avançada não de pequenas células. J Clin Oncol 2008; 26: 3543-3551.
- Sandler A, et al: Paclitaxel-carboplatina sozinho ou com bevacizumab para o cancro do pulmão de células não pequenas. N Engl J Med 2006; 355: 2542-2550.
- Reck M, et al: Sobrevivência global com cisplatin-gemcitabina e bevacizumab ou placebo como terapia de primeira linha para o cancro do pulmão não-químico não pequeno: resultados de um ensaio aleatório de fase III (AVAiL). Ann Oncol 2010; 21: 1804-1809.
- Queixo E, et al: Quimioterapia de carboplatina e paclitaxel doublet semanal em comparação com monoterapia em doentes idosos com cancro do pulmão avançado de células não pequenas: ensaio IFCT-0501 aleatorizado, fase 3. Lancet 2011; 378: 1079-1088.
- Cappuzzo F, et al: Erlotinib como tratamento de manutenção em cancro do pulmão avançado de células não pequenas: um estudo multicêntrico, randomizado e controlado por placebo de fase 3. Lancet Oncol 2010; 11: 521-529.
- Paz-Ares LG, et al: PARAMOUNT: Resultados finais de sobrevivência global do estudo fase III de manutenção pemetrexed versus placebo imediatamente após tratamento de indução com pemetrexed plus cisplatina para cancro do pulmão avançado não pequeno de células pequenas. J Clin Oncol 2013; 31: 2895-2902.
- Garassino MC, et al: Erlotinib versus docetaxel como tratamento de segunda linha de pacientes com cancro do pulmão avançado de células não pequenas e tumores EGFR do tipo selvagem (TAILOR): um ensaio controlado aleatório. Lancet Oncol 2013; 14: 981-988.
- Rosell R, et al: Erlotinib versus quimioterapia padrão como tratamento de primeira linha para doentes europeus com cancro do pulmão não-pulmão de células pequenas (EURTAC) avançado por mutação EGFR-positivo: um ensaio multicêntrico, com rótulo aberto, fase 3 aleatorizada. Lancet Oncol 2012; 13: 239-246.
- Mok TS, et al: Gefitinib ou carboplato-paclitaxel em adenocarcinoma pulmonar. N Engl J Med 2009; 361: 947-957.
- Wu YL, et al: Afatinib versus cisplatina mais gemcitabina para o tratamento de primeira linha de doentes asiáticos com cancro do pulmão avançado de células não pequenas que alberga mutações EGFR (LUX-Lung 6): um ensaio de fase 3 aleatorizado e aberto. Lancet Oncol 2014; 15: 213-222.
- Shaw AT, et al: Crizotinib versus quimioterapia no cancro do pulmão avançado ALK-positivo. N Engl J Med 2013; 368: 2385-2394.
InFo ONCOLOGY & HEMATOLOGY 2014; 2(4): 10-12