Os linfomas são responsáveis por 3,8% de todos os novos diagnósticos de cancro. De acordo com a actual classificação da OMS, existem mais de 75 linfomentidades diferentes, que são tratadas de forma diferente. No tratamento do linfoma difuso de grandes células B (DLBCL), do linfoma periférico de células T e do linfoma clássico de Hodgkin, muita coisa tem acontecido nos últimos anos.
De acordo com as classificações anteriormente utilizadas, os linfomas são tradicionalmente divididos nos chamados linfomas Hodgkin e linfomas não-Hodgkin. Esta classificação ainda é utilizada nas estatísticas individuais e serve de base para o registo da incidência nacional (www.nkrs.ch/de/stat). De acordo com esta recolha de dados, pouco menos de 1600 pacientes por ano na Suíça desenvolvem linfoma não-Hodgkin e cerca de 250 linfoma de Hodgkin. Os linfomas são responsáveis por 3,8% de todos os novos diagnósticos de cancro. A taxa anual de mortalidade é ligeiramente superior a 500 mortes. Assim, os linfomas são responsáveis por 3,2% de todas as mortes por cancro.
Classificação e apresentação clínica actual da OMS
A Organização Mundial de Saúde (OMS) já criou várias classificações para linfomas e substituiu cada vez mais o termo linfoma não-Hodgkin por uma nomenclatura clara e subtipagem de entidades individuais. A classificação actualmente válida a partir de 2016 inclui mais de 75 linfomentidades [1]. Baseia-se na diferente morfologia, na apresentação clínica e cada vez mais também nos aspectos moleculares ou genéticos.
Na minha opinião, esta classificação é muito importante, uma vez que o diagnóstico, prognóstico e terapia diferem fundamentalmente em alguns casos. Os termos indolentes e agressivos devem hoje em dia ser utilizados principalmente em relação ao comportamento de crescimento do respectivo linfoma. Aproximadamente 50% de todos os linfomas pertencem aos linfomas de crescimento lento e são assim chamados indolentes. Os outros 50% são linfomas de crescimento rápido e, portanto, bastante agressivos. Nesta compilação, gostaria de discutir brevemente a terapia de linfomas agressivos seleccionados.
Terapia do linfoma difuso de grandes células B (DLBCL)
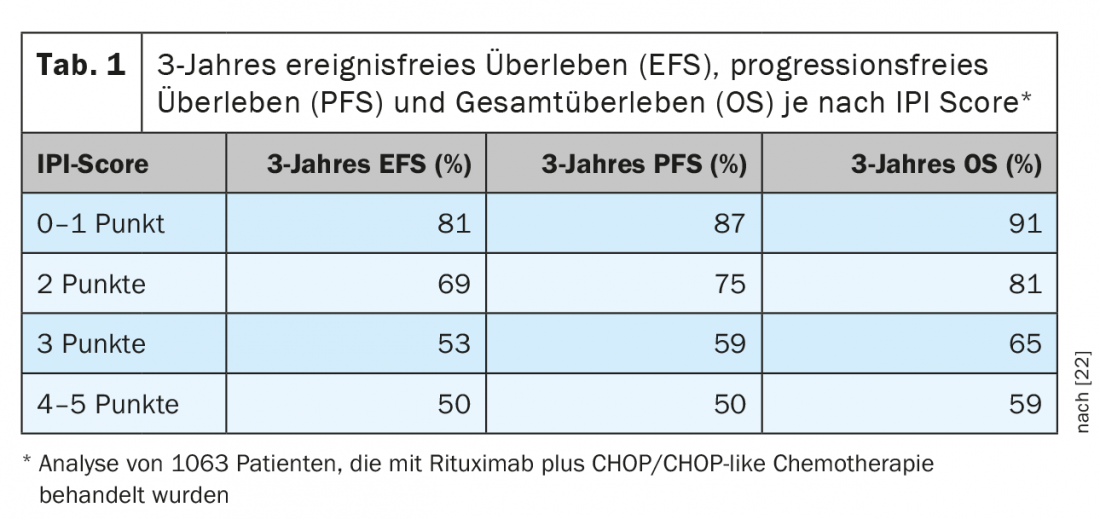
O DLBCL é responsável por 25-30% de todos os linfomas e é assim a entidade de linfoma mais comum. Pertencem aos agressivos linfomas de células B. Na maioria dos casos, o objectivo do tratamento deve ser o controlo ou cura de doenças a longo prazo. Isto só é normalmente conseguido através de imunochemoterapia intensiva, que se baseia na combinação de um anticorpo específico CD20 com poliquimioterapia. Tipicamente, é utilizado um regime CHOP ou semelhante ao CHOP. No que diz respeito ao prognóstico, existem entretanto vários sistemas de avaliação. A estratificação de risco mais utilizada e em grande parte ainda válida baseia-se no chamado “International Prognostic Index (IPI)” (Tab. 1) [2]. Para pacientes com menos de 60 anos de idade, é frequentemente utilizado o chamado “Índice Internacional de Prognóstico (aaIPI) adaptado à idade”. Com base nesta classificação, os pacientes DLBCL podem ser divididos em quatro grupos. Embora as pessoas com mais de 60 anos não sejam subtilografadas, existem três grupos na faixa etária inferior a 60 anos: Fase inicial com prognóstico favorável (aaIPI 0), pacientes mais jovens com prognóstico desfavorável (aaIPI 1 e/ou a granel) e como terceiro grupo os chamados pacientes de alto risco (aaIPI ≥2).
Para o tratamento de pacientes mais velhos (>60 anos), são frequentemente utilizados seis ciclos de Rituximab + CHOP, principalmente a intervalos de 21 dias e raramente a cada 14 dias. A superioridade de um regime de 14 dias estabelecido pelo grupo de estudo alemão DSHNL [3] não pôde ser confirmada pelos ingleses [4], nem pelo grupo de estudo francês [5], pelo que não é dada uma comparabilidade directa dos estudos. O benefício de oito ciclos de R-CHOP em comparação com seis ciclos no regime de 21 dias não foi aleatório. Contudo, análises retrospectivas do ensaio GOYA fase III aleatorizado [6], em que foi dada aos centros a escolha entre seis e oito ciclos, não mostraram qualquer diferença na eficácia. Assim, seis ciclos de R-CHOP a cada 21 dias é muitas vezes considerado padrão. A administração adicional de imunoterapia duas vezes como sétimo e oitavo ciclo de tratamento sob a forma de duas doses adicionais de rituximab no chamado “regime 6 + 2” também não provou ser superior no estudo PETAL [7].
Em pacientes mais jovens com menos de 60 anos de idade com ausência de factores de risco e prognóstico favorável (aaIPI 0, sem volume), quatro ciclos de R-CHOP-21 demonstraram proporcionar uma excelente sobrevivência sem progressão (PFS) e sobrevivência global (OS) no ensaio FLYER recentemente publicado [8]. Isto permite uma redução da dose e uma redução significativa da morbilidade relacionada com a terapia com elevadas taxas de cura (3 anos PFS 96% vs. 93%). Para o segundo grupo de pessoas com menos de 60 anos com aaIPI 1 e/ou granel, seis ciclos de R-CHOP-21 com radioterapia de consolidação do granel inicial são considerados padrão. No estudo MINT de DSHNHL [9], a sobrevivência livre de eventos de 6 anos (EFS) com esta terapia foi de 71%. O grupo de estudo francês GELA/LYSA mostrou superioridade do regime R-ACVBP [10] sobre o R-CHOP-21 para este colectivo. No entanto, este resultado deve ser questionado criticamente porque, ao contrário do estudo DSHNHL, não foi utilizada radioterapia.
Os doentes mais jovens de alto risco (aaIPI ≥ 2) continuam infelizmente a ter um risco mais elevado de recorrência e, por conseguinte, menores possibilidades de cura. A terapia óptima para esta população de doentes não está uniformemente definida. Alguns grupos de estudo utilizam o esquema R-CHOP-21 mencionado anteriormente [4]. Outros centros de estudo, tais como centros individuais americanos e europeus, realizam a priori a consolidação da terapia de alta dose com transplante autólogo de células estaminais na primeira linha de terapia. DSHNHL testou oito ciclos de R-CHOEP-14 contra uma abordagem de tripla transplantação no ensaio MEGA-CHOEP [11]. Foi demonstrada a superioridade (3 anos EFS 69,5% vs. 61,4%) do braço 8 x R-CHOEP-14. No âmbito americano, o R-DA-EPOCH é frequentemente utilizado em vez do regime R-CHOEP. Em geral, a maioria dos centros favorece um regime de tratamento mais dose-intensivo do que um regime padrão R-CHOP.
Em particular, a terapia de doentes jovens de alto risco mostra que a terapia de primeira linha da DLBCL é decisiva para o prognóstico. Se a doença recair dentro de 12-18 meses, o prognóstico é muitas vezes pobre e apenas alguns pacientes podem ainda alcançar a remissão a longo prazo. Contudo, se os pacientes não tiverem tido uma recaída nos primeiros 18 -24 meses após o fim da terapia, o controlo de doenças a longo prazo com altas taxas de cura é muito mais comum. Isto mostra que um conceito curativo deve ser escolhido, na medida do possível, no contexto da terapia de primeira linha. Nos últimos anos, a biologia molecular permitiu-nos obter uma visão mais profunda dos patomecanismos subjacentes à doença e vários estudos, baseados no já mencionado e estabelecido regime R-CHOP, estudaram o valor terapêutico dos diferentes inibidores de sinalização. Por exemplo, o bortezomib inibidor do proteasoma também foi testado na Suíça [12]. Infelizmente, não houve benefício de tratamento na população em geral. A adição do imunomodulador lenalidomida ao R-CHOP também não mostrou nenhum benefício significativo no ensaio ROBUST prospectivamente randomizado [13]. Estão actualmente em curso estudos sobre a utilização de inibidores BTK (ex. ibrutinibe) [14], bem como de inibidores BCL2 (venetoclax) [15]. Estudos e análises de subgrupos da fase inicial II sugeriram certas vantagens para as duas últimas substâncias. No entanto, ainda não foi provado que estes agentes apresentem uma superioridade significativa em relação ao padrão actual, pelo que nem os inibidores BTK nem os BCL2 são actualmente objecto da nossa rotina diária. Como novo conceito terapêutico, no caso de uma recaída, ou seja, em pacientes mais velhos após duas terapias anteriores e em pacientes mais jovens, em regra, após duas terapias anteriores, incluindo o tratamento com uma única terapia, foi possível provar a eficácia da terapia. Terapia de alta dose com substituição de células estaminais autólogas, estabelecendo a tecnologia de células T de CAR [16]. Isto está disponível em centros especializados na Suíça.
Terapia dos linfomas periféricos agressivos de células T (PTCL)
Os linfomas de células T representam cerca de 10% de todos os novos casos de linfoma no mundo ocidental. A classificação histopatológica e molecular das entidades individuais de linfoma de células T é complexa e, infelizmente, devido à raridade da doença, apenas se encontram frequentemente disponíveis dados muito limitados de estudos randomizados de maior envergadura. O prognóstico dos linfomas agressivos de células T é geralmente menos favorável do que o dos linfomas agressivos de células B. Apenas o chamado “ALK+ linfoma periférico de células T (PTCL)” é frequentemente classificado como tendo um melhor prognóstico. Os outros subtipos do PTCL mostram na sua maioria um curso rápido da doença com frequentemente apenas uma resposta de curta duração à terapia. A detecção do antigénio CD30 nas células do linfoma é importante para o tratamento com PTCL. De acordo com o estudo ECHELON-2, se isto for expresso, uma melhoria significativa em PFS de 3 anos (57% vs. 44%) e OS pode ser alcançada com a combinação de brentuximab vedotina como um imunoconjugador mais quimioterapia CHP [17]. O estudo comparou este tratamento com o actual regime padrão CHOP. Os centros de estudo eram livres de aplicar a terapia durante seis ou oito ciclos de cada vez. Brentuximab vedotin, tal como o alcalóide vincristina vinca, tem uma elevada neurotoxicidade, de modo que no braço experimental a vincristina teve de ser parada quando o brentuximab vedotin foi adicionado. Assim, a quimioterapia foi reduzida de CHOP para CHP. Como mencionado acima, além do benefício PFS, foi também observado um benefício OS. Como consequência, esta terapia é actualmente considerada o padrão ouro para o PTCL CD30-positivo na primeira linha. Infelizmente, outras substâncias terapêuticas tais como inibidores HDAC, imunoconjugados, anti-metabolitos e agentes quimioterápicos clássicos têm apenas uma duração de acção muito limitada no PTCL. Portanto, após o fracasso dos tratamentos terapêuticos intensivos, muitas vezes só estão disponíveis opções paliativas com eficácia curta.
Terapia do linfoma clássico de Hodgkin (cHL)
No tratamento do linfoma clássico de Hodgkin, muitos colegas seguem as directrizes do Grupo de Estudo do Linfoma de Hodgkin Alemão (GHSG). De acordo com a estratificação do GHSG, os doentes com NHC estão divididos em três grupos de risco. A última geração de ensaios concluída e publicada inclui os ensaios HD16-HD18 para o tratamento de pacientes com fases iniciais (HD16), intermédias (HD17) e avançadas (HD18). O estudo HD16 testou se a radioterapia consolidativa poderia ser omitida no caso da negatividade PET após dois ciclos de ABVD (a chamada “negatividade PET2”). De acordo com os resultados do estudo, a radioterapia não deve ser omitida, uma vez que o PFS de 5 anos cai de 93,4% com radioterapia para 86% sem radioterapia, pelo que se pode esperar um resultado significativamente pior da terapia se a radioterapia for omitida [18].
Na fase intermédia, uma questão semelhante foi abordada no estudo HD17 [19]. Para os pacientes correspondentes, a quimioterapia inclui como padrão dois ciclos de BEACOPPPescalated (BEACOPPPesc), seguidos de dois ciclos de ABVD. Após estes quatro ciclos terapêuticos, um PET-CT é classicamente realizado (o chamado “PET4”). No estudo HD17, a radioterapia geralmente administrada foi omitida para a negatividade PET4. Usando este regime terapêutico, foi demonstrado um PFS de 5 anos de 97% no braço padrão (com radioterapia) e de 95,1% no braço experimental, ou seja, com omissão de radioterapia em caso de negatividade PET4. Assim, o tratamento com omissão de radioterapia não foi inferior à terapia padrão com resultados PET correspondentes. De acordo com este estudo, é portanto possível dispensar a consolidação da radioterapia no caso da negatividade do PET4 após quatro ciclos de quimioterapia.
Os dados do estudo HD18 sobre o tratamento de fases avançadas de cHL já foram mostrados em vários congressos [20]. No âmbito do estudo, seis ciclos de BEACOPPesc foram definidos como a norma terapêutica do GHSG. No braço experimental, a negatividade do PET2 foi testada para ver se mais dois ciclos BEACOPPesc – um total de quatro em vez de seis – eram suficientes. O estudo mostrou um PFS de 5 anos de 91,2% no braço padrão de seis ciclos do BEACOPPesc. O braço guiado pelo PET2 mostrou um resultado comparável de 91,8%. Assim, no caso da negatividade PET2, uma redução da dose para um total de quatro ciclos pode agora ser levada a cabo. Este é um avanço significativo, especialmente devido à idade frequentemente jovem dos doentes com insuficiência renal. A redução da dose pode contrariar a morbilidade associada à terapia e, em particular, a infertilidade induzida pela quimioterapia. Espera-se que com o novo padrão de cuidados, ocorram menos neoplasias de segundo grau no decurso da vida.
A CHL é uma das entidades com as mais altas taxas de resposta à terapia inibidora PD1. No caso de recorrência da BVS, penso que a publicação do estudo KEYNOTE-204 é significativa para a prática clínica diária [21]. Neste estudo, a utilização do inibidor PD1 pembrolizumab vs. brentuximab vedotina foi testada em doentes com BVS recaída, numa comparação aleatória. Na análise apresentada na Reunião Anual de 2020 da ASCO, foi relatada a superioridade do bloqueio PD1 com uma taxa de resposta mais elevada (65% vs 54%) e uma mediana mais longa do PFS de 13,2 vs 8,3 meses. Além disso, o bloqueio PD1 mostrou uma toxicidade significativamente menor, especialmente neurotoxicidade, de modo que, para além da eficácia, a tolerabilidade também fala a favor do uso precoce da imunoterapia no tratamento das recidivas de NHC.
Mensagens Take-Home
- No tratamento dos linfomas agressivos das células B, é possível obter altas taxas de cura através do uso da imuno-chemoterapia.
- A terapia dos linfomas agressivos das células B é estratificada com 4-6(8) ciclos de imuno-chemoterapia (tipo R-CHOP ou R-CHOP).
- Os linfomas agressivos de células T têm geralmente um prognóstico muito pior em comparação com os linfomas agressivos de células B.
- A utilização da imunotoxina brentuximab vedotina CD30 em combinação com quimioterapia CHP no PTCL positivo CD30 é considerada padrão.
- CHL é tratada com quimioterapia ou quimioterapia mais radioterapia de acordo com o estádio e o risco e tem excelentes taxas de cura. O objectivo de novas abordagens terapêuticas é muitas vezes reduzir a dose para evitar a morbilidade relacionada com a terapia, mantendo simultaneamente altas taxas de cura.
Literatura:
- Swerdlow SH, et al: Classificação da OMS de tumores de tecido hematopoiético e linfóide. 4ª ed. revista de Lyon: IARC; 201.
- O Projecto Internacional de Factores de Prognóstico do Linfoma Não-Hodgkin. Um modelo preditivo para o linfoma agressivo não-Hodgkin. N Engl J Med 1993; 329: 987-994.
- Pfreundschuh M, et al: Seis contra oito ciclos de CHOP-14 quinzenais com ou sem rituximab em doentes idosos com linfomas agressivos de células CD20+ B: um ensaio controlado aleatorizado (RICOVER-60). Lancet Oncol 2008; 9: 105-116.
- Cunningham D, et al: Rituximab mais ciclofosfamida, doxorubicina, vincristina, e prednisolona em doentes com linfoma difuso grande de células B não-Hodgkin recentemente diagnosticado: Uma comparação fase 3 de intensificação da dose com ciclos de 14 dias versus 21 dias. Lancet 2013; 381: 1817-1826.
- Delarue R, et al: Dose-dense rituximab-CHOP comparado com rituximab-CHOP padrão em pacientes idosos com linfoma difuso de grandes células B (o estudo LNH03-6B): um ensaio aleatório da fase 3. Lancet Oncol 2013; 14: 525-533.
- Sehn LH, et al: Um estudo randomizado, aberto, fase III de obinutuzumab ou rituximab mais CHOP em doentes com linfoma difuso de células B grande previamente não tratado: análise final de GOYA. J Hematol Oncol. 2020; 13(1): 71-79.
- Schmitz C, et al.: Impacto da ressecção cirúrgica completa no resultado em linfoma agressivo não-Hodgkin tratado com imunochemoterapia. Cancer Med 2020; 9(22): 8386-8396.
- Poeschel V, et. al: Quatro contra seis ciclos de quimioterapia CHOP em combinação com seis aplicações de rituximab em doentes com linfoma agressivo de células B com prognóstico favorável (FLYER): um ensaio aleatório, fase 3, não-inferioritário. Lancet.2019; 394 (10216): 2271-2281.
- Pfreundschuh M, et al: quimioterapia tipo CHOP com ou sem rituximab em pacientes jovens com linfoma de células B grandes difusas de bom prognóstico: resultados de 6 anos de um estudo aleatório com rótulo aberto do Grupo MabThera International Trial (MInT). Lancet Oncol 2011; 12: 1013-1022.
- Recher C et al: Quimioterapia intensificada com ACVBP plus rituximab versus CHOP plus rituximab padrão para o tratamento de linfoma difuso de grandes células B (LNH03-2B): Um ensaio de fase 3 randomizado de rótulo aberto. Lancet 2011; 378: 1858-1867.
- Schmitz N, et al: Quimioterapia convencional (CHOEP-14) com rituximab ou quimioterapia de alta dose (MegaCHOEP) com rituximab para pacientes jovens de alto risco com linfoma agressivo de células B: um ensaio de fase 3, aleatorizado e aberto (DSHNHL 2002-1). Lancet Oncol 2012; 13: 1250-1259.
- Davies A, et al: perfil gene-expressão do bortezomib adicionado à quimioimunoterapia padrão para linfoma difuso de grandes células B (REMoDL-B): um ensaio de fase 3, aleatorizado e aberto. Lancet Oncol. 2019; 20(5): 649-662.
- Lue JK, O’Connor OA: Uma perspectiva para melhorar o regime R-CHOP: de Mega-CHOP a ROBUST R-CHOP, o PHOENIX ainda não se levantou. Lancet Haematol 2020; 7(11): e838-e850.
- Younes A, et al: Ensaio Fase III Aleatório de Ibrutinibe e Rituximab Plus Ciclofosfamida, Doxorubicina, Vincristina, e Prednisona no Centro Não-Germinal de Linfoma de Células B Difuso Grande de Células B. J Clin Oncol 2019; 37(15): 1285-1295.
- Morschhauser F, et al: Um estudo fase 2 de venetoclax mais R-CHOP como tratamento de primeira linha para doentes com linfoma difuso de grandes células B. Sangue 2021; 137(5): 600-609.
- Schuster SJ, et al: Células T do receptor quimérico de antígeno em linfomas refractários de células B. N Engl J Med 2017; 377: 2545-2554.
- Horwitz S, et al: Grupo de Estudo ECHELON-2. Brentuximab vedotin com quimioterapia para linfoma periférico de células T CD30-positivo (ECHELON-2): um ensaio global, duplo-cego, randomizado, fase 3. Lancet 2019; 393(10168): 229-240.
- Fuchs M, et al: Tratamento guiado por tomografia de emissão de positrões em fase inicial favorável ao linfoma de Hodgkin: Resultados finais do ensaio internacional, aleatório fase III HD16 pelo Grupo de Estudo Hodgkin alemão. J Clin Oncol 37 2019; 31: 2835-2845.
- Borchmann P, et al: omissão guiada por PET de radioterapia no linfoma Hodgkin desfavorável em fase inicial (GHSG HD17): um ensaio multicêntrico, aberto, randomizado, fase 3. Lancet Oncol 2021; 22(2): 223-234.
- Borchmann P, et al: tratamento guiado por PET em pacientes com linfoma de Hodgkin em fase avançada (HD18): resultados finais de um ensaio de fase 3 aberto, internacional, aleatorizado pelo Grupo de Estudo Hodgkin alemão. Lancet 2018; 390(10114): 2790-2802.
- Kuruvilla J, et al.: KEYNOTE-204: Randomized, open-label, phase III study of pembrolizumab (pembro) versus brentuximab vedotin (BV) in relapsed or refractory classic Hodgkin lymphoma (R/R cHL). Apresentado no Programa Científico Virtual da Sociedade Americana de Oncologia Clínica (ASCO) de 2020. 29-31 de Maio de 2020. Resumo 8005.
- Ziepert M, et al: Standard International prognostic index continua a ser um preditor válido de resultados para doentes com linfoma agressivo de células B CD20+ na era do rituximab. J Clin Oncol. 2010; 28: 2373.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(2): 10-13