A síndrome do intestino curto (SBS) é uma forma de falência intestinal que ocorre após uma ressecção intestinal extensa ou devido a outras limitações funcionais dos segmentos intestinais. Dependendo da extensão da restrição, são indicadas outras formas de suplementos nutricionais. Com a ajuda de uma terapia nutricional específica, alguns pacientes podem ter a oportunidade de se alimentarem oralmente de forma autónoma novamente.
A síndrome do intestino curto é uma doença rara, potencialmente fatal, cuja prevalência na Alemanha é estimada em 34 por milhão de habitantes [1]. A actual directriz S3 da Sociedade Alemã de Medicina Nutricional (DGEM) define falha intestinal como a incapacidade de manter o equilíbrio de proteínas, energia, fluidos e micronutrientes devido a uma capacidade de absorção limitada do intestino (obstrução, dismotilidade, doenças congénitas, absorção reduzida associada a doenças) [2]. A síndrome do intestino curto é uma forma de falência intestinal que ocorre após uma ressecção intestinal extensa ou devido a outra limitação funcional dos segmentos intestinais. As causas mais comuns incluem carcinoma, enfarte mesentérico, doença de Crohn e hemorragia pós-operatória [3].
O KDS é clinicamente indicado logo que o comprimento do intestino restante seja inferior a 200 cm [4]. A extensão da desnutrição e os sintomas individuais dependem de qual secção do intestino é afectada e até que ponto, especialmente porque são absorvidas diferentes substâncias, dependendo da secção. Os processos adaptativos, a doença subjacente e a comorbidade também têm influência [5].
Tipagem e suplemento nutritivo
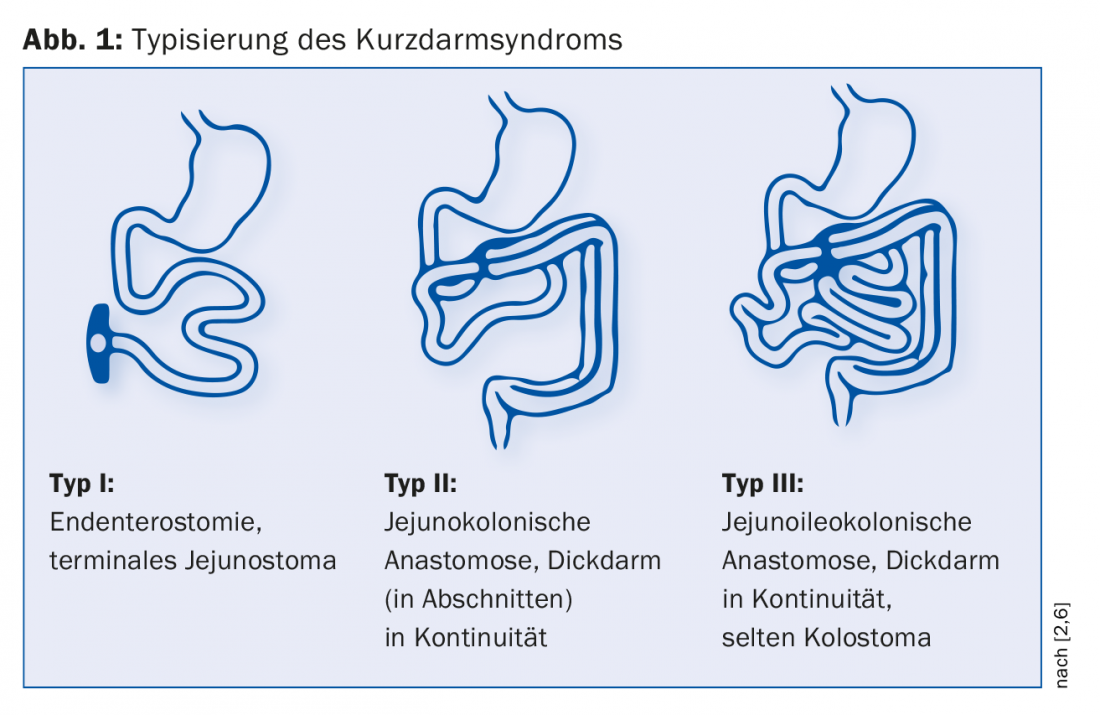
De acordo com Messing, distinguem-se três tipos de KDS pós-operatórios (Fig. 1) [6]. A endenterostomia é o caso mais difícil devido à ausência tanto do íleo como do cólon. “Há aqui grandes problemas como a desidratação com alta produção de estoma”, explica o Dr. Krieger-Grübel. Que tipo está presente influencia significativamente o curso da doença: “Se houver menos de um metro de intestino delgado residual com um estoma intestino delgado terminal, os pacientes estão dependentes da nutrição parenteral e de soluções salinas. Se, por outro lado, têm mais de um metro de intestino delgado disponível e o cólon está presente em continuidade, provavelmente não precisam de tratamento nutricional de apoio a longo prazo”. A influência do comprimento do intestino restante na mortalidade foi demonstrada num estudo: Após cinco anos, a probabilidade de sobrevivência dos doentes com cólon em continuidade era 30% maior do que a dos doentes com endenterostomia [6].
Terapia nutricional por fases
O objectivo principal é assegurar o equilíbrio de fluidos e nutrientes e a profilaxia de complicações. Dependendo do estado do tracto gastrointestinal, os pacientes devem também ser autorizados a alimentar-se oralmente de forma autónoma com terapia apropriada [7].
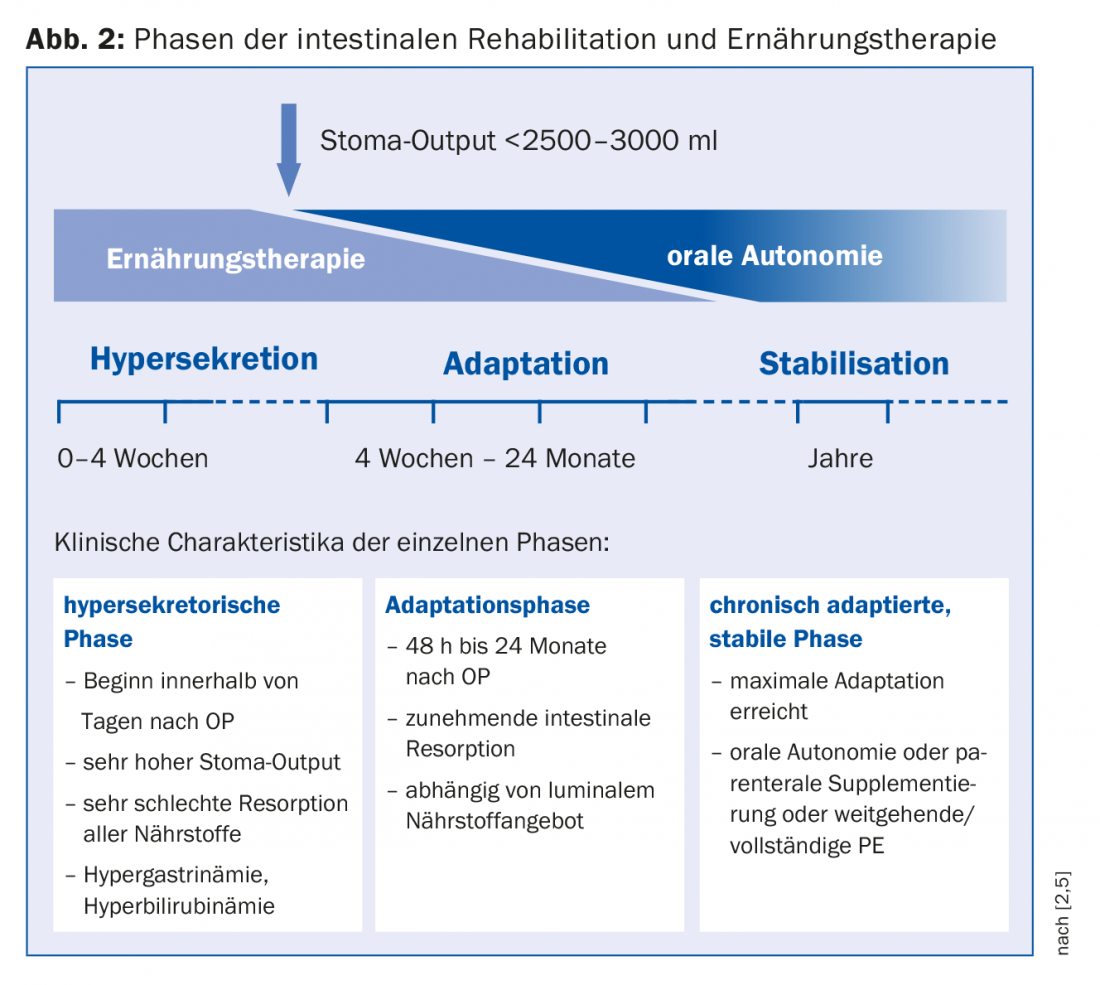
Para o planeamento terapêutico, é adequada uma divisão em fase de hipersecreção, fase de adaptação e fase de estabilização, em que estas fases se fundem umas nas outras (Fig. 2) [1]. Cada fase requer uma estratégia nutricional específica. Imediatamente após a cirurgia, a hipersecreção ocorre sob a forma de estoma e diarreia de alto rendimento. Aqui, a nutrição parenteral (PE) é inevitável devido à má absorção de todos os nutrientes. A monitorização da homeostase de fluidos é central. Para verificar o estado de hidratação (são necessários 15 ml de fluido/kg de peso corporal para excretar substâncias urinárias), o sódio é adequado como parâmetro sensível, sendo considerada suficiente uma quantidade de >20 mmol/l. Quando a saída do estoma pode ser reduzida (<2500-3000 ml), a alimentação oral pode ser iniciada. “A nutrição enteral é o verdadeiro desencadeador da proliferação celular”, sublinha o Dr. Krieger-Grübel. Conduz ao crescimento celular, bem como a um aumento das vilosidades e, através do aumento do fluxo sanguíneo intestinal, a uma melhor capacidade de absorção. Contudo, uma vez que é de esperar, em princípio, uma maior procura de energia, a EP não deve ser interrompida numa fase inicial [8]. As recomendações para a terapia nutricional oral na fase de adaptação estão resumidas no quadro 1. “Para a reidratação, uma combinação de sódio e glucose é eminentemente importante porque a absorção de glucose para a célula é acoplada ao sódio”. Os líquidos devem, portanto, ser salgados. Para um sumo de maçã diluído 1:3, haveria então pouco menos de 5 g de sal (1 colher de chá), o que corresponde a cerca de 100 mmol. Em caso de má absorção de gorduras, a administração de ácidos gordos de cadeia média é indicada se o cólon for preservado. Outras complicações com um cólon preservado, tais como cálculos renais, podem ser evitadas por um aumento da ingestão de cálcio, responsável pela ligação do oxalato, bem como por uma redução de princípio dos alimentos que contêm oxalato.

Medicamentos
O objectivo das medidas farmacêuticas é reduzir a secreção e diminuir a motilidade. Efeito anti-secretário, por exemplo. Inibidores da bomba de prótons, que inibem o H+/K+-ATPase na célula vestibular, ou análogos de somatostatina. Octreotídeo, por exemplo, inibe vários peptídeos, hormonas e secreção pancreática, mas também leva a uma redução do fluxo sanguíneo e da absorção alimentar.
A loperamida é utilizada em primeiro lugar contra o aumento da motilidade. Se o efeito for demasiado pequeno, a tintura de ópio pode ser dada posteriormente. A loperamida e a tintura de ópio conseguem o seu efeito estimulando os receptores de opiáceos gastrointestinais. A motilidade propulsiva é bloqueada, resultando num aumento da reabsorção de fluidos, diminuição da secreção e aumento do tónus no esfíncter anal [9]. Outras opções de fármacos incluem colestiramina (diarreia quologénica na continuidade cólica), enzimas pancreáticas na esteatorreia e fibras solúveis para ligar ainda mais o fluido intestinal. Um novo estudo mostra um efeito do teduglutide em pacientes sem cólon e com estoma: neste grupo de pacientes, a ingestão de fluido parenteral foi reduzida em 40%, enquanto o grupo placebo apenas conseguiu uma redução de 19%; em contraste, não houve efeito em pacientes com cólon em continuidade [11].
Fonte: SGAIM Spring Congress, 30 de Maio-1 de Junho de 2018, Basileia
Literatura:
- Websky MW, et al: A síndrome do intestino curto na Alemanha. Prevalência estimada e situação de cuidados. Chirurg 2014; 85(5): 433-439.
- Lamprecht G, et al.: S3-Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin e.V. in Zusammenarbeit mit der AKE, der GESKES und der DGVS. Nutrição clínica em gastroenterologia (parte 3) – Insuficiência intestinal crónica. Medicina Nutricional actual 2014; 39(2): e57-e71.
- Krafft T, et al: Resultado a longo prazo na insuficiência intestinal crónica: características, prognóstico e complicações. Z Gastroenterol 2013; 51: K285.
- Pironi L, et al: ESPEN guidelines on chronic intestinal failure in adults. Nutrição Clínica 2016; 35(2): 247-307.
- Karber M, et al: Insuficiência intestinal crónica e síndrome do intestino curto. Compendium Home Parenteral Nutrition (HPE). Directrizes KDS Charité Berlin. 2015.
- Messing B, et al.: Sobrevivência a longo prazo e dependência nutricional parenteral em pacientes adultos com síndrome do intestino curto. Gastroenterol 1999; 117(5): 1043-1050.
- O’Keefe SJ, et al: Short Bowel Syndrome and Intestinal Failure: Consensus Definitions and Overview. Clin Gastroenterol Hepatol 2006; 4: 6-10.
- Leuenberger M, et al: A síndrome do intestino curto: um desafio interdisciplinar. Medicina Nutricional actual 2006; 31: 235-242.
- Dorfschmid M, Sinik-Agan C: Insuficiência intestinal – terapia nutricional na síndrome do intestino curto. Schw Z Ernährungsmed 2017; 1: 10-18.
- Jeppesen PB, et al: Factores associados à resposta a Teduglutide em doentes com síndrome de Short-Bowel e Falha Intestinal. Gastroenterol 2018; 154(4): 874-885.
- Matarese LE: Nutrição e optimização de fluidos para pacientes com síndrome do intestino curto. JPEN 2013; 37(2): 161-170.
HAUSARZT PRAXIS 2018; 13(7) – publicado 8.6.18 (antes da impressão).











