Para além do tratamento local de feridas crónicas com o uso de pensos modernos adequados à fase, uma terapia causal da causa subjacente é decisiva para o sucesso da terapia. A utilização da terapêutica sistémica depende da doença subjacente. Especialmente para as feridas dermatológicas, a gama de possíveis terapias de sistema tem vindo a aumentar nos últimos anos.
Para além do tratamento local de feridas crónicas com o uso de pensos modernos adequados à fase, uma terapia causal da causa subjacente é decisiva para o sucesso da terapia. A utilização da terapêutica sistémica depende da doença subjacente. Especialmente para as feridas dermatológicas, a gama de possíveis terapias de sistema tem vindo a aumentar nos últimos anos. No entanto, devido à raridade de muitas doenças dermatológicas que se apresentam com úlceras crónicas como sintoma, a maioria dos medicamentos sistémicos são utilizações não rotuladas, excepto para autorizações individuais de comercialização, e a sua utilização pode levar a problemas de reembolso, por exemplo. Este manuscrito visa fornecer uma visão geral das terapias sistémicas actuais para feridas dermatológicas seleccionadas.
As causas mais comuns de feridas não cicatrizantes são doenças vasculares tais como insuficiência venosa crónica ou doença arterial oclusiva periférica, síndrome do pé diabético ou úlceras de pressão. Por definição, as feridas crónicas são feridas que persistem há pelo menos oito semanas apesar do tratamento ou onde as doenças subjacentes acima mencionadas estão presentes como causa da ferida [1]. A identificação da causa da ferida é essencial para a escolha da terapia causal correcta e, portanto, promissora. Por conseguinte, um historial médico detalhado, trabalho de diagnóstico e tratamento médico interdisciplinar são necessários para o tratamento estruturado do paciente.
A terapia da dor adequada, a administração de antibióticos na presença de uma infecção de ferida ou o tratamento de deficiências nutricionais através da toma de suplementos alimentares podem apoiar a cicatrização de feridas. No entanto, como este tipo de terapia medicamentosa se aplica a todos os tipos de feridas, será apenas brevemente mencionado aqui.
A seguir, são apresentadas as opções terapêuticas causais para quadros clínicos seleccionados. O Quadro 1 mostra uma visão geral dos diagnósticos diferenciais dermatológicos mais importantes de feridas crónicas.
Úlceras vasculares
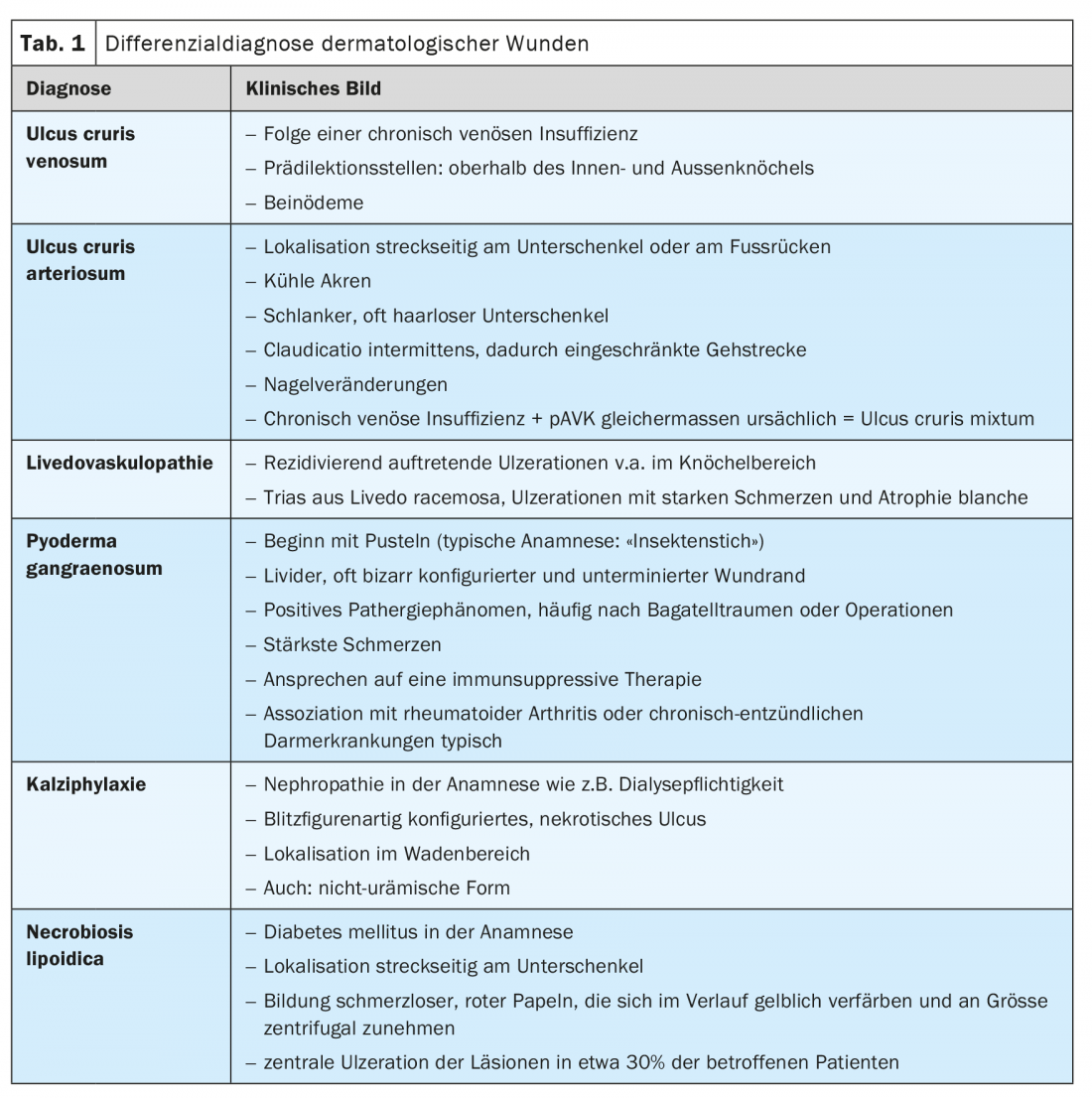
Partindo da insuficiência venosa crónica, podem desenvolver-se úlceras nas pernas venosas (VU), mostrando uma prevalência dependente da idade com um pico na faixa etária dos 70-79 anos [2]. Os sítios de predilecção da UCV estão acima do tornozelo interior e exterior (Fig. 1). A terapia destina-se principalmente a melhorar a doença subjacente, mas em alguns casos, apesar dos cuidados ideais com feridas, não conduz ao sucesso devido à já muito pronunciada dermatolipofasciosclerose e está sujeita a uma elevada taxa de recorrência. Uma extensão da terapia a nível sistémico pode melhorar a cicatrização de feridas; em particular, medicamentos com efeitos anti-inflamatórios e de melhoria da circulação, tais como ácido acetilsalicílico, estatinas, heparina de baixo peso molecular ou pentoxifilina mostram resultados positivos em casos individuais, mas não existem provas elevadas [1]. A terapia de compressão continua a ser o tratamento de primeira linha para a UCV.
O diagnóstico diferencial e a fisiopatologia das úlceras de perna devem ser distinguidos das úlceras de perna arterial. A causa aqui é a doença oclusiva arterial periférica (PAVD). As úlceras estão tipicamente localizadas pretibialmente ou na zona do dedo do pé. Para além de melhorar a situação do fluxo sanguíneo através de procedimentos de cirurgia intervencionista/vascular, podem ser utilizados inibidores de agregação de plaquetas, prostaglandinas ou prostaciclinas. A prevenção secundária da arteriosclerose também é importante para aumentar a esperança de vida e reduzir o risco de amputação. As medidas preventivas possíveis incluem mudanças no estilo de vida, ajuste óptimo dos níveis de glucose no sangue e da pressão arterial, e redução do perfil de risco cardiovascular, por exemplo, através da abstinência de nicotina ou do uso de estatinas [1].
No caso de valores de tensão arterial permanentemente elevados, a calcificação dos vasos da perna inferior pode levar a uma úlcera hipertónica da perna tipicamente localizada na perna inferior dorsal (= “Ulcus cruris Martorell”). Para além da dificuldade de diagnóstico, não há recomendações claras para um tratamento direccionado a não ser a optimização do controlo da tensão arterial.
|
Inibidores de excursus Janus kinase Janus kinases (JAKs) pertencem ao grupo das citoplasmas de tirosina kinases. São activados pelo estímulo de receptores por factores específicos de crescimento, hormonas de crescimento, quimiocinas e citoquinas. Após a activação, eles contêm factores de transcrição de fosforilato STAT e, portanto, o transporte dos factores STAT para o núcleo celular. Isto influencia a expressão de genes específicos, por exemplo citocinas e enzimas pró-inflamatórias. Existem quatro tipos conhecidos de JAK kinases: JAK1, JAK2, JAK3 e TYK2, que se encontram principalmente em células hematopoiéticas [9]. A constatação de que Janus kinases contribui significativamente para os processos imunológicos de doenças inflamatórias levou ao desenvolvimento de inibidores de Janus kinase, que estão agora estabelecidos na oncologia, mas que são também cada vez mais utilizados em reumatologia e dermatologia [9]. São aprovados para a artrite reumatóide, artrite psoriásica e neurodermatite grave. Existem actualmente cinco preparações aprovadas com diferentes especificidades que são tomadas oralmente ou aplicadas topicamente como um creme. |
Pyoderma gangraenosum
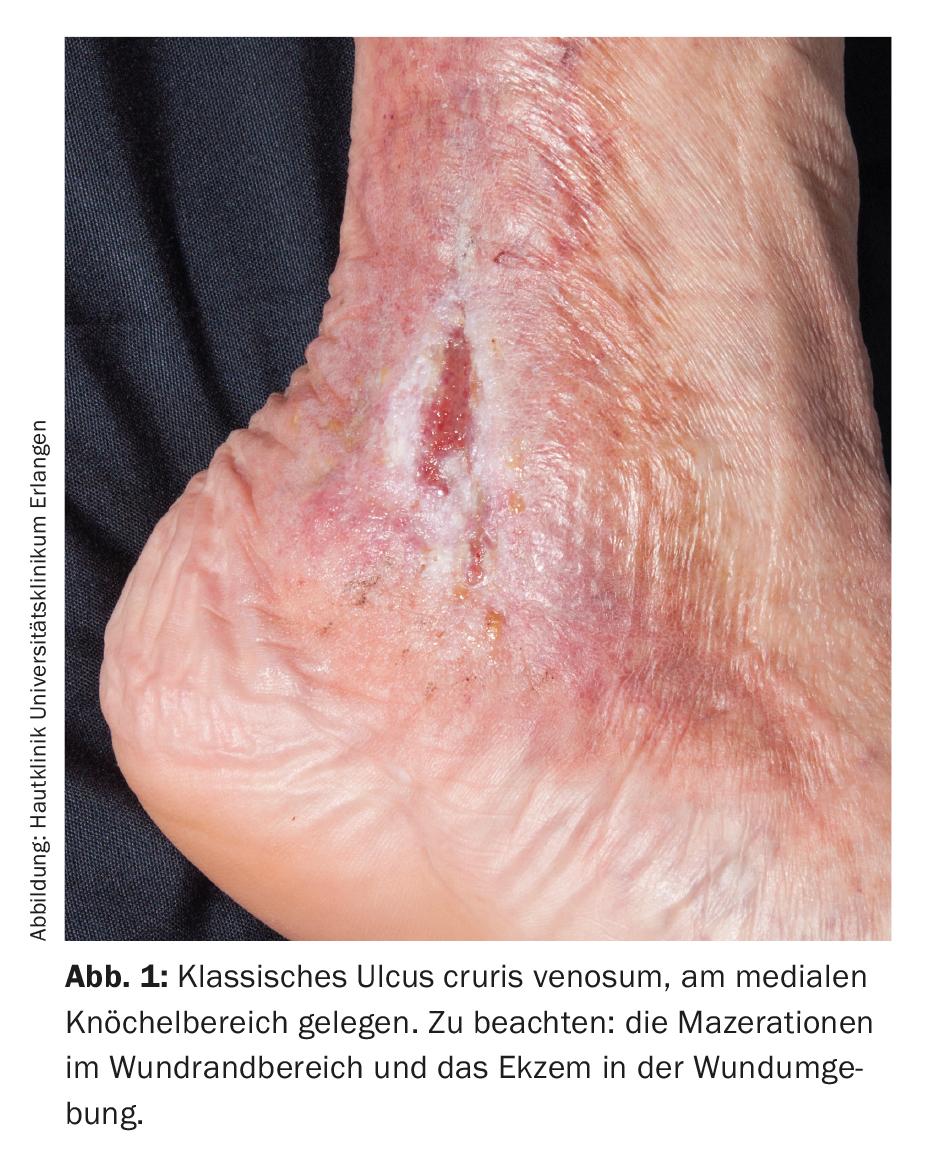
O pioderma gangraenosum (PG) é uma ferida causada imunologicamente, cuja patogénese exacta, no entanto, ainda não foi esclarecida [3]. Com a ajuda do Paracelsus Score, o PG pode ser melhor diagnosticado: A rápida dinâmica do curso da doença, ulcerações lívidas e muitas vezes bizarramente configuradas com margens minadas (Fig. 2) e dores fortes são indicativas da doença. Um fenómeno de patogenia positiva (desencadeamento de lesões cutâneas patológicas por um trauma trivial), sinais histológicos de inflamação supurativa e resposta à terapia imunossupressora também apoiam o diagnóstico [4].
O pioderma gangraenosum ocorre preferencialmente (até 70%) nas pernas, especialmente na região tibial, mas também pode ocorrer em outras partes do corpo. Existe também frequentemente uma associação com outras doenças (autoinflamatórias) tais como artrite reumatóide, doenças inflamatórias crónicas do intestino, bem como doenças malignas ou a síndrome metabólica. Muitas vezes o PG não pode ser controlado adequadamente por terapia tópica, pelo que é necessário o uso de terapêutica sistémica.
Na maioria dos pacientes, a terapia sistémica imunossupressora é indicada [3]. Actualmente, apenas glucocorticoides (prednisona, prednisolona) são licenciados, todos os outros imunossupressores são utilizados fora do rótulo. Estes incluem, por exemplo, ciclosporina A e infliximab. Além disso, a terapia com dapsona, azatioprina, micofenolato mofetil e imunoglobulinas intravenosas pode ser considerada. A utilização de anticorpos monoclonais contra citocinas pró-inflamatórias como a IL-1 (anakinra, canakinumab), IL-12 e IL-23 (ustekinumab), IL-17 (secukinumab) e TNF-alfa (adalimumab, etanercept) é promissora [1,3].
Foram observados efeitos positivos em menor número de pacientes para vários biólogos, i.v. imunoglobulinas (IVIG) e antagonistas dos receptores de IL-1. No entanto, devido à raridade da doença, faltam estudos grandes e aleatórios sobre abordagens terapêuticas mais recentes. A utilização de terapêutica de sistemas mais recentes no rótulo é ocasionalmente possível através da indicação na presença de uma doença reumatológica subjacente [5]. Nesses casos, recomenda-se uma discussão interdisciplinar de casos e uma decisão terapêutica.
Com a directriz S1 publicada em 2020, as recomendações terapêuticas estruturadas estão disponíveis pela primeira vez [6]. A terapia do sistema de PG depende da presença de uma doença subjacente associada [3]:
- Para doença inflamatória intestinal ou artrite reumatóide, os inibidores de TNF-alfa (infliximab, adalimumab, etanercept) são a primeira escolha como monoterapia ou em combinação com glucocorticóides. A administração de ciclosporina A, IVIG ou outros imunossupressores (por exemplo, MTX, azatioprina) como mono ou terapia combinada também é possível.
- Se a doença subjacente for maligna, o IVIG é inicialmente recomendado como monoterapia ou em combinação com glucocorticoides. Além disso, os inibidores de TNF-alfa ou imunossupressores podem ser utilizados dependendo da actividade da doença maligna.
- Para PG de outras causas, os glucocorticoides são a primeira escolha. Também aqui pode ser considerada a terapia com inibidores de TNF-alfa, imunoglobulinas ou imunossupressores [3].
Se as abordagens acima mencionadas não produzirem uma melhoria no pioderma gangraenosum, uma tentativa terapêutica com outros biólogos pode ser útil [3].
Calciflaxis
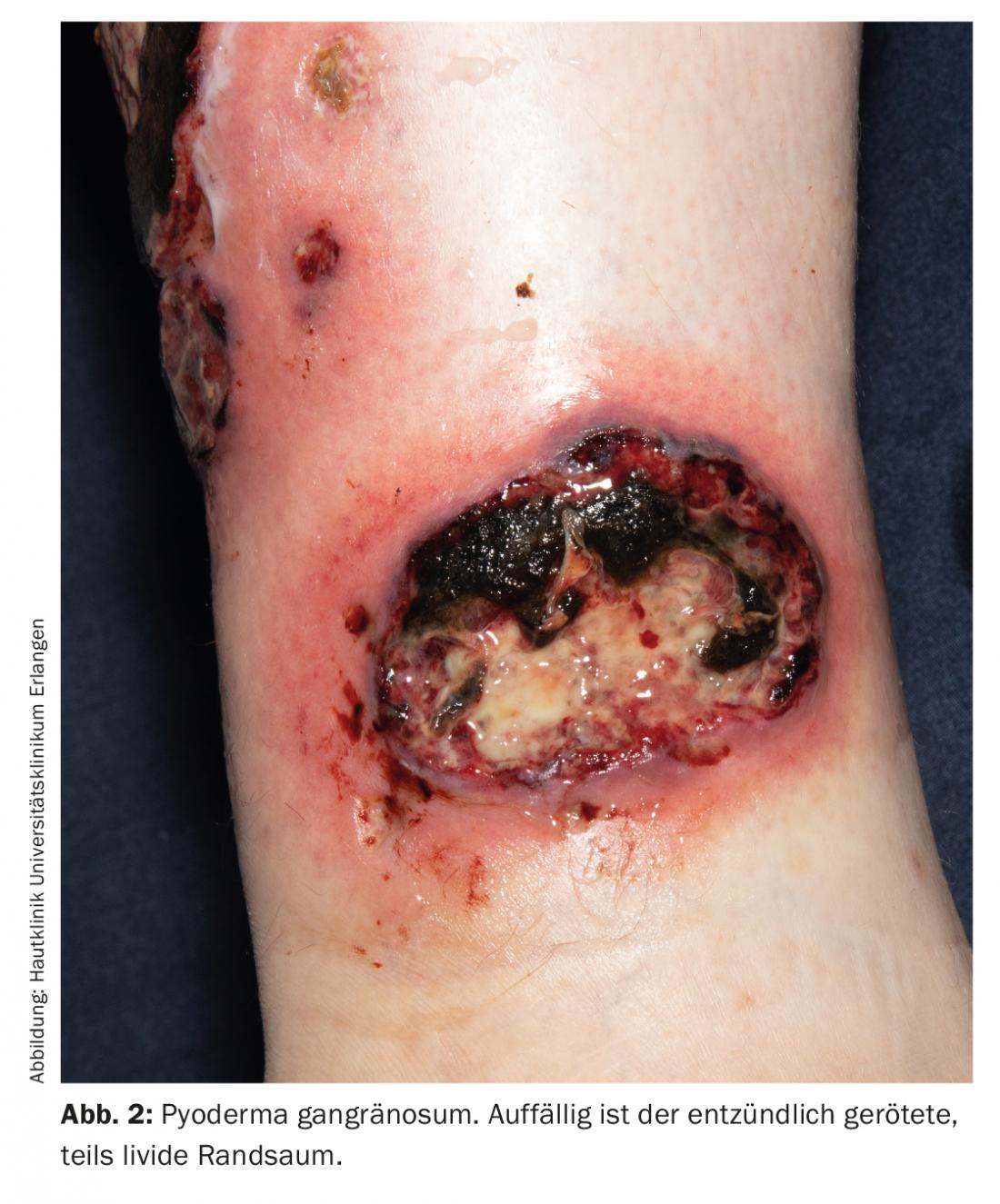
A calcificação é uma arteriolopatia rara e potencialmente fatal, que na maioria dos casos é causada por perturbações no equilíbrio cálcio-fosfato e a consequente calcificação dos meios com oclusão vascular consecutiva. Caracteriza-se, entre outras coisas, por úlceras necróticas de configuração bizarra (Fig. 3) e está frequentemente associada a nefropatia, dependência dialítica e transplante renal [1].
Além disso, o hiperparatiroidismo, deficiência de albumina, obesidade e o uso de certos medicamentos são factores de risco para o desenvolvimento da calcificação. Estes incluem anticoagulantes contendo cumarina, corticosteróides, suplementos de cálcio e vitamina D activa [7].
O diagnóstico é feito com base no quadro clínico, no historial médico e numa tríade histológica de
- Hiperplasia intimal, fibrose, trombose vascular
- Calcificação dos meios de comunicação
- Necrose da epiderme, derme circundante e subcutis
Devido ao possível envolvimento de órgãos e frequentemente de doentes multimórbidos, regista-se uma elevada taxa de mortalidade neste quadro clínico [1]. Além disso, existem também formas de calcificação não curémicas, para as quais, no entanto, não existem recomendações terapêuticas uniformes devido à falta de estudos randomizados [5].
O tratamento multidisciplinar de doentes por nefrologistas, dermatologistas, especialistas em feridas, nutricionistas e terapeutas da dor é também importante para a terapia nestes casos. Não existe uma terapia de sistema especificamente aprovada. Na forma uraémica de calcificação, a regulação do equilíbrio de cálcio e fosfato através de diálise ou medicação pode ser considerada, uma vez que a redução dos níveis de cálcio e fosfato mostra efeitos positivos. Em séries de casos, outros medicamentos também foram utilizados com sucesso, tais como o tiossulfato de sódio. Forma complexos hidrofílicos com metais e minerais e deve ser aplicado por via intravenosa várias vezes por semana. Estão também disponíveis outros relatórios de casos sobre a utilização de cinacalcet ou bisfosfonatos. Devido à associação descrita da ocorrência de calcificação com a ingestão de antagonistas da vitamina K, a medicação cumarina deve ser implementada em doentes com calcificação ou substituição da vitamina K deve ser realizada caso a caso [1].
|
Excursus Biologics Os produtos biológicos são proteínas produzidas artificialmente que interceptam substâncias mensageiras para inflamação ou bloqueiam a sua transmissão de sinal. Trata-se de terapias muito dispendiosas, a maioria das quais ainda são utilizadas fora do rótulo para as indicações aqui apresentadas. Um problema com a biologia é o risco de reactivação de infecções latentes, um aumento da susceptibilidade às infecções e uma possível alteração do hemograma. Além disso, devem ser tidas em conta contra-indicações como insuficiência cardíaca descompensada, infecções graves pré-existentes, gravidez, doença hepática grave ou um historial de malignidade. |
Necrobiosis lipoidica
A necrobiose lipoidica (NL) é uma doença de pele inflamatória e não infecciosa cuja causa exacta não é clara. Ocorre especialmente em pacientes com diabetes mellitus (0,3-1% de todos os pacientes diabéticos) e já pode aparecer antes do diagnóstico de diabetes. Cerca de 50% de todos os doentes com NL têm outras doenças do síndroma metabólico. As doenças da tiróide também parecem ser mais frequentes neste grupo de doentes [1].
A degradação inflamatória do colagénio com reacção granulomatosa do tecido na derme, por vezes também no tecido adiposo subcutâneo, leva inicialmente a pápulas ou placas vermelhas indolores, que mais tarde se tornam amareladas a acastanhadas e aumentam de tamanho. O quadro típico da necrobiose lipoidica são lesões com um centro amarelado e uma área circundante castanha escura com margens activas inflamatórias elevadas. As eflorescências podem também aparecer nos antebraços, mãos e tronco. Localizações inusitadas, tais como o couro cabeludo ou a área genital, também podem ocorrer [1]. Em cerca de 30% dos casos NL, as ulcerações resistentes à terapia ocorrem nas áreas cutâneas afectadas.
No caso de uma associação com diabetes, o ajuste óptimo do nível de glicose no sangue é o primeiro passo mais importante. NL é tratado sistemicamente e topicamente com glucocorticoides. As alternativas possíveis são ésteres do ácido fumárico, ciclosporina A, dapsona e medicamentos anti-maláricos como a cloroquina (hidroxi)chloroquina. Biológicos como os inibidores de TNF-alfa (por exemplo adalimumab) também podem ser utilizados, mas devido à utilização não rotulada, com precaução e informação detalhada do doente sobre possíveis efeitos secundários [1]. No entanto, devido à raridade da doença, faltam estudos aleatórios e directrizes terapêuticas claras.
A utilização de inibidores de Janus kinase (JAK) é nova. Uma boa resposta à terapia, incluindo a ulceração, em doentes com necrobiose lipoidica sugere uma ligação entre a via de sinalização JAK-STAT e a patogénese da doença [8].
Livedovasculopatia
A livedovasculopatia (LV) caracteriza-se por ulcerações recorrentes e muito dolorosas, principalmente na zona do tornozelo, cujo curso é tipicamente dividido em três fases [10]. Na primeira fase, um padrão de livedo racemosa aparece em torno da ferida. Estas são máculas reticulares lívidas, irregularmente circunscritas, causadas por uma perfusão inadequada. Na segunda fase, a isquemia tecidual resulta da perfusão reduzida. Devido a vasculopatias obliterativas e microembolias, ocorrem isquemia cutânea e ulcerações necróticas (“enfartes cutâneos”). São sobretudo os capilares superficiais que são afectados. Na última fase, os processos de remodelação crónica e cicatrizante por vezes têm lugar, desenvolve-se a chamada atrofia blanche. Estas são cicatrizes em forma de relâmpago ou de estrela, cor de porcelana [11].
O início precoce da terapia medicamentosa é necessário para evitar o agravamento das ulcerações em termos de cicatrizes dos enfartes cutâneos. O período entre o início dos primeiros sintomas e o diagnóstico deve ser encurtado o mais possível. Todas as terapias actuais estão fora do rótulo para a vivovasculopatia [10,11]. Foi também publicada recentemente uma directriz S1 para a vivovasculopatia [11].
Para o tratamento sistémico, os anticoagulantes são agentes de primeira linha devido aos mecanismos pró-coagulantes que contribuem para o desenvolvimento da doença. São utilizados heparina de baixo peso molecular (NMH) e anticoagulantes orais directos (DOAK, por exemplo dabigatran, rivaroxaban) [1]. A terapia com heparina de baixo peso molecular conduz a uma rápida melhoria na maioria dos casos [11].
A heparina de baixo peso molecular em doses terapêuticas completas é recomendada para o diagnóstico inicial da ovasculopatia viva ou exacerbação. Se os resultados forem estáveis ou se as ulcerações tiverem sarado, a dose pode ser reduzida e o fármaco pode ser completamente descontinuado se necessário. Se houver um risco de deterioração, a terapia deve ser continuada ou mudada para rivaroxaban, um inibidor do factor Xa. Um possível agravamento clínico da ulceração pode ser reconhecido pelo aumento da dor e pode ser detectado precocemente através da manutenção de um diário da dor [11].

As imunoglobulinas intravenosas (fora do rótulo) são uma alternativa terapêutica importante. Além disso, podem ser utilizados antagonistas de vitamina K ou iloprost. A administração de vitamina B6, B12 e ácido fólico para além da anticoagulação também mostra efeitos positivos em doentes com hiper-homocisteinemia [11]. Além disso, reologias como o ciloestazol, naftidrofurilo e pentoxifilina devem ser consideradas em casos individuais resistentes a terapias [5].
O quadro 2 resume novamente as recomendações da directriz.
Conclusão para a prática
Para a maioria das doenças mencionadas, as provas para recomendações de tratamento derivam actualmente em grande parte da experiência clínica e de vários relatos de casos em pequenas populações de doentes, e não de ensaios aleatórios. Por conseguinte, a maioria das terapias utilizadas continuam, na sua maioria, a não estar rotuladas. No entanto, estas novas terapias, especialmente a utilização crescente de produtos biológicos e inibidores de Janus kinase, são muito promissoras e permitem um espectro mais amplo de terapias disponíveis no tratamento de feridas dermatológicas. O trabalho inicial de diagnóstico da causa da ferida crónica continua a ser decisivo para uma terapia orientada.
Mensagens Take-Home
- O diagnóstico e a terapia da doença subjacente são o ponto de partida para o tratamento direccionado de feridas crónicas.
- O envolvimento interdisciplinar de diferentes disciplinas médicas é muitas vezes necessário.
- As opções de tratamento sistémico mais recentes são promissoras, mas devem ser utilizadas com cautela.
- As drogas que causam ou agravam úlceras e factores de risco individuais também devem ser tidas em conta.
Literatura:
- Dissemond J, et al: Terapias sistémicas para úlceras de perna. J Dtsch Dermatol Ges 2018; 16(7): 873-890.
- Erfurt-Berge C, Renner R: Feridas crónicas – Recomendações para o diagnóstico e terapia. J Reviews in Vascular Medicine 2015; 3(1): 5-9.
- AWMF, S1 Guideline Pyoderma gangrenosum 2020. www.awmf.org/uploads/tx_szleitlinien/013-091l_S1_Pyoderma-gangrenosum_2020-10_1.pdf (último acesso: 06.03.2022).
- Jockenhöfer F, et al: A pontuação PARACELSUS: uma nova ferramenta de diagnóstico do pioderma gangrenoso. Br J Dermatol 2019; 180: 615-620.
- Erfurt-Berge C, Renner R: Abordagem interdisciplinar no diagnóstico e tratamento de úlceras de perna. Geriatrie up2date Thieme 2022; 04(01): 41-55.
- Quist SR, Kraas L: Opções terapêuticas para o pioderma gangraenosum. J Dtsch Dermatol Ges 2017; 15(1): 34-41.
- Erfurt-Berge C, Renner R: Gestão de pacientes com calcificação: perspectivas actuais. Chronic Wound Care Management and Research 2019; 6: 109-115.
- Erfurt-Berge C, Sticherling M: Tratamento bem sucedido da necrobiose lipoidica ulcerosa com inibidor de janus kinase. Journal of the European Academy of Dermatology and Venereology 2020; 34(7): 331-333.
- Shreberk-Hassidim R, et al: Janus kinase inhibitors in dermatology: Uma revisão sistemática. J Am Acad Dermatol 2017; 76(4): 745-753.
- Schiffmann M, et al: S1-Leitlinie Diagnostik und Therapie der Livedovaskulopathie. JDDG – Journal of the German Dermatological Society 2021; 19(11): 1667-1678.
- Görge T, et al.: S1-Leitlinie Diagnostik und Therapie der Livedovaskulopathie 2021. www.awmf.org/uploads/tx_szleitlinien/013-098l_S1_Diagnostik-Therapie-Livedovaskulopathie__2021-02.pdf (último acesso: 06.03.2022).
PRÁTICA DA DERMATOLOGIA 2022; 32(3): 6-11