A esclerose múltipla é a doença neurológica mais comum em adultos jovens. Mesmo numa idade jovem, pode levar a uma incapacidade permanente, embora a actividade da doença no início da doença pareça ser relevante para o curso posterior da doença. O início precoce de uma terapia eficiente é, portanto, importante. Em resultado dos ensaios clínicos recentemente concluídos e dos resultados actuais e promissores da investigação, pode esperar-se um aumento das opções terapêuticas nos próximos meses e anos.
A esclerose múltipla (EM) é a doença auto-imune mais comum do sistema nervoso central (SNC), cuja base fisiopatológica ainda não está esclarecida em detalhe. Com base nos novos critérios de acordo com McDonald 2010, o diagnóstico de EM é frequentemente feito após o primeiro episódio clínico [1]. Na maioria dos casos, existe um curso de recaída (“recapsing remitting multiple sclerosis”, RRMS).
No decurso da doença, muitos pacientes experimentam uma progressão secundária-crónica dos sintomas independente de recaídas (“EM progressiva secundária”, SPMS); após dez anos, este é o caso em cerca de 30-40% dos pacientes [2]. A EM progressiva primária (PPMS) está presente em 10-20% dos doentes, e este curso pode também incluir recaídas sobrepostas [3].
A fase inicial do RRMS corresponde muitas vezes formalmente a uma síndrome clinicamente isolada (CIS). Nos doentes com SIC, os critérios McDonald 2010 para o diagnóstico de RRMS não são cumpridos, mas a presença de EM deve muitas vezes ser assumida como provável [4].
Os processos na fase inicial das doenças parecem ter uma influência significativa no curso posterior da doença, de modo que um início precoce da terapia é importante. A transição formal do SIC para EM clinicamente confirmada pode ser atrasada e o curso posterior positivamente influenciado pela utilização precoce da terapia básica [5, 6].
Mais recentemente, foram feitos progressos no tratamento do CIS e do RRMS. Além das substâncias orais (tais como ácido fumárico, laquinimod, teriflunomida), as terapias de anticorpos (tais como alemtuzumab, daclizumab, ocrelizumab) estão também em estudos de fase II ou III ou alguns estudos correspondentes já foram concluídos.
Ácido fumárico, teriflunomida e alemtuzumabe já estão aprovados em alguns países, pelo que também se pode esperar uma expansão das opções terapêuticas na Suíça num futuro próximo (Separador. 1 e Fig. 1).
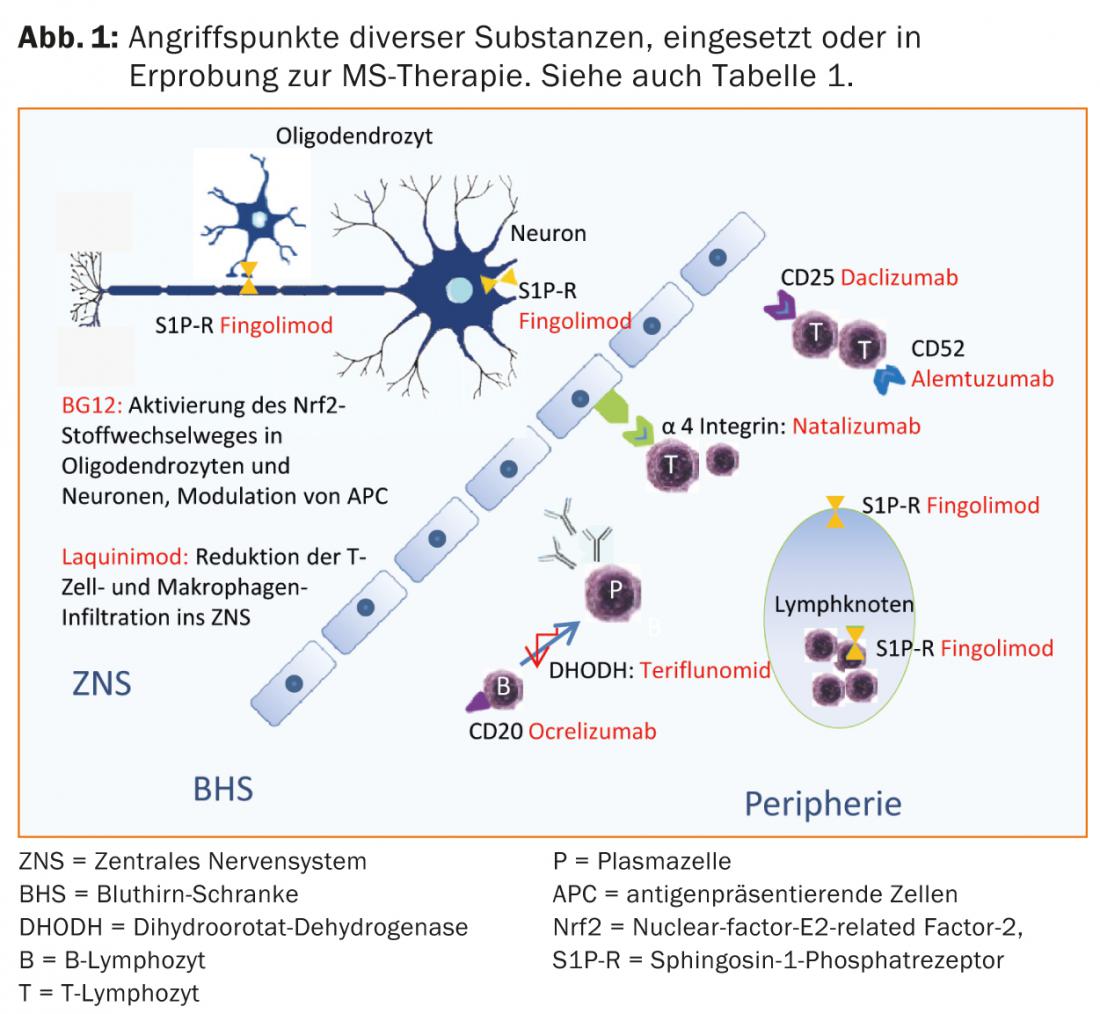
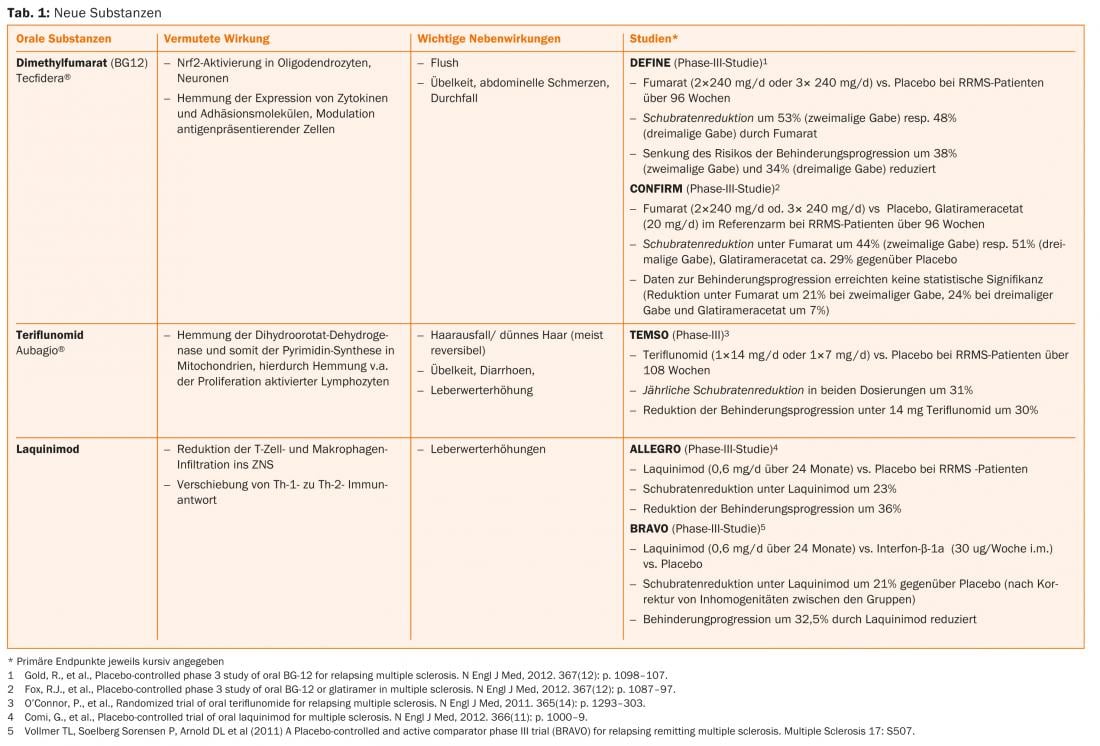
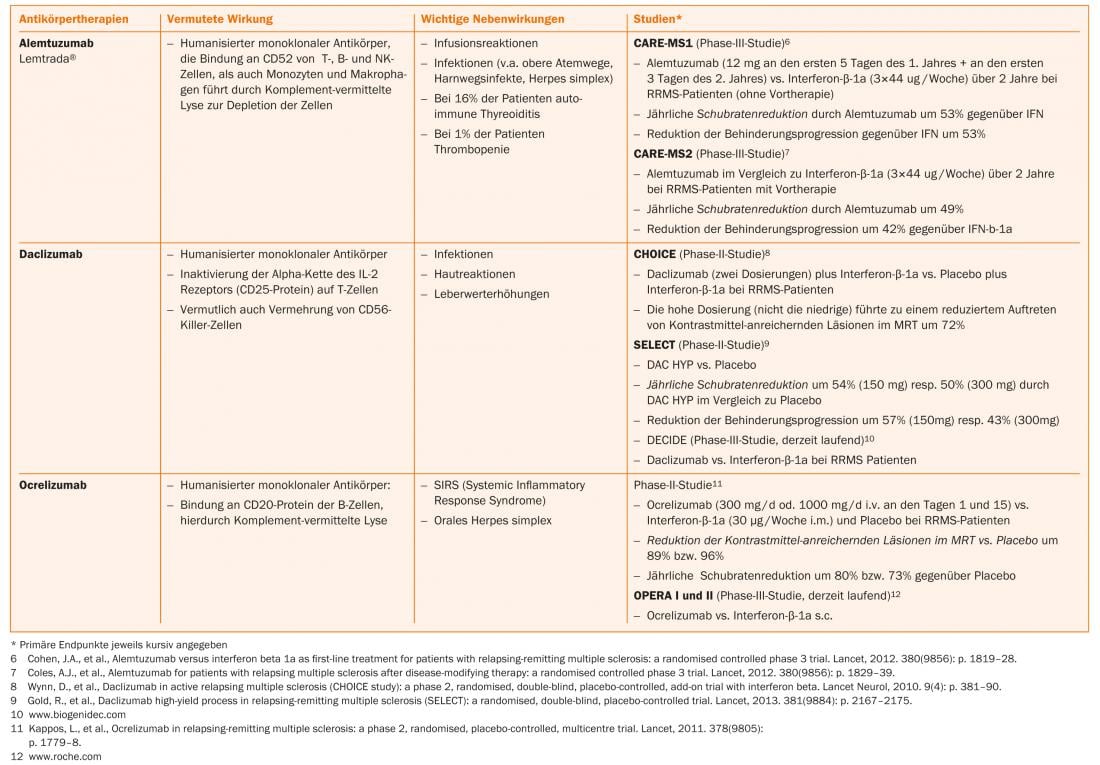
Opções terapêuticas actuais
Para o tratamento de doentes CIS e RRMS, os beta-interferões (interferon-beta 1b s.c. [Betaferon®]) estão disponíveis na UE e na Suíça. [Betaferon®], interferon-beta 1a s.c. e i.m. [Rebif® e Avonex®] e Glatira. [Rebif® e Avonex®] e acetato de glatiramer s.c. [Copaxone®] foram aprovados [7, 8]. Para estas substâncias, que são normalmente injectadas pelo próprio paciente, há muitos anos de vasta experiência e caracterizam-se em particular por um perfil de segurança favorável [9]. Em 2011, o fingolimod foi também aprovado na Suíça como terapia de primeira linha para o tratamento de RRMS [10]. Os exames de ressonância magnética (MRI) devem ser realizados inicialmente e regularmente durante o curso da terapia para determinar a situação inicial e para a monitorização subsequente da terapia.
Os interferões (IFN) utilizados são produzidos de forma recombinante. Os IFN endógenos são parte integrante do sistema imunitário e são importantes para a resposta imunitária às infecções virais. O mecanismo exacto de acção dos preparativos do IFN-β no tratamento do CIS/RRMS ainda não foi totalmente compreendido. Os efeitos secundários semelhantes aos da gripe ocorrem frequentemente, especialmente nos primeiros meses de terapia, que podem ser reduzidos tomando um medicamento anti-inflamatório não esteróide ou paracetamol [11]. Efeitos secundários locais tais como dor, vermelhidão da pele, lipoatrofia e endurecimento podem ocorrer nos locais de injecção [12, 13]. Como alternativa aos beta-interferões, pode ser utilizado o acetato de copolímero glatiramer, uma mistura heterogénea de polipéptidos sintéticos constituídos por quatro aminoácidos cujo mecanismo de acção também não é totalmente compreendido, [14]. Os efeitos secundários semelhantes aos da gripe não são relevantes com este medicamento, mas podem ocorrer reacções pós-injecção com sintomas de rubor e induração ou lipoatrofia local nos locais de injecção [15].
Na Suíça, o fingerolimod (comprimido) é também aprovado para a terapia básica de primeira linha de RRMS. O Fingolimod é a primeira terapia de EM modificadora da doença disponível oralmente, geralmente bem tolerada, que foi superior ao interferão comparador-beta 1a i.m. num dos estudos centrais [17]. O fingolimod liga-se como um antagonista não selectivo de alta afinidade aos receptores de esfingosina-1-fosfato (S1P-R) nos linfócitos, evitando assim a sua emigração de órgãos linfóides secundários. A redistribuição dos linfócitos resulta em linfopenia, e a metabolização no fígado pode levar a um aumento dos valores hepáticos. Devido à expressão dos receptores S1P na área do sistema de condução cardíaca, podem ocorrer efeitos secundários tais como bradicardia ou uma perturbação da condução atrioventricular, especialmente durante a primeira ingestão. Por este motivo, são necessários controlos da tensão arterial, pulso e ECG na primeira administração, bem como após pausas na terapia. O edema macular pode ocorrer como uma complicação rara [16]. Devido aos efeitos sobre o sistema imunitário, os pacientes cujo tipo de pele predispõe a doenças malignas devem ser examinados dermatologicamente numa base regular [17, 18]. Além disso, as infecções virais, em particular, são favorecidas. Em doentes que não tenham tido varicela, os títulos de anticorpos anti-varicela zoster virus devem ser determinados antes de se iniciar a terapia. Os doentes seronegativos devem ser vacinados.
Novas substâncias tais como alemtuzumab (infusão, apenas para pacientes com actividade de doença actual), fumarato de dimetilo (comprimido) e teriflunomida (comprimido) já foram aprovadas para a terapia de RRMS em alguns países e foram submetidas para aprovação na Suíça.
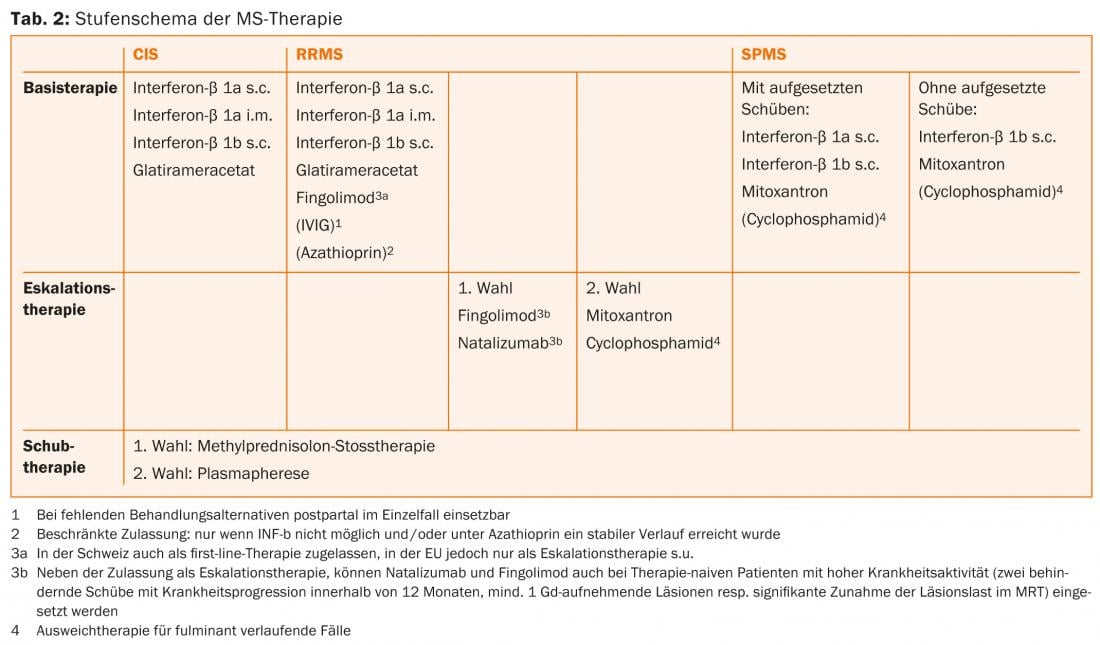
Terapia de escalada
A escalada terapêutica desde a terapia de primeira linha até ao fingolimod (ela própria primeira linha na Suíça, não na UE) [16, 19] ou natalizumab [20] pode ser considerada se ≥1 tiver ocorrido uma recidiva sob terapia de base no ano anterior e houver ≥9 lesões T2-hiperintensas ou ≥1 agudas, ou seja, lesão absorvente de contraste na RM. Os IFNs são mencionados como a terapia básica correspondente nas indicações. Contudo, a prática actual é avaliar igualmente a escalada em doentes tratados com acetato de glatiramer ou, em caso de escalada para natalizumab, dedilimod. O tratamento primário com natalizumab ou (na UE, não restrito na Suíça) fingolimod só é indicado para pacientes que já tiveram ≥2 recidivas com progressão de incapacidade no ano passado e que têm ≥1 lesão que aumenta o contraste ou um aumento “significativo” da carga de lesão T2 detectável na RM cerebral.
Natalizumab é um anticorpo monoclonal humanizado contra a molécula de adesão celular α4-integrina, que os linfócitos precisam para entrar no SNC. No estudo central, o natalizumab reduziu a taxa de recidivas em 68% em relação ao placebo e também teve um bom efeito na progressão da incapacidade e nos sinais de actividade da doença na ressonância magnética [20]. O Natalizumab é administrado por infusão a cada 28 dias e é geralmente bem tolerado. A utilização deste medicamento muito eficaz é limitada pelo risco de leucoencefalopatia multifocal progressiva (LPM). Esta infecção oportunista causada pelo vírus JC leva frequentemente a deficiências graves, um resultado letal é possível. Não há tratamento específico para a LPM. Em PML, o natalizumab é portanto descontinuado e lavado com plasmaférese para restaurar a imunocompetência o mais rapidamente possível. Pouco mais de metade dos doentes com EM e a população saudável correspondente são portadores do vírus JC. Enquanto os pacientes com JC-seronegativos têm um baixo risco de LPM (aproximadamente 1:10.000) [21], o risco em pacientes seropositivos pode aumentar até aproximadamente 1:89 para o terceiro e quarto ano se a terapia imunossupressora tivesse sido administrada no passado. Dependendo do risco individual, é portanto necessário um aconselhamento cuidadoso dos doentes sobre benefícios e riscos [22]. Ao passar de fingolimod para natalizumab, deve ser observado um período de washout de cerca de dois meses, pelo menos à espera que a contagem de linfócitos se normalize [23]. Após revisão cuidadosa, mitoxantrona, ciclofosfamida ou azatioprina [23] podem ser utilizados como fármacos de reserva e agentes de segunda linha na terapia de escalada (tab. 2). Outras terapias não rotuladas podem ser consideradas.
Finalmente, deve ser mencionado que as combinações das terapêuticas de EM mencionadas não são aprovadas.
Desejo para as crianças, gravidez, amamentação
A EM afecta frequentemente as mulheres jovens. A questão do tratamento durante a gravidez e a amamentação é, portanto, relevante. A utilização dos agentes quimioterápicos teratogénicos ou imunossupressores azatioprina, ciclofosfamida e mitoxantrona está contra-indicada. Também com o fingolimod, deve ser observado um período de washout antes de terminar a contracepção, se possível. O acetato de glatirâmero foi classificado como o melhor pela US Food and Drug Agency (FDA) em termos de risco de exposição durante a gravidez, uma vez que este medicamento não tem sido teratogénico em estudos com animais e os dados até à data sobre seres humanos também são favoráveis [24]. Também para os interferons e natalizumab, não foi observada até agora nenhuma teratogenicidade para os humanos.
Embora estes dados não provenham de ensaios controlados, deve ser considerada a interrupção do tratamento com um destes medicamentos apenas quando ocorre uma gravidez, tendo em conta o respectivo rótulo. Durante a gravidez, quando a actividade de recaída é geralmente baixa, o tratamento só é dado em raros casos excepcionais. O tratamento também não é normalmente dado durante a amamentação, especialmente porque muitas pacientes de EM não amamentam para poderem recomeçar o tratamento após o parto, após o qual existe frequentemente um elevado nível de actividade da doença.
Utilização da terapêutica de base em formas progressivas
Actualmente não existem opções de tratamento eficazes com um efeito claro para a forma progressiva do curso; em vez disso, para além de uma terapia individual, multimodal, sintomática, fisioterapêutica e medidas de reabilitação estão também em primeiro plano. No caso do SPMS, a opção de usar IFN-β-1b e, se houver recaídas, também IFN-β-1a s.c. [25] é uma opção.
Se o curso for particularmente agressivo, a administração de mitoxantrone deve ser discutida [26]. Deve ser feita previamente uma avaliação cuidadosa da relação risco-benefício, especialmente devido ao aumento do risco de leucemia [27] e de cardiomiopatia, bem como do efeito tóxico sobre a função gonadal. A duração da terapia é limitada pela dose cumulativa total que pode ser aplicada (na Suíça max. 100 mg/m2 de superfície corporal). Isto pode ser excedido se necessário sob controlo cuidadoso da função do coração.
Conclusão
A terapia precoce do CIS/RRMS é importante para o curso da doença. Há um número crescente de medicamentos disponíveis para este fim, que diferem em termos de eficácia, segurança, perfil de efeitos secundários e conforto terapêutico. A escolha crescente da terapêutica da EM oferece a possibilidade de uma terapia mais individualizada, adaptada ao perfil específico do paciente.
Helen Könnecke
PD Michael Linnebank, MD
Literatura:
- Polman CH, et al: Ann Neurol 2011; 69(2): 292-302.
- Weinshenker BG, et al: Brain 1989; 112(Pt1): 133-146.
- Weinshenker BG: Semin Neurol 1998; 18(3): 301-307.
- Miller DH, et al: Mult Scler 2008; 14(9): 1157-1174.
- Weinshenker BG, et al: Brain 1989; 112(Pt 6): 1419-1428.
- Hirst C, et al: J Neurol 2008; 255(2): 280-287.
- Buttmann M, Rieckmann P: Perito Rev Neurother 2007; 7(3): 227-239.
- Comi G, et al: Ann Neurol 2011; 69(1): 75-82.
- Reder AT, et al: Neurology 2010; 74(23): 1877-1885.
- www.swissmedic.ch.
- Hartung HP, et al: Nervenarzt 2013; 84(6): 679-704.
- Nikfar S, Rahimi R, Abdollahi M: Clin Ther 2010; 32(11): 1871-1888.
- Plosker GL: CNS Drugs 2011; 25(1): 67-88.
- O’Connor P, et al: Lancet Neurol 2009; 8(10): 889-897.
- Ford C, et al: Mult Scler 2010; 16(3): 342-350.
- Cohen JA, et al: NEJM 2010; 362(5): 402-415.
- Comi G, et al: Mult Scler 2010; 16(2): 197-207.
- Kappos L, et al: NEJM 2006; 355(11): 1124-1140.
- Kappos L, et al: NEJM 2010; 362(5): 387-401.
- Polman CH, et al: NEJM 2006; 354(9): 899-910.
- Bloomgren G, et al: NEJM 2012; 366(20): 1870-1880.
- www.biogenidec.ch.
- Directriz DGN sobre o diagnóstico e terapia da EM. Diener HC, Weimar C (eds.): Guidelines of the German Society of Neurology Thieme Verlag: Stuttgart 2012, 430-475.
- Salminen HJ, Leggett H, Boggild M: J Neurol 2010; 257(12): 2020-2023.
- Kappos L, et al: Neurology 2004; 63(10): 1779-1787.
- Hartung HP, et al: Lancet 2002; 360(9350): 2018-2025.
- Martinelli V, et al: Neurology 2011; 77(21): 1887-1895.
InFo Neurologia e Psiquiatria 2013; 11(6): 13-20











