A utilização dos quatro testes multigene MammaPrint, Oncotype DX, EndoPredict e Prosigna pode ser útil quando se decide sobre quimioterapia adjuvante. Em que pacientes em particular devem ser utilizados?
Felizmente, a taxa de mortalidade por carcinoma da mama tem diminuído nas últimas décadas. As razões para isto são o diagnóstico precoce de carcinomas mamários, novas substâncias e também o uso frequente de quimioterapia adjuvante. Coloca-se agora a questão de saber se a terapia poderia ser desescalonada em alguns pacientes [1].
Decisão baseada em factores de risco clínicos e patológicos
A decisão sobre qual paciente deve receber quimioterapia adjuvante e qual não deve ser feita anteriormente com base em factores de risco clínicos e patológicos tais como tamanho do tumor, estado dos gânglios linfáticos, grau de tumor, taxa de proliferação, expressão do receptor hormonal e estado Her2.
Para carcinomas triplenegativos (“tipo basal”) e para tumores Her2 positivos, é indiscutível que a quimioterapia adjuvante deve ser administrada. Têm normalmente uma elevada taxa de proliferação e tendem a crescer de forma mais agressiva. Ambos os grupos respondem geralmente bem à quimioterapia.
A decisão é um pouco mais difícil no caso do receptor de estrogénio bem diferenciado (ER)-positivo luminal A e dos tumores luminais B mal diferenciados ER-positivos, que são mais difíceis de distinguir uns dos outros. Até agora, a taxa de proliferação, que foi determinada com a ajuda de um imunossistema KI-67 nem sempre fiável, tem sido utilizada para diferenciar.
Testes de expressão multigene
A fim de se poder determinar com maior certeza que paciente deve receber quimioterapia além da terapia anti-hormonal no grande grupo de carcinomas hormonais receptores da mama, é portanto necessário ser capaz de prever melhor e mais individualmente o risco.
Por exemplo, o desenvolvimento de microarrays de cDNA começou há cerca de 20 anos para investigar a expressão genética dos tumores com mais detalhe. Com estas matrizes, a expressão de cerca de 500 genes poderia ser determinada simultaneamente. Verificou-se que os tipos de carcinoma mamário biologicamente diferentes podem também ser distinguidos uns dos outros com base no padrão de expressão genética.
Com base nestes estudos, foram desenvolvidos testes de expressão multigene para uso clínico de rotina, que se limitam aos genes mais importantes que são necessários para distinguir entre tipos de tumor prognosticalmente diferentes e permitir a tomada de decisões terapêuticas individuais.
Quatro desses testes de expressão multigene estão agora disponíveis na Suíça (Tab. 1) [2–4]:
- MammaPrint: O teste é realizado centralmente em material tumoral congelado ou fixado com formalina e examina a expressão genética de 70 genes. MammaPrint distingue risco baixo de alto prognóstico.
- Oncótipo DX: O teste realiza-se centralmente nos EUA em material incluído em parafina e examina a expressão de 21 genes. É um prognóstico para o risco de recaída nos primeiros cinco anos e dá um valor numérico entre 0 e 100 (“pontuação de recorrência”) como medida do risco de recaída. Com base no Oncotype DX, são também possíveis declarações sobre a eficácia das quimioterapias [2,3].
- EndoPredict: O teste é realizado de forma descentralizada, também na Suíça, em tecido fixado em formol ou em parafina, testa a expressão do mRNA de 12 genes e inclui parâmetros clinicopatológicos (tamanho do tumor, número de gânglios linfáticos axilares afectados). Portanto, não é um teste genético puro. O significado prognóstico para a previsão de metástases precoces e tardias foi validado.
- Prosigna: O teste examina a expressão de 50 genes e pode também ser realizado localmente com o equipamento de laboratório apropriado. Foi desenvolvido para determinar o subtipo biológico, mas também pode ser utilizado de forma prognóstica através da estimativa do risco individual de recaída do paciente.
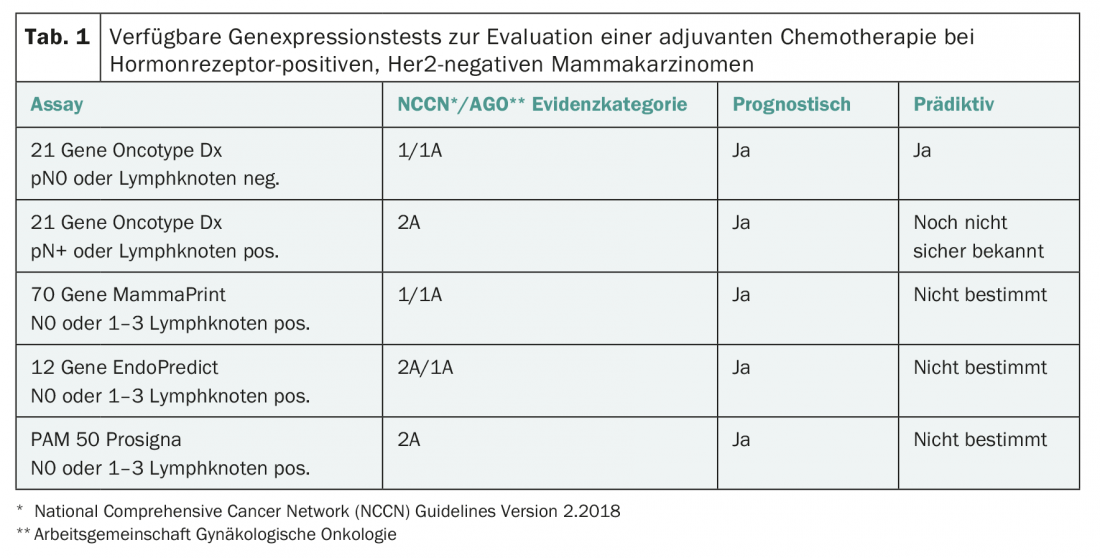
A importância prognóstica dos quatro testes foi comprovada em estudos retrospectivos. Existem agora também dados prospectivos para Oncotype DX e MammaPrint (TAILORx, Mindact [5,6]). Todos os quatro testes são recomendados pelas directrizes internacionais (ASCO, directrizes da ESMO, AGO, Consenso de St. Gallen [1]) como testes de prognóstico e são agora reembolsados pelas companhias de seguros de saúde. Contudo, não é o caso que os resultados dos diferentes testes estejam 100% correlacionados. Por exemplo, uma comparação de EndoPredict e Oncotype DX encontrou uma concordância significativa mas bastante moderada dos resultados de 76% [7].
Quando é que a quimioterapia é útil?
Levanta-se agora a questão para qual grupo de risco definido por um tal teste de expressão genética adjuvante da quimioterapia faz sentido. Esta questão está a ser investigada nos estudos actualmente publicados TAILORx e Mindact.
O estudo TAILORx [5] é um estudo prospectivo realizado com o ensaio de 21 genes, Oncotype DX. 10 273 mulheres com receptor hormonal positivo, Her2-negativo carcinoma da mama sem envolvimento de gânglios linfáticos foram incluídas. O resultado do teste fornece uma “pontuação de recorrência” (RS) entre 1 e 100, sendo que um valor entre 1 e 11 prevê um baixo risco de recorrência para o qual não é indicada quimioterapia, e um valor >25 indica um risco elevado para o qual a quimioterapia parece ser aconselhável. Havia ambiguidade entre as mulheres com um risco médio entre 11 e 25, afectando a maioria dos pacientes (69%). Este grupo de 9719 mulheres foi aleatorizado em dois braços de estudo com e sem quimioterapia. Todos os doentes receberam terapia anti-hormonal adjuvante. O período médio de observação foi de nove anos. Após este período, ambos os grupos de tratamento tiveram taxas semelhantes de sobrevivência sem doenças, nomeadamente 83,3% no grupo tratado exclusivamente com anti-hormonas e 84,3% no grupo que também tinha recebido quimioterapia. Não houve diferença na sobrevivência global (93,9% vs. 93,8%), especialmente nas mulheres com mais de 50 anos de idade. Em pacientes com mais de 50 anos e com uma RS de 0-25, pode portanto presumir-se que a quimioterapia não traz qualquer benefício adicional. Entre os pacientes mais jovens, especialmente aqueles com um RS de 21-25, cerca de 6,5% beneficiaram da quimioterapia.
O estudo Mindact [6] foi realizado com a assinatura MammaPrint de 70gene. Este teste distingue tumores com baixo risco genético de tumores com alto risco genético para a ocorrência de metástases distantes após cinco e dez anos. A Mindact é um ensaio de fase III que investiga a utilidade de um microarray (MammaPrint) como informação adicional aos factores de risco clínico na decisão individual sobre o uso de quimioterapia adjuvante. Em 6693 mulheres, o risco genético foi determinado com MammaPrint e o risco clínico foi determinado com a ajuda de “Adjuvant Online”, tendo em conta os factores de risco clássicos. Quando o risco clínico e genético coincidiu, o tratamento foi claro: os pacientes com baixo risco genético e clínico não receberam quimioterapia e os pacientes com alto risco genético e clínico receberam quimioterapia. Os doentes com risco discordante, ou seja, de alto risco genético e baixo risco clínico ou vice-versa, foram randomizados em dois grupos de tratamento com e sem quimioterapia, além da terapia anti-hormonal. Verificou-se que a administração da quimioterapia não fez uma diferença significativa para a sobrevivência livre de doenças nos grupos discordantes. Olhando para o grupo de 1550 pacientes com elevado risco clínico e baixo risco genético, existe apenas uma diferença de 1,5% na sobrevida livre de recorrência à distância (DRFS) após cinco anos a favor da quimioterapia. Os doentes com baixo risco clínico e alto risco genético não beneficiaram de quimioterapia em termos de DRFS. Assim, pode-se tirar a conclusão deste estudo que só se deve oferecer testes genéticos a pacientes com alto risco clínico e pode-se então poupar os pacientes com quimioterapia de baixo risco genético, a menos que os pacientes insistam na quimioterapia para minimizar o risco de recaída por mais 1,5%. No entanto, estes pacientes não precisam de um teste genético.
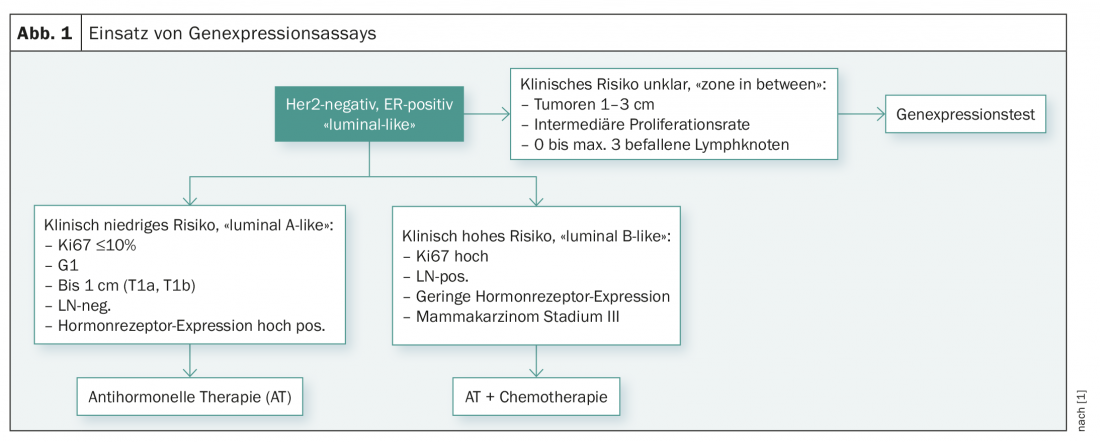
Reunião de Consenso de St. Gallen 2017
Na reunião do Consenso de St Gallen de 2017 em Viena, estes estudos e a utilização de testes multigenes foram também discutidos [1]. Actualmente, os peritos viram a indicação de testes genéticos apenas para responder à questão de saber se um paciente necessita ou não de quimioterapia adjuvante. De acordo com a actual recomendação consensual, os testes genéticos não devem ser realizados em casos de baixo risco clínico (pT1a/b, G1, ER elevado, N0, baixa taxa de proliferação) e em casos de risco clínico claramente elevado (baixa expressão do receptor hormonal, G3, alta taxa de proliferação, envolvimento de muitos gânglios linfáticos ou fase III). O painel de peritos considerou os testes genéticos como úteis apenas em doentes com um perfil de risco clínico não totalmente claro (tamanho do tumor 1-3 cm, envolvimento de 0-3 gânglios linfáticos axilares e taxa de proliferação intermédia) (Fig. 1).
Literatura:
- Curigliano G, et al: Diminuição e escalada dos tratamentos para o cancro da mama em fase inicial: a Conferência de Consenso Internacional de Peritos de St. Gallen sobre a Terapia Primária do Cancro Precoce da Mama 2017. Anais de Oncologia 2017; 28: 1700-1712.
- Paik S, et al: Um ensaio multigene para prever a recorrência do cancro da mama tratado com Tamoxifen, Node-Negativo. N Engl J Med 2004; 351(27): 2817-2826.
- Paik S, et al: Gene Expression and Benefit of Chemotherapy in Women With Node-Negative, Estrogen Receptor-Positive Breast Cancer. J Clin Oncol 2006; 24: 3726-3734.
- Markopoulos C, et al: Provas clínicas que apoiam testes genómicos em cancro da mama precoce: Todos os testes genómicos fornecem a mesma informação? EJSO 2017; 43: 909-920.
- Sparano JA, et al: Quimioterapia Adjuvante Guiada por um Ensaio de Expressão de 21 Genes no Cancro da Mama. N Engl J Med 2018; 379: 111-121.
- Cardoso F, et al: 70-Gene Signature as an Aid to Treatment Decisions in Early-Stage Breast Cancer. N Engl J Med 2016; 375(8): 717-729.
- Varga Z, et al: Comparação dos resultados dos testes EndoPredict e Oncotype DX em Receptor Hormonal Positivo Cancro da Mama Invasivo. PLOS UM 2013; 8(3): e58483.
- Lux MP, et al.: Budget Impact analysis of gene expression tests to aid Therapy decisions for breast cancer patients in Germany. O Peito 2018; 37: 89-98.
Leitura adicional:
- Sørlie T, et al.: Os padrões de expressão genética dos carcinomas da mama distinguem subclasses tumorais com implicações clínicas. PNAS 2001; 98(19): 10869-10874.
InFo ONCOLOGy & HaEMATOLOGy 2018; 6(6): 26-29.











