A que visam realmente as chamadas terapias específicas? E que progressos foram feitos a este respeito nas várias neoplasias hemato-oncológicas? No 21º Simpósio de Medicina no Manège, no Circus Knie, o Prof. Dr. med. Markus G. Manz do Hospital Universitário de Zurique deu respostas às perguntas mais ardentes.
Segundo o Prof. Markus G. Manz, MD, Clínica de Hematologia, Hospital Universitário de Zurique, os cancros no campo da hemato-oncologia representam cerca de 10% das neoplasias na Suíça. Trata-se principalmente das chamadas “doenças da velhice”, ou seja, condições que ocorrem mais frequentemente com o aumento da idade.
“Mesmo que não se assuma o cenário demográfico mais extremo, mas sim um cenário médio, uma duplicação da população com mais de 65 anos de idade terá lugar até 2030. Assim, de uma forma muito simplificada, é de esperar uma duplicação das neoplasias hemato-oncológicas, o que torna ainda maior a necessidade de terapias adequadas”, explicou o Professor Manz.
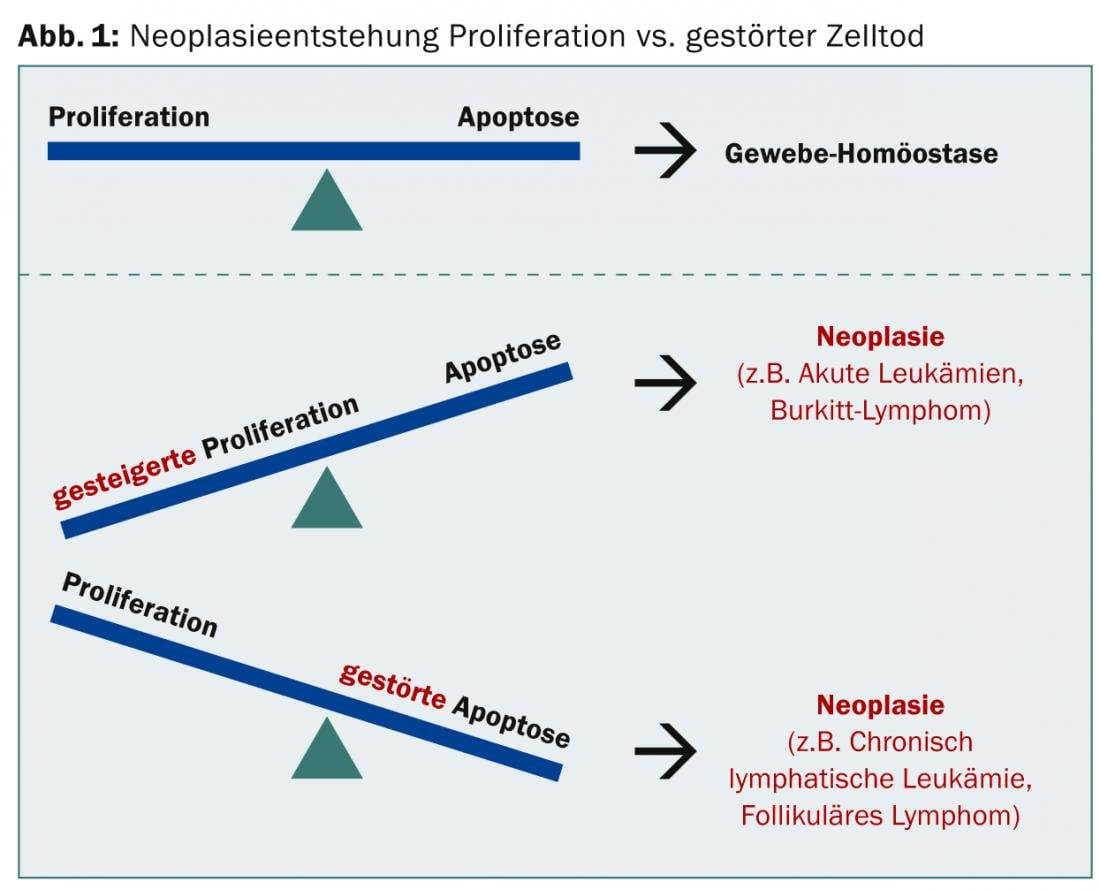
No caso de uma neoplasia, ou o aumento da proliferação ou a apoptose perturbada podem predominar, em ambos os casos o equilíbrio dos tecidos já não é dado (Fig. 1).
O ideal de terapia orientada, por outro lado, é a maior selectividade possível do tumor; deve atacar apenas o tumor, mas não todo o paciente ou o tecido saudável. “A chamada quimioterapia clássica não direccionada é normalmente dependente do ciclo celular, ou seja, segue o princípio: muita divisão – alto efeito”, disse o orador. A terapia orientada, por outro lado, visa os chamados “condutores de tumores” que são essenciais para o tumor e que, assim, destroem o tumor de forma eficiente e, pelo menos teoricamente, com o menor número possível de efeitos secundários.
Os dois alvos mais comuns são enzimas/kinases (intracelulares) e antigénios na superfície celular. As primeiras são inibidas pelas chamadas “pequenas moléculas”, as segundas são atacadas por anticorpos com ou sem “munições” presas.
As quinases transferem um resíduo de fosfato e podem, portanto, activar outras enzimas. São essenciais para a transdução de sinal na célula. No tecido tumoral, a cinase está sempre activa, o que leva a uma divisão celular maciça. O inibidor bloqueia a cinase e assim coloca a divisão celular num estado inactivo. “Um excelente exemplo de um inibidor da cinase é o imatinibe. O Rituximab, por outro lado, é o mais conhecido representante dos anticorpos monoclonais e levou a uma verdadeira revolução em todos os linfomas com expressão CD20, que inclui praticamente todos os linfomas de células B”, diz o Prof.
Que melhorias podem ser feitas?
Utilizando como exemplo a leucemia mielóide crónica (LMC), o Prof. Manz mostrou que desde que os inibidores da tirosina cinase foram introduzidos pela primeira vez por volta de 2001, a eficácia do tratamento aumentou consideravelmente e a sobrevivência a longo prazo melhorou significativamente como resultado. “Cerca de 5% dos doentes com LMC no imatinib são chamados super-respondedores: aqui, pela primeira vez, coloca-se a questão de uma possível cura [1,2]”, diz o Prof. Manz. “A consequência do sucesso é uma expectativa crescente no campo da CML para o futuro próximo: 100% de sobrevivência a longo prazo com 0% de redução na qualidade de vida”.
Como segundo exemplo, mencionou o desenvolvimento no campo da mielofibrose primária (PMF): a chamada mutação JAK-2 (Janus kinase 2) ocorre em cerca de 50% dos casos de PMF. Menos de dez anos após a descoberta e identificação desta mutação, o primeiro inibidor JAK foi então aprovado. “Mostra de dados sob ruxolitinibe (Jakavi®), em comparação com a melhor terapia disponível, uma melhoria no controlo dos sintomas e na qualidade de vida [3], bem como uma melhor sobrevivência global em comparação com o placebo [4]. Mas: os inibidores JAK-1&2 também são activos em JAK-2 não mutantes. O alvo selectivo no tumor então não é de todo relevante”, perguntou o Prof. Manz.
O último tópico foi a leucemia linfocítica crónica (CLL). Aqui, a adição de um anticorpo anti-CD20 à quimioterapia demonstrou ser mais eficiente do que apenas a quimioterapia. Além disso, os anticorpos anti-CD20 optimizados como o GA101 (obinutuzumab) funcionam melhor do que os da primeira geração [5].
“Actualmente, existem também estudos que investigam a eficácia da inibição da cinase na CLL [6]. Uma ampla aplicação deste modo de acção no linfoma de B-non-Hodgkin é muito provável num futuro próximo”, conclui o Prof.
Fonte: 21st Symposium Medicine in the Manege, 5 de Junho de 2014, Zurique
Literatura:
- Mahon FX, et al: Descontinuação do imatinibe em doentes com leucemia mielóide crónica que tenham mantido uma remissão molecular completa durante pelo menos 2 anos: o ensaio prospectivo, multicêntrico Stop Imatinib (STIM). Lancet Oncol 2010 Nov; 11(11): 1029-1035.
- Ross DM, et al: Segurança e eficácia da cessação da imatinibração para doentes com CML com doença residual mínima estável e indetectável: resultados do estudo TWISTER. Sangue 2013 Jul 25; 122(4): 515-522.
- Harrison C, et al: JAK Inhibition with Ruxolitinib versus Best Available Therapy for Myelofibrosis. N Engl J Med 2012; 366: 787-798.
- Verstovsek S, et al: Long-Term Outcomes Of Ruxolitinib Therapy In Patients With Myelofibrosis: 3-Year Update From COMFORT-I. Sangue 2013; 122(21): 396.
- Goede V, et al: Obinutuzumab plus chlorambucil em doentes com CLL e condições de coexistência. N Engl J Med 2014; 370: 1101-1111.
- Byrd JC, et al: Ibrutinib versus ofatumumab em Leucemia Linfóide Crónica Anteriormente Tratados. NEJM 31 de Maio de 2014. DOI: 10.1056/NEJMoa1400376.
InFo ONCOLOGy & HaEMATOLOGy 2014; 2(6): 33-34