Atualmente, existe uma vasta gama de opções de tratamento para a alopecia androgenética (AAG). As preparações tópicas com o ingrediente ativo minoxidil e os inibidores orais da 5-α-redutase finasterida e dutasterida estão entre as medidas terapêuticas clássicas baseadas na evidência. No entanto, atualmente, existem também vários estudos sobre a terapia laser de baixa intensidade e o plasma rico em plaquetas (PRP).
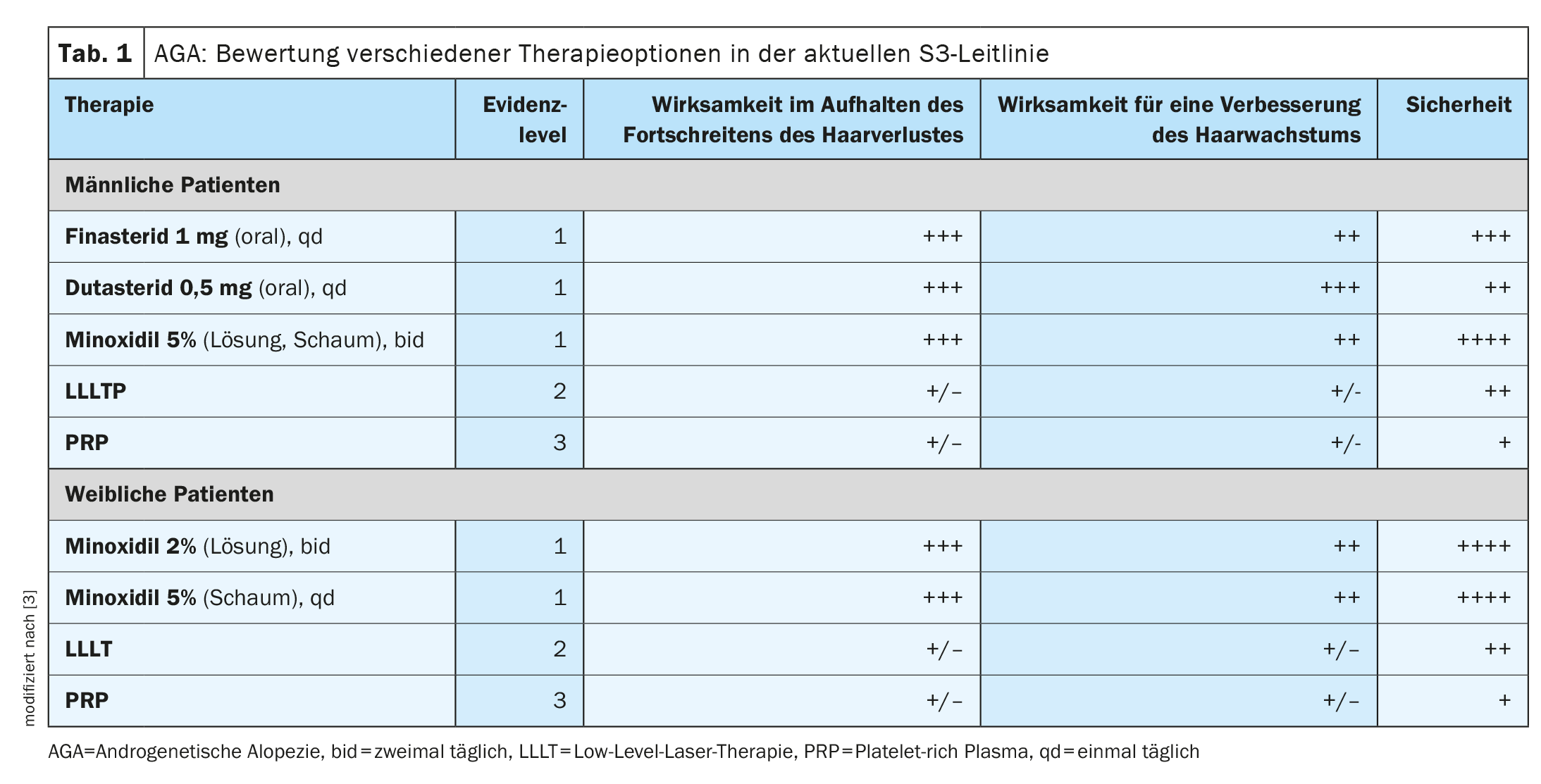
A queda de cabelo é um sintoma que altera muito a sua aparência e pode afetar significativamente a sua qualidade de vida. Tanto nos homens como nas mulheres, cerca de 95% de todos os casos de queda de cabelo são causados pela alopecia androgenética (alopecia androgenética, AGA). Esta queda de cabelo congénita (caixa) é, portanto, a causa mais comum de alopecia em ambos os sexos [1,4–7]. Kaiser et al. resumiram as provas actuais sobre as várias opções de tratamento da AAG num artigo de revisão publicado em 2023 [2]. E a diretriz S3 para o tratamento da AAG em homens e mulheres publicada no JEADV em 2018 baseia-se na avaliação das terapias actuais com base na análise de 47 artigos científicos que cumprem os critérios de inclusão de acordo com as normas AGREE [3]. Os critérios de avaliação incluíram a eficácia para travar a progressão da queda de cabelo, a eficácia para melhorar o crescimento do cabelo e a segurança da respectiva opção de tratamento (Quadro 1) .
Minoxidil tópico: a atividade da sulfotransferase no folículo piloso é relevante
O Minoxidil é autorizado para o tratamento tópico do couro cabeludo na alopécia androgenética em homens e mulheres. O efeito é direcionado para a raiz do cabelo. Nos homens, a solução a 5% demonstrou ser mais eficaz do que a solução a 2% quando utilizada duas vezes por dia [8]. Nas mulheres, as soluções a 2% e 5% alcançaram uma eficácia aproximadamente semelhante [9,10]. A enzima sulfotransferase, que converte o minoxidil na sua forma biologicamente ativa, o sulfato de minoxidil, parece desempenhar um papel importante. Vários estudos demonstraram que o sucesso da aplicação de minoxidil está correlacionado com a quantidade de sulfotransferase nos folículos capilares [11]. Esta é uma explicação possível para o facto de nem todas as pessoas com AGA responderem ao minoxidil. Goren et al. relataram que, após 16 semanas de aplicação tópica contínua de minoxidil, cerca de 40% dos pacientes apresentaram uma resposta à terapia [12]. Pensa-se que 60% dos doentes do sexo masculino não respondem à terapêutica com minoxidil tópico devido aos baixos níveis de base da sulfotransferase [14]. E a análise da atividade da sulfotransferase nos folículos pilosos arrancados parece ser um indicador preciso da resposta das mulheres ao tratamento tópico com minoxidil [11]. Os primeiros efeitos do minoxidil no crescimento do cabelo começam normalmente após 6-8 semanas e atingem o seu máximo após 12-16 semanas [13]. Os produtos Minoxidil (solução ou espuma) devem ser aplicados duas vezes por dia. Se a aplicação for interrompida, os efeitos desaparecem novamente após algum tempo. Os efeitos secundários ocasionais do minoxidil podem incluir comichão, vermelhidão, inflamação e caspa no couro cabeludo [16]. Também pode ocorrer hipertricose, especialmente em mulheres [10]. Outro efeito secundário é a queda de cabelo, que provoca um aumento temporário da queda de cabelo no início do tratamento. Se o doente não for informado, tal pode resultar na interrupção prematura do tratamento [10,15].
| Nos homens, a AAG manifesta-se por uma queda de cabelo gradualmente crescente na zona frontoparietal (“receding hairline”), frontal e/ou no vértex. Cerca de metade dos homens com mais de 65 anos têm AGA. As mulheres caracterizam-se por um enfraquecimento uniforme do cabelo na zona da coroa, mantendo-se intacta a linha do cabelo na zona da testa. A AAG pode ocorrer em mulheres após a puberdade, sendo a prevalência em pessoas com 70 anos de idade de cerca de 38%. |
| para [27] |
Quando a finasterida oral falha: a dutasterida como uma alternativa possível
Foi demonstrado que a finasterida numa dose de 1 mg/dia reduz a progressão da AAG [17]. Numa revisão sistemática efectuada por Mella et al. verificou-se que a finasterida oral melhorou significativamente o crescimento do cabelo e o número médio de cabelos em comparação com o placebo em dez estudos [18]. Num estudo de acompanhamento de 10 anos efectuado por Rossi et al. verificou-se também que a utilização diária de finasterida em homens com AAG durante 5 anos resultou numa melhoria sustentada do número de cabelos em 21% dos doentes. Os melhores resultados de crescimento capilar foram obtidos na área da coroa do couro cabeludo, enquanto que apenas foram observadas melhorias clínicas mínimas na área da testa [19]. Os efeitos secundários mais comuns da finasterida incluem a disfunção sexual; dependendo do estudo, a frequência varia entre 1% e 40% [20,21]. A base de dados sobre a segurança da utilização a longo prazo da finasterida oral é bastante limitada.
Os doentes nos quais a finasterida oral não é eficaz podem beneficiar do tratamento com dutasterida. Um estudo efectuado por Jung et al. hin. Os doentes do sexo masculino (n=31) receberam dutasterida oral 0,5 mg/d [22] após uma tentativa falhada de tratamento com finasterida. Cerca de 80% registaram melhorias clínicas ao fim de 6 meses. A densidade do cabelo aumentou em 10% de forma estatisticamente significativa e a espessura do cabelo aumentou em 20%. Foram notificados efeitos secundários semelhantes com a dutasterida, tais como redução da libido, impotência, perturbações da ejaculação e ginecomastia.
| Alterações no metabolismo dos androgénios relacionadas com a idade Pensa-se que a principal causa da AAG são as alterações do metabolismo dos androgénios relacionadas com a idade, que levam a um encurtamento progressivo da fase anagénica do crescimento do cabelo e a uma diminuição do tamanho do folículo piloso [2,4]. Além disso, há uma fase telógena prolongada, que leva à regressão dos folículos pilosos [5]. Devido ao aumento da ativação dos receptores de androgénio na AAG, os folículos pilosos tornam-se cada vez mais curtos até deixarem de conseguir penetrar na epiderme [6]. Verificou-se que os doentes com AAG têm níveis elevados de dihidrotestosterona (DHT) e que as regiões do couro cabeludo afectadas pela AAG têm receptores de androgénio aumentados [6]. Tipicamente, a AGA resulta na perda de pêlos terminais e na sua substituição por pequenos pêlos velus, geralmente nas áreas temporal, parietal e médio-frontal do couro cabeludo [7]. |
Terapia laser de baixa intensidade (LLLT)
Na LLLT, o crescimento do pelo é estimulado pela luz laser emitida por díodos laser. A LLLT pode ser efectuada em casa, usando um capacete com um laser integrado. Em geral, a LLLT é bem tolerada e os efeitos secundários são normalmente menores (por exemplo, couro cabeludo seco, comichão, sensibilidade e uma sensação de calor) [3]. Um total de três estudos sobre LLLT preencheu os critérios de inclusão da diretriz S3. A LLLT levou a um aumento da contagem de pêlos após 16 e 26 semanas de aplicação sob diferentes protocolos e com dois dispositivos diferentes. No entanto, não foi efectuado qualquer acompanhamento a longo prazo [3]. Uma meta-análise recente efectuada por Liu et al. constatou que 11 ensaios aleatórios, duplamente cegos e controlados encontraram uma melhoria estatisticamente significativa na densidade do cabelo em pacientes tratados com LLLT em comparação com dispositivos placebo [23].
Por último, mas não menos importante: PRP
O plasma rico em plaquetas (PRP) é obtido a partir do sangue do próprio doente. Foram incluídos três estudos PRP na diretriz S3 [3,24–26]. Foram incluídos doentes do sexo masculino e feminino em dois deles [24,25]. Foi observado um aumento da densidade capilar com o tratamento PRP [24–26]. No entanto, o PRP foi realizado em pequenas amostras, com diferentes protocolos e sem um grupo de controlo. De acordo com Kaiser et al. O PRP é particularmente interessante como opção de tratamento para doentes em que várias modalidades de tratamento de primeira linha falharam [2]. Independentemente da opção de tratamento, é importante discutir as suas expectativas e objectivos com os doentes e abordar os riscos de efeitos secundários e os custos do tratamento.
Literatura:
- Deutsches Endokrinologisches Versorgungszentrum: Anlagebedingter Haarausfall, www.endokrinologen.de, (último acesso 19.01.2024)
- Kaiser M, et al.: Treatment of Androgenetic Alopecia: Current Guidance and Unmet Needs. Clin Cosmet Investig Dermatol 2023; 16: 1387–1406.
- Kanti V, et al.: Evidence-based (S3) guideline for the treatment of androgenetic alopecia in women and in men – short version. JEADV 2018; 32(1): 11–22.
- Trüeb RM. Molecular mechanisms of androgenetic alopecia. Exp Gerontol 2002; 37(8–9): 981–990.
- Kaliyadan F, Nambiar A, Vijayaraghavan S: Androgenetic alopecia: an update. Indian J Dermatol Venereol Leprol 2013; 79(5): 613.
- Ho CH, Sood T, Zito PM: Androgenetic alopecia. In: StatPearls. StatPearls Publishing; 2021.
- Rathnayake D, Sinclair R: Male androgenetic alopecia. Expert Opin Pharmacother 2010;11(8): 1295–1304.
- Olsen EA, et al.: A randomized clinical trial of 5% topical minoxidil versus 2% topical minoxidil and placebo in the treatment of androgenetic alopecia in men. JAAD 2002; 47(3): 377–385.
- Lucky AW, et al.: A randomized, placebo-controlled trial of 5% and 2% topical minoxidil solutions in the treatment of female pattern hair loss. JAAD 2004; 50(4): 541–553.
- Blumeyer A, et al.: Evidence-based (S3) guideline for the treatment of androgenetic alopecia in women and in men. JDDG 2011; 9: S1–S57.
- Roberts J, et al.: Sulfotransferase activity in plucked hair follicles predicts response to topical minoxidil in the treatment of female androgenetic alopecia. Dermatol Ther 2014; 27(4): 252–254.
- Goren A, et al.: Clinical utility and validity of minoxidil response testing in androgenetic alopecia. Dermatol Ther 2015; 28(1): 13–16.
- Messenger A, Rundegren J: Minoxidil: mechanisms of action on hair growth. BJD 004; 150(2): 186–194.
- Goren A, et al.: Novel enzymatic assay predicts minoxidil response in the treatment of androgenetic alopecia. Dermatol Ther 2013; 27(3): 171–173.
- Randolph M, Tosti A: Oral minoxidil treatment for hair loss: a review of efficacy and safety. JAAD 2021; 84(3): 737–746.
- Suchonwanit P, Thammarucha S, Leerunyakul K: Minoxidil and its use in hair disorders: a review. Drug Des Devel Ther 2019; 13: 2777.
- Kaufman KD, et al.: Finasteride in the treatment of men with androgenetic alopecia. JAAD 1998; 39(4): 578–589.
- Mella JM, et al.: Efficacy and safety of finasteride therapy for androgenetic alopecia: a systematic review. Arch Dermatol 2010; 146(10): 1141–1150.
- Rossi A, et al.: Finasteride, 1 mg daily administration on male androgenetic alopecia in different age groups: 10-year follow-up. Dermatol Ther 2011; 24(4): 455–461.
- Hirshburg JM, et al.: Adverse effects and safety of 5-alpha reductase inhibitors (finasteride, dutasteride): a systematic review. J Clin Aesthet Dermatol 2016; 9(7): 56.
- Ganzer CA, Jacobs AR, Iqbal F: Persistent sexual, emotional, and cognitive impairment post-finasteride: a survey of men reporting symptoms. Am J Men Health 2015; 9(3): 222–228.
- Jung JY, et al.: Effect of dutasteride 0.5 mg/d in men with androgenetic alopecia recalcitrant to finasteride. Int J Dermatol 2014; 53(11): 1351–1357.
- Liu K-H, et al.: Comparative effectiveness of low-level laser therapy for adult androgenic alopecia: a system review and meta-analysis of randomized controlled trials. Lasers Med Sci 2019; 34(6): 1063–1069.
- Jha AK, et al.: Platelet-rich plasma and microneedling improves hair growth in patients of androgenetic alopecia when used as an adjuvant to minoxidil. J Cosmet Dermatol 2019; 18(5): 1330–1335.
- Aggarwal K, et al.: Dermoscopic assessment of microneedling alone versus microneedling with platelet-rich plasma in cases of male pattern alopecia: a split-head comparative study. Int J Trichology 2020; 12(4): 156.
- Sinclair RD: Female pattern hair loss: a pilot study investigating combination therapy with low-dose oral minoxidil and spironolactone. Int J Dermatol 2018; 57(1): 104–109.
- Beise U: Guideline Haarausfall, www.medix.ch/wissen/guidelines, (último acesso 22.01.2024).
DERMATOLOGIE PRAXIS 2024; 34(1): 48–49