Com a introdução do inibidor de Janus kinase (JAK) ruxolitinibe, a terapia da mielofibrose mudou drasticamente nos últimos anos. No entanto, é necessária mais inovação, especialmente na segunda linha. Dados promissores sobre novas opções de tratamento foram apresentados na última Reunião Anual da ASH em Dezembro de 2020.
Além do transplante de células estaminais, há muito que não existem instrumentos terapêuticos eficazes para a mielofibrose. Embora tenham sido dados passos importantes na luta contra a doença nos últimos anos através do desenvolvimento de inibidores JAK, ainda não se vislumbra uma cura. Talvez agora, através da utilização de agentes novos e inovadores, pelo menos o controlo dos sintomas a longo prazo esteja ao nosso alcance.
Estado da arte
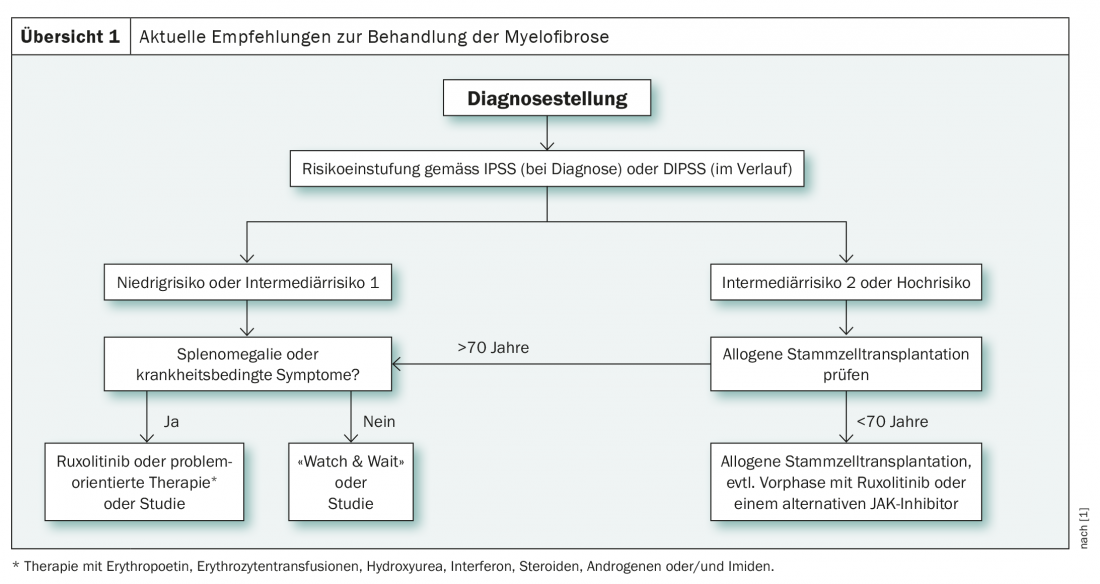
O factor decisivo para a escolha da terapia no diagnóstico da mielofibrose é a estratificação do risco, que é realizada no diagnóstico de acordo com o IPSS(International Prognostic Scoring System) e no curso seguinte utilizando o DIPPS (Dynamic International Prognostic Scoring System) em quatro grupos (baixo risco, médio-1, médio-2 e alto risco). Estes são sistemas de pontuação clínica, que podem ser complementados por outros métodos de classificação, conforme necessário. Por exemplo, o GIPSS (Genetically Inspired Prognostic Scoring System) também leva em conta factores genéticos citogenéticos e moleculares. Estes podem facilitar a decisão a favor ou contra o transplante de células estaminais em casos pouco claros e são, portanto, particularmente úteis no grupo de risco intermédio-1 [1]. De acordo com as novas directrizes internacionais, o transplante de células estaminais é recomendado para este grupo de pessoas com menos de 65 anos de idade, se determinados critérios forem cumpridos. Estes incluem anemia relacionada com transfusão refractária, explosões circulantes >2% e genética cito ou molecular desfavorável [2].
Em contraste com o grupo de risco intermédio-1, a recomendação para o transplante alogénico de células estaminais é clara no grupo de risco intermédio-2 e no grupo de alto risco nos menores de 70 anos de idade (visão geral 1) . Desde 2017, o inibidor de tirosina quinase ruxolitinibe tem sido também cada vez mais utilizado. Isto é utilizado particularmente na fase preliminar do transplante de células estaminais e no tratamento de doentes de risco baixo a intermédio, especialmente na presença de sintomas relacionados com doenças ou esplenomegalia. Como alternativa à terapia com ruxolitinibe, os doentes sintomáticos de baixo e médio risco também podem ser tratados de uma forma orientada para o problema. Esta abordagem inclui o uso de eritropoietina, transfusões de glóbulos vermelhos, hidroxiureia e esteróides [1].
Ruxolitinibe, mas também outros inibidores JAK, estão assim a aumentar tanto nos cenários de baixo como de alto risco. Por um lado, estes medicamentos servem para controlar os sintomas, e por outro lado, de acordo com estudos actuais, são capazes de apoiar o transplante de células estaminais. Quase dez anos após os primeiros dados do estudo sobre ruxolitinibe, o inibidor JAK tem agora efeitos duradouros na esplenomegalia e sintomas de mielofibrose relacionados com a doença, com melhorias a longo prazo na qualidade de vida [3,4]. Na Reunião Anual ASH 2020 , foi também discutido o potencial alargamento do tempo de sobrevivência do medicamento, para o qual existem cada vez mais dados promissores, embora até agora apenas retrospectivos [5]. No entanto, a progressão, especialmente na leucemia mielóide aguda, continua a ser um problema importante [5].
Espaço para melhorias
Apesar dos progressos significativos na terapia ao longo dos últimos anos, ainda há muito a melhorar. Especialmente no caso de falha do tratamento com ruxolitinibe e intolerância à substância activa, as opções são ainda muito limitadas actualmente. Embora a resistência primária seja rara, a resposta inadequada e a perda de resposta são mais comuns. Por exemplo, a duração média da acção do ruxolitinibe sobre a esplenomegalia é ligeiramente superior a três anos, o que limita frequentemente a utilização da substância no tempo e levanta a questão das opções terapêuticas complementares [3,4]. Esta necessidade médica reflecte-se também nas taxas de descontinuação da terapia com ruxolitinibe analisadas num estudo recentemente publicado, que são de 50 a 60% ao fim de três anos [6]. A sobrevivência média após a descontinuação do medicamento é de apenas 14 meses e é ainda mais reduzida na presença de aberrações clonais ou baixa contagem de plaquetas [7].
Além disso, o efeito da substância sobre a anemia, leucopenia e trombocitopenia é frequentemente insuficiente. São urgentemente necessárias estratégias terapêuticas alternativas para abordar adequadamente as citopénias que ocorrem na mielofibrose. Afinal, quase 40% dos doentes têm níveis de hemoglobina inferiores a 10 g/dL no momento do diagnóstico e 20% já são dependentes da transfusão neste momento [8].
Os efeitos positivos do ruxolitinibe também não podem esconder uma clara lacuna: As verdadeiras remissões sob a terapia actual são extremamente raras no cenário do mundo real [9]. Isto pode dever-se, entre outras coisas, ao mecanismo de acção, uma vez que a mutação do alvo JAK2V617F não é a única responsável pelo desenvolvimento da mielofibrose. Assim, a eliminação da doença não pode ser esperada com um bloqueio adequado por um inibidor JAK.
Um olhar sobre o futuro
Embora uma cura por esta classe de substâncias seja dificilmente possível mecanicamente, a esperança no tratamento da mielofibrose continua a residir principalmente no desenvolvimento de novos inibidores JAK. Por exemplo, foram apresentados na Reunião Anual ASH 2020 (síntese 2) dados sobre três novas substâncias que visam as JAK. Estas destinam-se a complementar no futuro a terapia de ruxolitinibe. O Fedratinib já está aprovado nos EUA e Canadá para terapia de primeira linha, e estão actualmente em curso ensaios de fase III para a utilização de momelotinibe e pacritinibe.

Os resultados do estudo JAKARTA-2 [10] mostram que o fedratinib é também promissor no tratamento de segunda linha. Aqui, o medicamento demonstrou uma forte eficácia na esplenomegalia e sintomas relacionados com a doença em todos os subgrupos pré-tratados com ruxolitinibe. A taxa de resposta foi de 55,4%. O Fedratinib poderá, portanto, ser brevemente utilizado na resistência e intolerância ao ruxolitinibe, especialmente se os resultados do JAKARTA-2 forem confirmados no ensaio FREEDOM-2, actualmente em curso e controlado aleatoriamente – um pré-requisito para aprovação na Suíça e na Europa.
Com o desenvolvimento de novas opções terapêuticas, várias questões vêm também à mesa. Por exemplo, o tempo ideal para mudar para um inibidor JAK alternativo precisa de ser avaliado. Até agora, a regra tem sido que a terapia com ruxolitinibe deve ser gradualmente eliminada antes da mudança, a fim de evitar um ressalto. Hoje, espera-se um período completo de três meses por uma resposta antes de o tratamento ser considerado um fracasso. O número crescente de opções também torna a escolha da terapia mais difícil. As preferências individuais, por exemplo em relação à frequência de utilização, bem como o respectivo espectro de efeitos secundários, poderão provavelmente desempenhar um papel mais importante no futuro.
Fonte: 62ª Reunião Anual da Sociedade Americana de Hematologia (ASH Annual Meeting), 5-8 de Dezembro de 2020, conduta virtual.
Literatura:
- Griesshammer M, et al.: Onkopedia Guidelines: Primary Myelofibrosis (PMF). www.onkopedia.com/de/onkopedia/guidelines/primaere-myelofibrose-pmf/@@guideline/html/index.html (último acesso em 03.01.2021)
- Barbui T, et al: Philadelphia chromosome-negative classic myeloproliferative neoplasms: recomendações de gestão revistas da European LeukemiaNet. Leucemia de 2018; 32(5): 1057-1069.
- Verstovsek S, et al: Tratamento a longo prazo com ruxolitinibe para doentes com mielofibrose: actualização de 5 anos do ensaio COMFORT-I, fase 3, aleatorizado, duplo-cego, controlado por placebo. J Hematol Oncol 2017; 10(1): 55.
- Harrison CN, et al: Conclusões a longo prazo de COMFORT-II, um estudo de fase 3 de ruxolitinibe vs melhor terapia disponível para a mielofibrose. Leucemia 2016; 30(8): 1701-1707.
- Al-Ali HK, et al: Análise primária do JUMP, um estudo de fase 3b, de acesso alargado avaliando a segurança e eficácia do ruxolitinibe em doentes com mielofibrose, incluindo aqueles com baixa contagem de plaquetas. Br J Haematol 2020; 189(5): 888-903.
- Harrison CN, Schaap N, Mesa RA: Gestão da mielofibrose após falha do ruxolitinibe. Ann Hematol 2020; 99(6): 1177-1191.
- Newberry KJ, et al: Evolução clonal e resultados na mielofibrose após a descontinuação do ruxolitinibe. Sangue 2017; 130(9): 1125-1131.
- Naymagon L, Mascarenhas J.: Myelofibrosis-Related Anemia: Current and Emerging Therapeutic Strategies (Anemia Relacionada com a Mielofibrose: Estratégias Terapêuticas Actuais e Emergentes). Hemasfera 2017; 1(1): e1.
- Gill H, et al: neoplasmas mieloproliferativos tratados com hidroxiureia, interferão peguilado alfa-2A ou ruxolitinibe: respostas clínico-hematológicas, alterações da qualidade de vida e segurança no contexto do mundo real. Hematologia 2020; 25(1): 247-257.
- Harrison CN, et al: Janus kinase-2 inibidor fedratinib em doentes com mielofibrose previamente tratados com ruxolitinibe (JAKARTA-2): um estudo de um único braço, com rótulo aberto, não aleatório, fase 2, multicêntrico. Lancet Haematol 2017; 4(7): e317-e24.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(1): 32-33 (publicado 24.2.21; antes da impressão).