Novos dados epidemiológicos mostram que a doença arterial periférica PAVD assumiu um carácter pandémico em todo o mundo. Embora apenas um terço dos doentes tenha sintomas, a doença arterial periférica é um importante marcador de doença vascular generalizada com elevada morbilidade e mortalidade que é fácil e barato de diagnosticar. Não fazer o diagnóstico significa perder uma importante abordagem preventiva. O rápido desenvolvimento de novas tecnologias com, em parte, resultados significativamente melhorados a curto e longo prazo, também em comparação com os procedimentos cirúrgicos abertos, está a conduzir cada vez mais a uma estratégia de “endovascular primeiro” (directrizes TASC II revistas).
202 milhões de pessoas em todo o mundo são afectadas por doenças arteriais periféricas (PAVD). Isto é quase cinco vezes mais do que o número de doentes seropositivos. As fronteiras nacionais, o rendimento e o nível de vida já não desempenham um papel no que diz respeito à frequência das doenças. A PAVD assumiu assim um carácter pandémico como uma das causas mais comuns de morbidade e mortalidade [1].
Hoje em dia, a PAVD ainda é aceite por muitas pessoas como um mal que não deve ser levado a sério, até porque dois terços dos pacientes manifestamente doentes não têm sintomas [2]. Este facto não leva os pacientes ao médico e o médico não se apercebe disso, a menos que efectue o estado de pulso e a medição ABI rotineiramente durante um exame de controlo.
A aterosclerose, a causa mais comum de PAVD, é tudo menos uma doença benigna. Semelhante a uma malignidade, tende a progredir continuamente e a “metástase” para o cérebro, coração, artérias periféricas e viscerais. Infelizmente, a terminologia actual não ajuda a sublinhar isto claramente. Fala-se de “doença coronária”, de “insuficiência cerebrovascular”, de “acidente vascular cerebral”, de “acidente vascular cerebral”, de “insulto isquémico”, de “claudicação intermitente”, de “distúrbio circulatório arterial periférico”, etc.
Num livro publicado em 2002 [3], já propusemos deixar de utilizar esta terminologia confusa e imprecisa e falar em vez de doença coronária, cerebral, periférica e visceral arterial oclusiva: Uma doença com múltiplos locais. Infelizmente, isto não pegou.
A consciência da necessidade de tratar agressivamente os factores de risco cardiovascular mesmo no paciente assintomático com PAVK não é dada a devida importância – a profilaxia secundária adequada da aterosclerose é realizada com menos frequência do que no paciente com uma manifestação coronária, por exemplo. Nos pacientes com PAVD, apenas 33% estão sobre um beta-bloqueador, apenas 29% estão sobre um inibidor da ECA, apenas 31% estão sobre uma estatina, e naqueles com diabetes conhecida, apenas 45% estão na gama recomendada de HBA1c inferior a 7% [4]. O risco de isquemia ou amputação crítica é de 1% por ano, mas o risco de mortalidade de 5-15% é três a quatro vezes superior ao de um grupo de comparação da mesma idade [5].
50% dos pacientes com PAVK têm um envolvimento coronário significativo e 43% têm um envolvimento cerebral significativo [6], independentemente de estes pacientes terem ou não sintomas. Não diagnosticar PAVD significa faltar a uma abordagem preventiva.
A incidência de diabetes mellitus irá aumentar significativamente nos próximos anos. A obesidade, causada pela falta de exercício como a razão mais comum, poderia facilmente ser evitada através de medidas preventivas, tais como desporto e programas de exercício [7]. Só na Alemanha, espera-se que haja mais 1,5 milhões de diabéticos entre os 55 e 74 anos de idade até 2030 [8]. 20% dos diabéticos com mais de 40 anos de idade manifestaram-se, na sua maioria assintomáticos, o que é um indicador de um elevado risco de amputação e risco cardiovascular. A Associação Americana de Diabetes recomenda há 10 anos que todos os diabéticos com mais de 50 anos de idade sejam rastreados para possíveis PAVK [9].
No início do século XIX, a PAVD era ainda uma doença muito rara, no final afectava principalmente o mundo industrializado e os homens mais frequentemente do que as mulheres. Hoje em dia, ambos os sexos são afectados com igual frequência nos países de rendimento elevado, e nos países de rendimento médio e baixo, as mulheres são ainda mais frequentemente doentes do que os homens.
De 2000 a 2010, o PAVK aumentou 23,5%. Este aumento continuará se não forem tomadas medidas preventivas adequadas. Os países de alto rendimento carecem de discernimento, os países de baixo rendimento carecem de dinheiro.
Mesmo em países medicamente muito desenvolvidos como a Alemanha, existe uma falta de consciência da doença, das suas possibilidades diagnósticas e, acima de tudo, terapêuticas entre os doentes manifestos.
Numa análise de todos os pacientes (n=41882) segurados pela maior companhia de seguros de saúde alemã que foram hospitalizados para PAVD entre 2009 e 2011, o seu tratamento e prognóstico foram documentados (acompanhamento até 2013) [10]. 4298 foram amputados, entre os quais 37% não tinham recebido nem angiografia nem revascularização dentro de 24 meses até à amputação, ou seja, não foram tratados de acordo com as directrizes. A menor proporção de angiografias e revascularizações na isquemia de membros críticos em comparação com as fases de claudicação é alarmante. Após a hospitalização do índice, mais 3527 pacientes foram amputados. Tais números fazem com que nos sentemos e tomemos nota, e levantam a questão de porque é que uma doença tão comum e grave não é percebida adequadamente.
O doente sintomático
As dores nas pernas relacionadas com o exercício reduzem significativamente a qualidade de vida, a produtividade e a saúde em geral das pessoas afectadas. A manifestação mais comum é uma perturbação circulatória das pernas femoro-poplíteas. Novas técnicas de cateteres intervencionistas e melhores materiais conseguiram uma melhoria significativa tanto no sucesso inicial como a longo prazo, de modo que hoje os procedimentos de terapia endovascular são normalmente a primeira linha de terapia [11].
O sucesso a longo prazo da angioplastia transluminal percutânea (ATP) é limitado apenas pela dissecção, recuo elástico e taxas de reestenose de até 70% a um ano.
Os stents de nitinol, stents de eluição de drogas (DES) e balões (DEB) são claramente superiores ao PTA nas lesões FP.
O período de observação mais longo para um DES está disponível para o stent Zilver®-PTX(técnica de célula aberta, revestimento sem polímero de paclitaxel, empresa Cook). No estudo prospectivo multicêntrico randomizado do mesmo nome [12], comprimentos de lesão relativamente curtos (média 6,5 cm) mostrou uma taxa aberta primária (PP) de 66,4% (total do grupo DES) em comparação com 43,4% no grupo do stent PTA/ bare-metal (BMS) a cinco anos (p<0,001%). Em termos de ausência de revascularização da lesão alvo (TLR), o DES foi também significativamente (p <0,001%) superior ao grupo da ATP/BMS (83,1% vs. 67,6%).
O stent EluviaTM-PTX (entrega de medicamentos à base de polímeros biostáveis com cinética de libertação prolongada, Boston Scientific) também está actualmente a mostrar resultados muito bons. O estudo prospectivo MAJESTIC de um único braço, multicêntrico [13] encontrou uma taxa de PP de 96% (49/51) e MAE (evento adverso maior), definida como qualquer morte no prazo de um mês, amputação da extremidade do alvo e TLR, de 4% aos 12 meses, impulsionada exclusivamente por TLRs. 91% dos pacientes tratados (57) mostraram uma melhoria clínica na classificação de Rutherford (fase 0 ou 1) e índice tornozelo-brachial (ABI, de 0,72 a 1,02). As lesões eram em média ligeiramente mais longas (71 mm) e quase duas vezes mais frequentemente (65% vs. 37%) severamente calcificadas (46% das quais eram oclusões). Entretanto, foram apresentados dados de dois anos no Congresso CIRSE (Sociedade Cardiovascular e Intervencionista Radiolocigal da Europa) de 2016 com eficácia e segurança contínuas (TLR 92,5%, MAE 7,5%). Além disso, não houve ruptura de stent nem amputação importante.
No entanto, o cepticismo mantém-se. Um factor limitante do DES é a supressão incompleta da hiperplasia neointimal devido a um efeito antiproliferativo não homogéneo entre as escoras do stent e as extremidades das endopróteses. Além disso, uma concentração relativamente elevada do medicamento antiproliferativo nas “escoras” leva a uma endotelização significativamente retardada do stent, o que, devido à superfície metálica protrombogénica, requer uma inibição prolongada da agregação plaquetária dupla. Além disso, praticamente nenhuma outra região vascular do nosso corpo apresenta um enorme desafio para qualquer material utilizado devido a forças tais como compressão, torção, extensão, contracção e flexão. E com a crescente estratégia “endovascular primeiro” (actualizar a directriz TASC II [14]), deve tentar-se deixar as possíveis zonas de bypass “desoneradas” nos segmentos de junção cruzada.
Embora os dados dos DEBs no primeiro e segundo anos [15] sejam claramente superiores ao PTA e pelo menos equivalentes ao DES [16], os dados fiáveis a longo prazo dificilmente estão disponíveis. Em 2015, os cinco resultados anuais do primeiro estudo DEB, Thunder, foram [17] que, utilizando uma pequena população de doentes (22 vs. 25 doentes no grupo DEB vs. PTA), mostrou uma taxa TLR significativamente mais baixa (21% vs. 56%, p<0,0005) e um intervalo mais longo para reintervenção (206 dias vs. 607 dias, p=0,04).
No Congresso VIVA 2016 (Vascular InterVentional Advances), foi apresentada a análise de três anos do estudo prospectivo, multicêntrico UE/EUA, 2:1 IN.PACT-SFA randomizado e mono-cego. Neste estudo, 330 pacientes (8% CLI) foram tratados com o DEB (IN.PACTTM Almirante, n=220) ou com a versão não revestida (n=110). O parâmetro de eficácia primária (PE) foi PP aos 12 meses, definido como a ausência de TLR clinicamente indicado e a reestenose determinada por ultra-sons. O PE de segurança primária é composto de ausência de morte relacionada com dispositivos e procedimentos no prazo de 30 dias, amputação da perna e TVR (Vessel) clinicamente indicado. O comprimento médio da lesão era de 9 cm em ambos os grupos. A superioridade da DEB sobre a PTA simples já observada em um e dois anos [1] continua consistentemente (PP 69,5% vs. 45,1%, ∆ +24,4%), p <0,001; TLR 16,2% vs. 34,0%; p <0,001). O grupo DEB foi também superior ao grupo simples PTA na sustentabilidade da melhoria clínica, definida como a ausência de amputação da perna, classificação TVR e Rutherford (68,7% vs. 52,6%, p <0,001). Não houve amputações em nenhum dos grupos.
Então porque não combinar o melhor dos dois mundos – “Não Deixar Nada Para Trás”?
Após os dados iniciais frustrantes de vários suportes vasculares não revestidos bioreabsorvíveis (andaimes, BVS) na área da artéria femoral superficial (AFS) em 2013 e 2014, a última geração mostra os primeiros sucessos (Fig. 1).
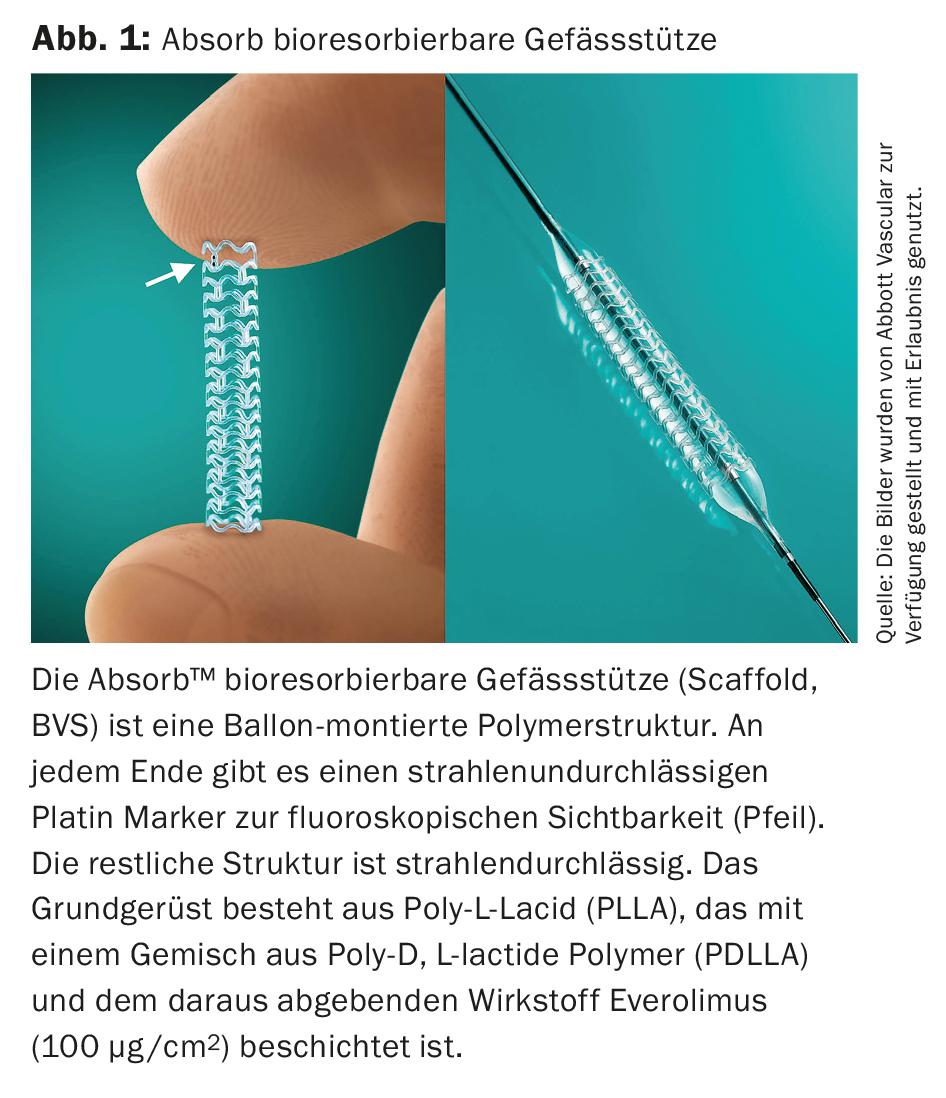
Este sistema BVS é baseado num andaime de poli-lactida (PLLA) revestido com uma mistura de polímero de poli-D, L-lactida (PDLLA) e a droga everolimus (100 µg/cm2) (ESPRIT™-BVS System, Abbott Vascular, (Fig. 2) . No estudo ESPRIT-I prospectivo, de um só braço e multicêntrico “first-in human” ESPRIT-I [19] Foram examinados 35 pacientes com PAVK sintomático e focais (média aproximada de 36 mm), pequenas lesões calcificadas (correspondentes à TASC A) na área da AFS (88,6%) e A. iliaca externa (11,4%). Após dois anos, não ocorreu qualquer amputação. A taxa de TLR era de 12,1% a um ano, e 16,1% a dois anos, com uma taxa de TLR clinicamente indicada de apenas 9%. A ABI aumentou de 0,75 antes do tratamento para 0,96 após dois anos. Durante este tempo, 71% de todos os pacientes permaneceram em grande parte livres de sintomas (Rutherford 0); a distância máxima a pé melhorou para cerca de 450 metros. Limitada pelo pequeno número de pacientes, a falta de um grupo de comparação directa e as lesões relativamente curtas e pouco calcificadas, a BVS terá de competir no futuro nas lesões TASC B&C e em comparação com as outras tecnologias DE.

No entanto, não é suficiente abrir mesmo oclusões femoro-poplíteas de longo alcance laboriosamente com vários instrumentos (Fig. 3) . Um problema maior é manter os recipientes reabertos durante um período de tempo mais longo. Infelizmente, para intervenções periféricas, não existem ensaios aleatórios para provar qual a terapia pós-intervencional provavelmente melhor para isso, pelo que temos de nos orientar por ensaios de cardiologia.
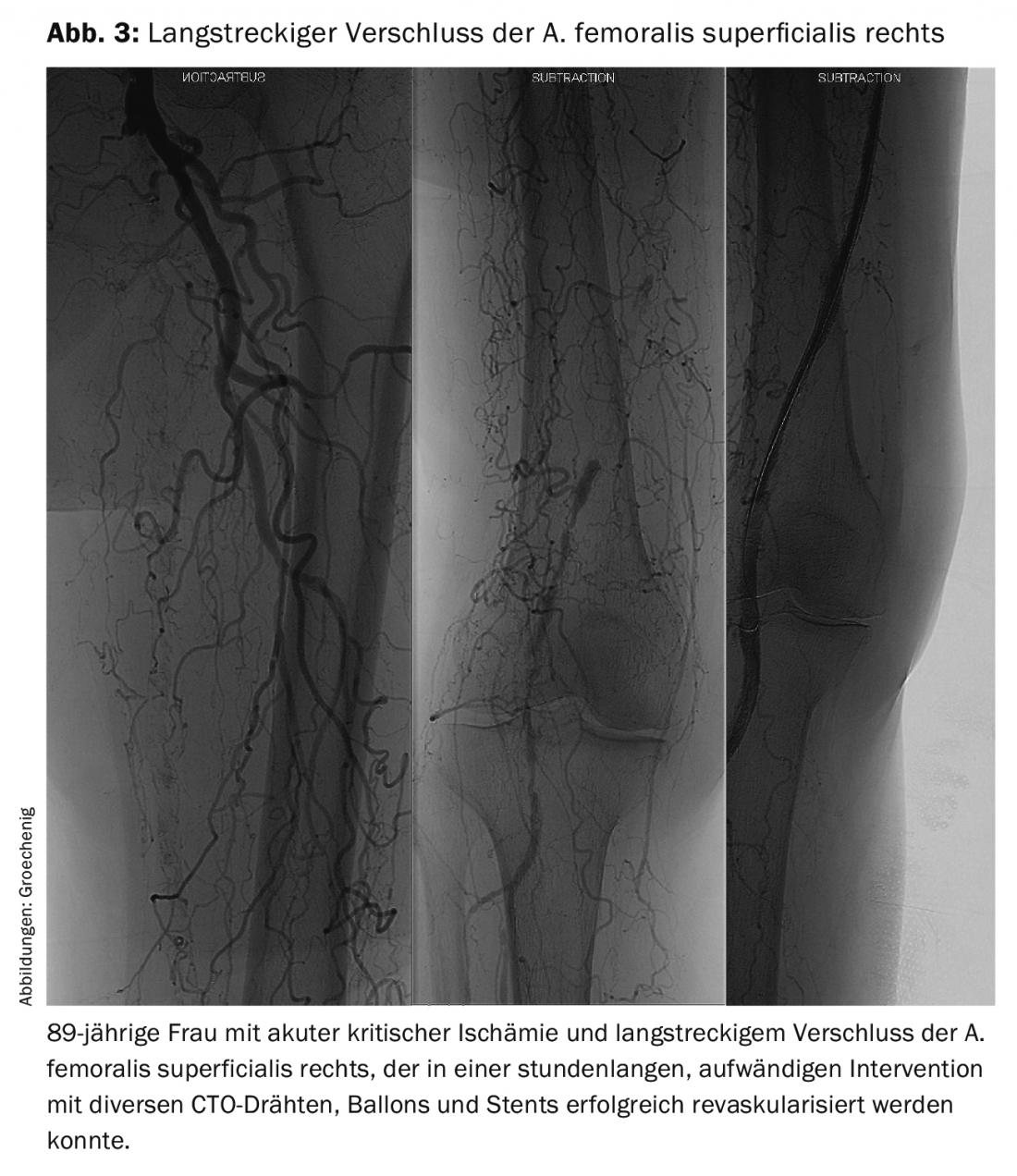
Os dispositivos implantados exercem um estímulo de crescimento constante sobre o endotélio, o que leva a recidivas frequentes. Contudo, também ocorre fadiga material, especialmente na secção femoro-poplítea, que é exposta a cargas extremas devido ao torque, compressão e flexão. Tais problemas são assintomáticos durante muito tempo e depois manifestam-se frequentemente como isquemia crítica aguda, necessitando de uma recanálise extensiva (Fig. 4).
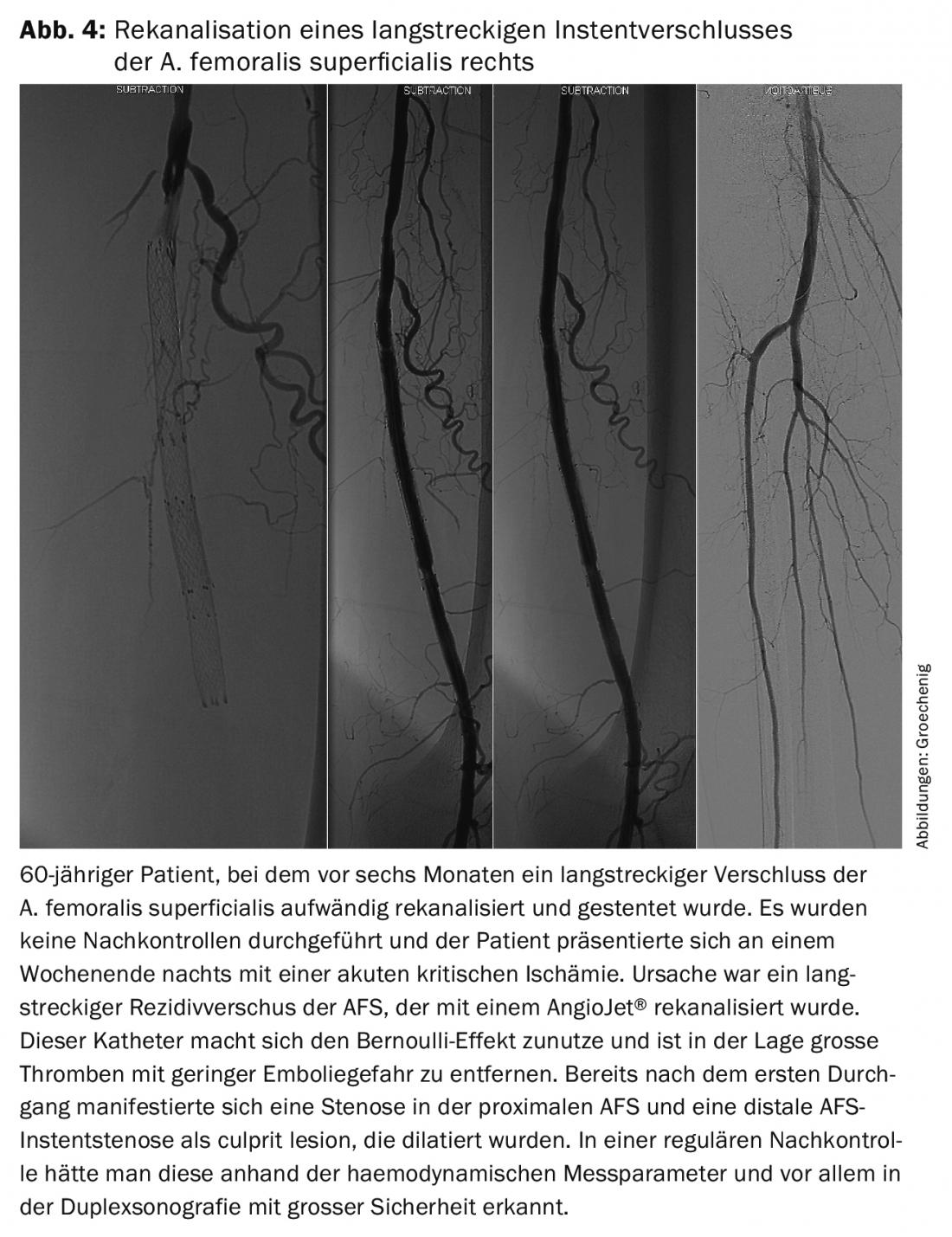
São necessários controlos regulares e de malha apertada para detectar tais problemas precocemente e alcançar uma longa taxa de abertura secundária, terciária, quaternária ou ainda mais frequente com uma intervenção electiva mais pequena, a fim de assegurar a qualidade de vida e a preservação das pernas durante o máximo de tempo possível.
Resumo
No doente sintomático, os procedimentos terapêuticos intervencionistas estão na vanguarda com um desenvolvimento técnico exponencial. A profilaxia secundária adequada e em conformidade com as directrizes deve ser uma questão natural. No entanto, isto só pode atrasar o curso da doença. Embora os stents tenham melhorado a taxa de abertura de oclusões recanalisadas, ainda têm uma elevada taxa de recorrência devido à estenose do stent ou à fadiga do material. Normalmente, as coisas movem-se muito rapidamente e os pacientes originalmente assintomáticos apresentam frequentemente isquemia crítica aguda.
Só um acompanhamento especializado regular e uma intervenção precoce podem prevenir tais catástrofes. Uma taxa aberta primária, secundária, terciária, quaternária, etc. pode ser alcançada. Desta forma, uma taxa aberta pode ser alcançada ao longo de muitos anos e assim garantir a qualidade de vida e a preservação dos membros. Na cirurgia de bypass isto foi estabelecido durante muito tempo, na angiologia intervencionista ainda temos de trabalhar nela.
Literatura:
- Fowkes GR, Rudan D, Ruda I, et al: Comparação das estimativas globais de prevalência e factores de risco de doenças das artérias periféricas em 2000 e 2010: uma revisão e análise sistemática. A Lanceta 2013; 382: 1329 – 1340.
- Diehm C, Darius H, Pittrow D, et al: Valor prognóstico de um baixo índice braquial pós-exercício do tornozelo, avaliado por médicos de cuidados primários. Aterosclerose 2011; 214: 364-372.
- Pilger E, Schulte KL, Diehm V, Groechenig R: arterielle Gefässerkrankungen, Standards in Klinik, Diagnostik und Therapie, Thieme Verlag 2002.
- Hirsch AT, Criqui MH, Treat-Jacobson D: O Programa PARCEIROS. Um levantamento nacional da prevalência de doenças arteriais periféricas, sensibilização e risco isquémico. JAMA 2012; 286: 1317-1324.
- Criqui MH, Langer RD, Fronek A, et al: Mortalidade durante um período de 10 anos em doentes com doença arterial periférica. N Engl J Med 1992, 326: 381-386.
- Marsico F, Ruggiero D, Parente A, et al: Prevalência e gravidade da doença coronária e arterial carotídea assintomática em doentes com doença arterial dos membros inferiores, Atherosclerose 2013; 228: 386-389.
- Lindström J, Ilanne-Parikka P, Petonen M, et al: Sustained reduction in the incidence of type 2 diabetes by lifestyle intervention: follow-up of the Finnish Diabetes Prevention Study, The Lancet 2006; 368: 1673-1679.
- Brinks R, Tamayo T, Kowall B, et al: Prevalência da diabetes tipo 2 na Alemanha em 2040: estimativas de um modelo epidemiológico, European Journal of Epidemiology 2012; 27: 791-797.
- American Diabetes Association: Peripheral arterial disease in people with diabetes: Consensus statement, Diabetes Care 2003; 26: 3333-3341.
- Reinecke H, Unrath M, Freisinger E, et al: Peripheral arterial disease and critical member ischaemia: still poor outcomes and lack of guideline adherence. Eur Heart J. 2015 Abr 14; 36(15): 932-8. doi: 10.1093/eurheartj/ehv006.
- O Comité de Direcção da TASC. Uma actualização dos métodos de revascularização e expansão da classificação da TASC para incluir as artérias abaixo do joelho: um suplemento ao Consenso Inter-Sociedade para a Gestão da Doença Arterial Periférica (TASC II). J Endovasc Ther. 2015; 22: 657-671.
- Dake MD, et al: Eficácia clínica durável com stents de eluição de paclitaxel na artéria femoropoplítea: resultados de 5 anos do ensaio aleatório de zilver ptx. Circulação. 2016; 133(15): 1472-83.
- Müller-Hülsbeck S: Resultados de 12 meses do ensaio MAJESTIC do Stent Eluvia Paclitaxel-Eluting para o Tratamento da Doença Femoropoplítea Obstrutiva. J Endovasc Ther. 2016; 23(5): 701-7.
- O Comité de Direcção da TASC. Uma actualização dos métodos de revascularização e expansão da classificação da TASC para incluir as artérias abaixo do joelho: um suplemento ao Consenso Inter-Sociedade para a Gestão da Doença Arterial Periférica (TASC II). J Endovasc Ther. 2015; 22: 657-671.
- Werner M: Angioplastia com balões revestidos de drogas para o tratamento da doença arterial periférica infrainguinal. Vasa. 2016; 45(5): 365-372.
- Zeller T, et al.: Balões revestidos com drogas vs. stents com eluição de drogas para tratamento de lesões femoropoplíteas longas. J Endovasc Ther. 2014; 21(3): 359-368).
- Tepe G: Angioplastia de artérias femorais-poplíteas com balões revestidos de drogas: seguimento de 5 anos do ensaio THUNDER. JACC Cardiovasc Interv. 2015; 8: 102-108).
- Laird JR, et al: Durabilidade do efeito de tratamento usando um balão revestido de drogas para lesões femoropoplíteas: resultados de 24 meses de IN.PACT SFA. J Am Coll Cardiol. 2015; 66(21): 2329-38.
- Lammer J, et al.: Bioresorbable everolism-eluting scaffold vascular para pacientes com doença arterial periférica (ESPRIT I). 2 anos de resultados clínicos e de imagem. Am Coll Cardiol Intv. 2016; 9(11): 1178-1187.
CARDIOVASC 2017; 16(1): 18-22