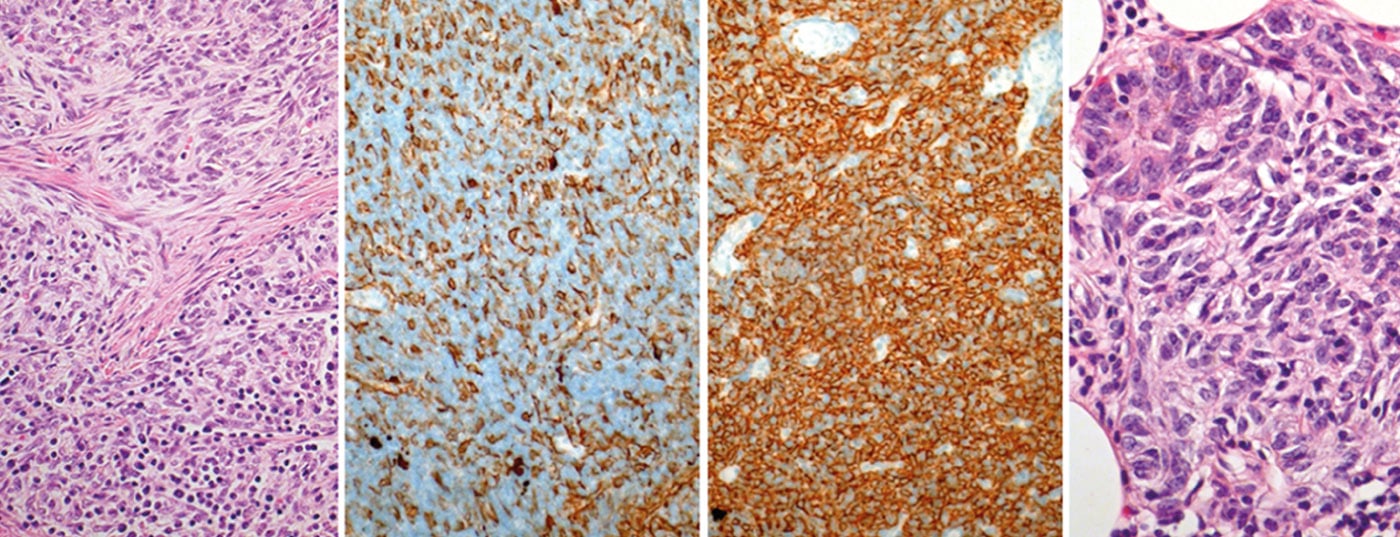
Os tumores tímicos são raros e pertencem aos chamados “tumores malignos órfãos”. A incidência anual é de cerca de 0,15 por 100.000 pessoas. A última classificação distingue três grandes grupos: Timosomas, carcinomas tímicos e tumores neuroendócrinos do timo. Devido à sua raridade, a maioria dos conhecimentos sobre diagnóstico e terapia provém de séries de casos e estudos monocêntricos. Foi apenas em 2010 que foi fundada uma sociedade internacional e interdisciplinar (International Thymic Malignancy Interest Group, ITMIG) para promover a colaboração mundial e iniciar a investigação clínica e científica básica sobre tumores tímicos.
Os tumores tímicos são raros: A sua incidência é de 0,15/100,000/ano [1]. Podem ocorrer em qualquer idade, mas mostram uma acumulação aos 30 – 40 anos de idade para timomas com miastenia gravis resp. manifesta. de 60-70 anos sem miastenia [2]. Mulheres e homens são afectados com a mesma frequência. Cerca de um terço dos pacientes com um timoma são assintomáticos, enquanto que cerca de dois terços dos pacientes com carcinoma tímico ou um tumor neuroendócrino do timo estão predominantemente presentes com sintomas locais.
Apresentação clínica
Os sintomas mais comuns, tais como dores no peito, tosse e falta de ar, são causados pelo crescimento local. No caso de tumores invasivos, pode também haver uma síndrome de veia cava superior ou paralisia do nervo frênico com elevação diafragmática ou rouquidão devido à constrição do nervo laríngeo recorrente. Além disso, os tumores tímicos são frequentemente associados a síndromes paraneoplásicas (Tab. 1).

Myasthenia gravis é de longe a síndrome paraneoplásica mais comum. As séries clínicas relatam que cerca de 30-50% de todos os doentes com timoma, especialmente o timoma do tipo B2, têm miastenia. Inversamente, um timoma pode ser detectado em 10-15% dos doentes com miastenia. Cerca de 5% dos doentes com miastenia associada à timoma têm outras síndromes paraneoplásicas, por exemplo tiroidite auto-imune, aplasia pura de glóbulos vermelhos, encefalopatia límbica, etc. A miastenia gravis é muito mais rara nos carcinomas tímicos – é observada quase exclusivamente nos carcinomas com um componente de timoma. Os tumores neuroendócrinos do timo estão ocasionalmente associados a endocrinopatias.
Diagnósticos
O diagnóstico de tumores tímicos baseia-se nas características clínicas, nas técnicas de imagem e no trabalho histopatológico de biópsias ou espécimes de biópsia. ressecções ou cortes congelados. A imagem centra-se na tomografia computorizada (CT) como modalidade de avaliação inicial e acompanhamento [3]. A RM pode ser utilizada para avaliar suspeitas de invasão do coração e de grandes vasos sanguíneos [4]. O PET permite comparar o diagnóstico suspeito de hiperplasia tímica com um timoma ou tumor tímico. de um tumor menos agressivo versus um tumor altamente agressivo. A confirmação histológica pré-operatória perdeu alguma da sua importância, uma vez que os métodos radiológicos mais recentes têm agora uma fiabilidade diagnóstica mais elevada e uma ressecção completa dos tumores correspondentes, independentemente da entidade exacta. Em geral, deve ser realizada uma biopsia se os achados radiológicos não forem claros e não se puder excluir a hipótese de linfoma, ou no caso de um achado não previsível antes de se iniciar a quimioterapia por indução ou a radio-quimioterapia definitiva [5].
Encenação e classificação histológica
O sistema de encenação mais utilizado para os timomas é a classificação Masoaka, que foi revista pela última vez em 1994 (Quadro 2) [6].

Nos próximos anos deverá ser estabelecido um sistema de encenação baseado em TNM. Havia diferentes classificações para a classificação histológica. Em 1999, a OMS introduziu uma classificação histológica baseada na morfologia e na relação entre linfócitos e células epiteliais. Esta classificação foi revista em 2004 (Tab. 3) .
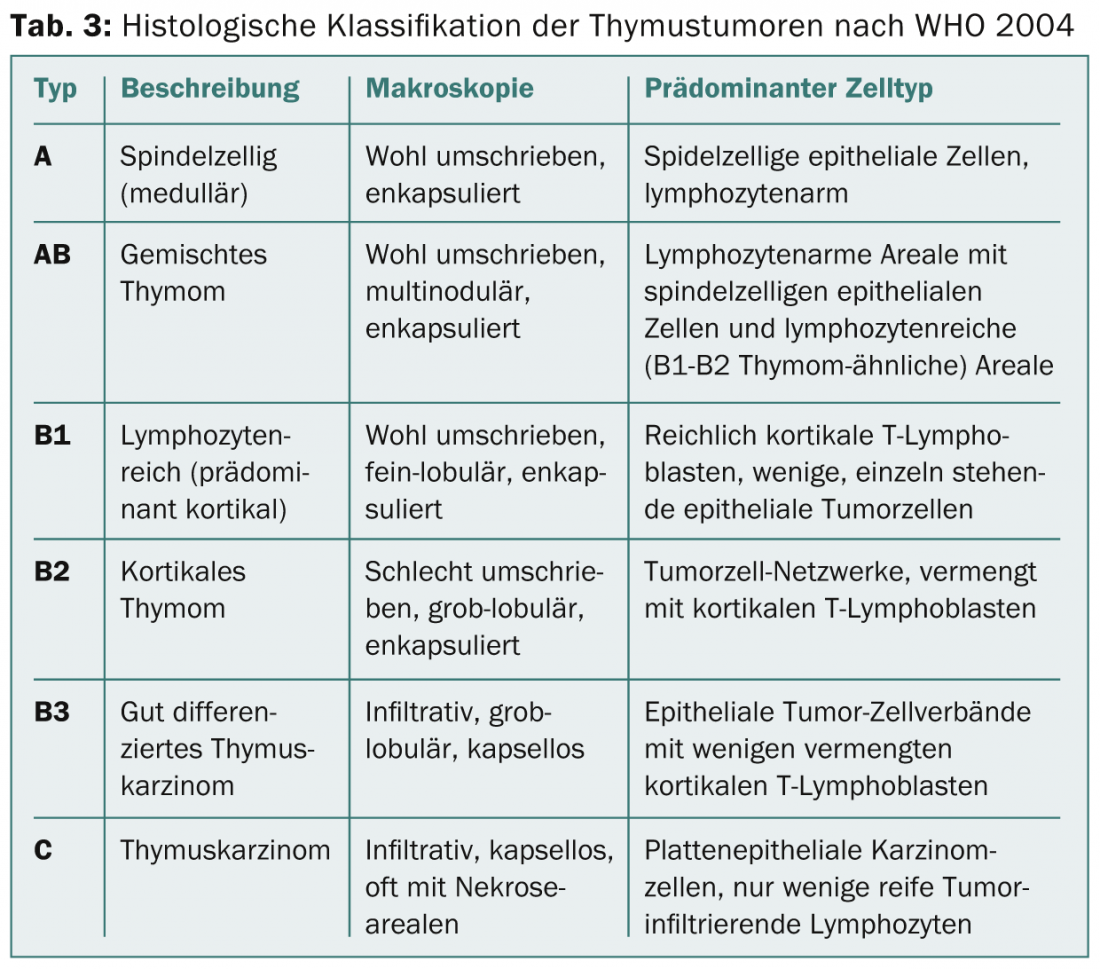
Por um lado, reflecte a biologia tumoral dos tumores tímicos (por exemplo, origem celular diferente, agressividade diferente, acumulação diferente de auto-imunidade paraneoplásica), mas também tem significado para as decisões terapêuticas (Fig. 1).
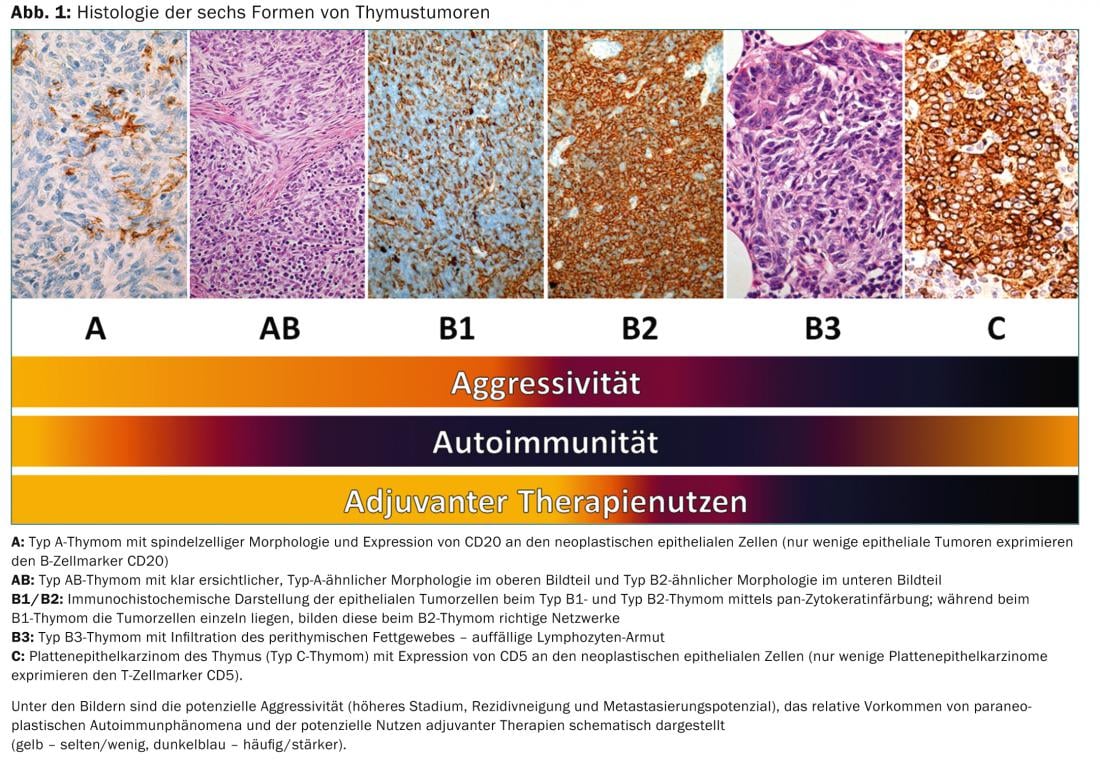
Terapia de tumores tímicos
Várias séries e estudos têm investigado potenciais factores prognósticos em tumores tímicos. Os únicos factores prognósticos validados para a sobrevivência e probabilidade de recorrência são (por ordem decrescente de importância) a fase de diagnóstico, a extensão da ressecção tumoral e o subtipo histológico [7,8].
Cirurgia
A ressecção cirúrgica é a pedra angular do tratamento, e a ressecção completa deve ser sempre direccionada para a ressecção. O International Thymic Malignancy Interest Group (ITMIG) recomenda a ressecção em bloco com remoção completa do timo e ressecção do tecido adiposo circundante devido a uma possível infiltração macroscópica invisível do tecido adiposo. A sobrevivência após dez anos depende do estádio e é de 90, 70, 55 e 35% para as fases I, II, III e IVa, respectivamente. As taxas de recorrência correspondentes após a ressecção completa são 3, 11, 30 e 43% [9].
Radioterapia
Os tumores tímicos tendem a repetir-se localmente, razão pela qual a radioterapia pós-operatória é importante. Para a irradiação, uma dose total de 50-54 Gy é destinada.
Recomenda-se doses mais elevadas (até 60 Gy) para uma ressecção incompleta. Não há benefício comprovado para a radioterapia nas fases I e II da masoaka [7,10]; isto também parece ser verdade para os subtipos histológicos A, AB e B1 [11]. No entanto, na fase II, a radioterapia pós-operatória é realizada em muitos centros, como mostra um inquérito recentemente publicado na Europa [12]. Na fase III, a radioterapia adjuvante foi estabelecida e é também recomendada nas directrizes internacionais, apesar de haver poucas provas de ensaios clínicos [7,13,14]. Para pacientes que estão inoperacionais principalmente ou após a quimioterapia por indução, a radioterapia definitiva é uma opção de tratamento, em que uma dose de até 70 Gy é visada. A taxa de resposta é de cerca de 70% e a probabilidade de ainda estar vivo após cinco anos é de 70-80%, o que é comparável à taxa de sobrevivência para uma ressecção incompleta [15,16].
Quimioterapia
A quimioterapia tem um lugar no tratamento primário, na situação de recaída e em metástases [17]. Para os tumores primários das fases III e IV não renováveis de acordo com Masoaka, a quimioterapia neoadjuvante ou a radio-quimioterapia combinada é a terapia de escolha. Globalmente, pode esperar-se uma taxa de resposta de cerca de 70% (29-100%). A ressecção subsequente é também completamente possível em cerca de 70% dos casos [2]. As quimioterapias combinadas foram investigadas em todos os estudos.
Na situação pós-operatória, o valor da quimioterapia é menos bem estabelecido. O controlo local de tumores é o objectivo terapêutico mais importante porque os timomas raramente metástases (10-15%). Portanto, a radioterapia pós-operatória ou, se necessário, a radio-quimioterapia combinada (para tumores não ressecáveis, pacientes inoperáveis ou para tumores ressecados incompletamente) tem prioridade apenas sobre a quimioterapia. Na situação metastática ou no caso de recidivas não renováveis e já irradiadas, a quimioterapia pode ser utilizada com intenção paliativa. São normalmente utilizadas quimioterapias combinadas com uma antraciclina e um derivado da platina, com taxas de resposta entre 50 e 90% [18]. Não existem terapias padrão comprovadas para tumores refractários da platina; várias monossubstâncias e combinações sem platina mostram taxas de resposta de 20-40% [19]. A terapia local (cirurgia / radioterapia) também é importante para o controlo dos sintomas em tumores localmente avançados ou na presença de metástases.
Terapias orientadas
Nos últimos anos, tal como com outros tumores sólidos, as terapias orientadas têm sido cada vez mais investigadas nos tumores tímicos [19]. A expressão elevada dos receptores de somatostatina é encontrada em cerca de metade dos tumores tímicos. Estes pacientes parecem beneficiar de uma terapia orientada com octreotídeo, com maior benefício nos timomas do que nos carcinomas tímicos.
A sobreexpressão da tirosina kinase c-KIT está presente em cerca de 2% dos timomas e 80% dos carcinomas tímicos. A activação de mutações, tais como as encontradas em tumores do estroma gastrointestinal (GIST), raramente ocorrem em tumores tímicos. A terapia com o inibidor multikinase imatinib (Glivec®), que é dirigida contra o c-KIT entre outros alvos, levou à estabilização da doença em tumores avançados, especialmente aqueles com mutações do c-KIT.
Em 70% dos timomas e cerca de 50% dos carcinomas tímicos, o receptor do factor de crescimento epitelial (EGFR) está sobreexpresso. No entanto, a activação de mutações, tal como ocorrem no adenocarcinoma do pulmão, são raras. A terapia com inibidores de tirosina quinase EGFR mostrou apenas um benefício modesto. O anticorpo EGFR cetuximab está actualmente a ser investigado num ensaio clínico.
Tal como com outros tumores, a neoangiogénese também desempenha um papel nos tumores tímicos. As substâncias anti-angiogénicas (bevacizumab, sunitinib) foram capazes de induzir uma resposta tumoral em pequenos estudos. O receptor do factor de crescimento do tipo insulina 1 (IGFR-1) é sobreexpresso em cerca de 20% dos tumores tímicos. A terapia com o anticorpo IGFR-1 cixutumumab levou a uma elevada taxa de estabilização da doença.
Mensagens Take-home-messages
- Os tumores tímicos são doenças raras do mediastino anterior e estão divididos em timomas com diferentes subgrupos histológicos, carcinomas tímicos e tumores neuroendócrinos do timo.
- Os timomas estão frequentemente associados a síndromes paraneoplásicas, incluindo mais frequentemente a miastenia gravis, enquanto que os carcinomas tímicos e os tumores neuroendócrinos do timo são mais frequentemente manifestados por sintomas locais.
- A base do tratamento é a ressecção cirúrgica completa; dependendo da fase e possivelmente do subtipo, a radioterapia pós-operatória pode ser avaliada.
- A quimioterapia é utilizada para tumores localmente avançados (se necessário em combinação com radiação) como terapia de indução antes da cirurgia planeada.
- No caso de tumores inoperáveis ou de recidivas locais, é administrada radio-quimioterapia.
- Em tumores metastáticos, a combinação de quimioterapia com uma antraciclina e uma substância contendo platina pode levar a uma alta taxa de resposta.
- No futuro, a melhor compreensão biológica molecular dos tumores tímicos permitirá uma terapia orientada para certos subgrupos.
Literatura:
- Engels EA, Pfeiffer RM: timoma maligno nos Estados Unidos: padrões demográficos na incidência e associações com malignidades subsequentes. Int J Cancer 2003; 105(4): 546-551. doi:10.1002/ijc.11099.
- Venuta F, et al:Thymoma e carcinoma tímico.Eur J Cardiothorac Surg 2010; 37(1): 13-25. doi:10.1016/j.ejcts.2009.05.038.
- Marom EM: Avanços na imagem do timoma. J Thorac Imaging 2013; 28(2): 69-80. quiz 81-83. doi:10.1097/RTI.0b013e31828609a0.
- Sadohara J, et al.: Thymic epithelial tumores: comparação dos resultados das imagens de TC e RM de timomas de baixo risco, timomas de alto risco, e carcinomas tímicos. Eur J Radiol 2006; 60(1): 70-79. doi:10.1016/j.ejrad.2006.05.003.
- Detterbeck FC, Parsons AM: Tumores tímicos. Ann Thorac Surg 2004; 77(5): 1860-1869. doi:10.1016/j.athoracsur.2003.10.001.
- Koga K, et al: Uma revisão de 79 timomas: modificação do sistema de encenação e reavaliação da divisão convencional em timoma invasivo e não invasivo. Pathol Int 1994; 44(5): 359-367. www.ncbi.nlm.nih.gov/pubmed/8044305. Acesso em 2 de Dezembro de 2014.
- Kondo K, Monden Y: Terapia para tumores epiteliais tímicos: um estudo clínico de 1.320 pacientes do Japão. Ann Thorac Surg 2003; 76(3): 878-884; discussão 884-885. www.ncbi.nlm.nih.gov/pubmed/12963221. Acedido a 2 de Dezembro de 2014.
- Ströbel P, et al.: Recidiva tumoral e sobrevivência em doentes tratados por timomas e carcinomas tímicos de células escamosas: uma análise retrospectiva. J Clin Oncol 2004; 22(8): 1501-1509. doi:10.1200/JCO.2004.10.113.
- Koppitz H, et al: Classificação de última geração e tratamento multimodal do timoma maligno. Cancer Treat Rev 2012; 38(5): 540-548. doi:10.1016/j.ctrv.2011.11.010.
- Ruffini E, et al: Recurrence of thymoma: análise das características clinicopatológicas, tratamento, e resultado. J Thorac Cardiovasc Surg 1997; 113(1): 55-63. www.ncbi.nlm.nih.gov/pubmed/9011702. Acesso em 2 de Dezembro de 2014.
- Chen G, et al: A nova classificação histológica da OMS prevê o prognóstico de tumores epiteliais tímicos: um estudo clinicopatológico de 200 casos de timoma da China. Cancro 2002; 95(2): 420-429. doi:10.1002/cncr.10665.
- Ruffini E, et al: Gestão de tumores tímicos: um levantamento da prática actual entre os membros da Sociedade Europeia de Cirurgiões Torácicos. J Thorac Oncol 2011; 6(3): 614-623. doi:10.1097/JTO.0b013e318207cd74.
- Korst RJ, et al: Radioterapia adjuvante para tumores epiteliais tímicos: uma revisão sistemática e meta-análise. Ann Thorac Surg 2009; 87(5): 1641-1647. doi:10.1016/j.athoracsur.2008.11.022.
- Forquer JA, et al.: Radioterapia pós-operatória após ressecção cirúrgica do timoma: papéis diferentes na doença localizada e regional. Int J Radiat Oncol Biol Phys 2010; 76(2): 440-445. doi:10.1016/j.ijrobp.2009.02.016.
- Loehrer PJ, et al: Cisplatina, doxorubicina, e ciclofosfamida mais terapia de radiação torácica para o timoma inconectável em fase limitada: um ensaio intergrupal. J Clin Oncol 1997; 15(9): 3093-3099. www.ncbi.nlm.nih.gov/pubmed/9294472. Acesso em 2 de Dezembro de 2014.
- Girard N, Mornex F: O papel da radioterapia na gestão de tumores tímicos. Thorac Surg Clin 2011; 21(1): 99-105, vii. doi:10.1016/j.thorsurg.2010.08.011.
- Girard N, et al: Definições e políticas de quimioterapia para os malignos tímicos. J Thorac Oncol 2011; 6(7 Suppl 3): S1749–1755. doi:10.1097/JTO.0b013e31821ea5f7.
- Girard N: Thymoma: da quimioterapia à terapia orientada. Am Soc Clin Oncol Educ Book 2012: 475-479. doi:10.14694/EdBook_AM.2012.32.475.
- Berardi R, et al: Thymic neoplasms: uma actualização sobre o uso da quimioterapia e novas terapias orientadas. Uma revisão bibliográfica. Cancer Treat Rev 2014; 40(4): 495-506. doi:10.1016/j.ctrv.2013.11.003.
InFo ONCOLOGy & HEMATOLOGy 2015; 3(2): 16-20