O padrão para um glioblastoma recentemente diagnosticado é uma ressecção tão completa quanto possível. A isto segue-se a radiochemoterapia à base de temozolomida. Uma das abordagens terapêuticas mais recentes é a utilização de campos de terapia tumoral.
Os glioblastomas são os tumores primários malignos mais comuns em adultos e podem basicamente ocorrer em qualquer idade. A incidência aumenta com a idade e a idade média de início é de 64 anos. Os homens são afectados ligeiramente mais frequentemente do que as mulheres [1]. A sobrevida média dos pacientes com um glioblastoma recentemente diagnosticado é de apenas cerca de 16 meses, mesmo em ensaios clínicos, e é significativamente mais curta em estudos baseados na população.
Em contraste com o único progresso terapêutico relativamente menor, a compreensão da base biológica molecular dos glioblastomas expandiu-se consideravelmente nos últimos dez anos. Segundo a classificação da OMS revista em 2016, os glioblastomas que surgem de novo não têm uma mutação num dos dois genes da isocitrato desidrogenase (IDH). Este grupo é responsável por cerca de 90% de todos os glioblastomas. Em contraste, os glioblastomas muito mais raros que surgem de um tumor de baixo grau têm geralmente uma mutação IDH e têm um melhor prognóstico. Consequentemente, estes tumores são relatados separadamente na nova classificação da OMS [2]. A O6-metilguanina-DNA metiltransferase (MGMT) estabeleceu-se como um importante biomarcador. É uma proteína de reparação de DNA que inverte as alquilações na posição O6 da guanina. A metilação do promotor do MGMT encontra-se em cerca de um terço dos glioblastomas. O resultado da metilação é uma expressão de MGMT ausente ou reduzida, o que leva a uma sensibilidade das células à quimioterapia alquilante.
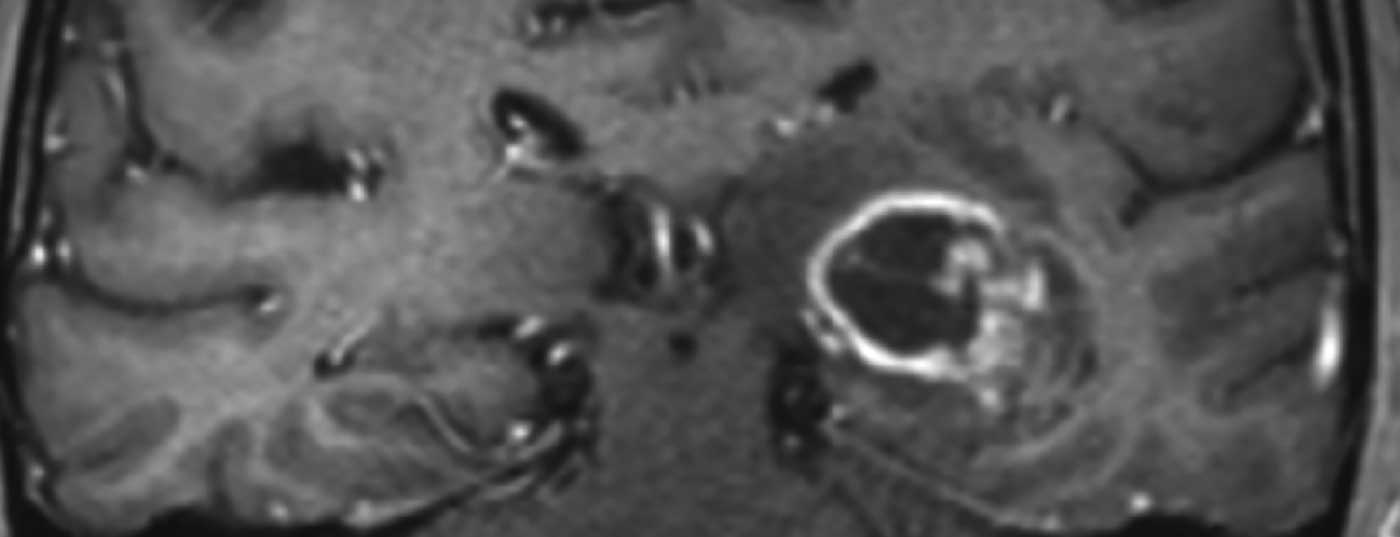
Os glioblastomas manifestam-se através de diferentes sintomas clínicos, que dependem principalmente da localização do tumor no cérebro. Além das mudanças de personalidade, dores de cabeça, náuseas e vómitos no sentido de sintomas de pressão intracraniana ou défices neurológicos focais, uma convulsão epiléptica leva frequentemente a uma clarificação diagnóstica. A ressonância magnética craniana mostra tipicamente uma lesão marginalmente absorvente de contraste com necrose central (Fig. 1). Se houver uma suspeita de glioblastoma ou outro tumor cerebral na imagiologia, deve ser normalmente procurado um diagnóstico histológico.
Terapia
Para além da obtenção de tecido, o objectivo do procedimento cirúrgico é conseguir a máxima ressecção possível que pode ser realizada sem causar novos défices neurológicos. Os tumores para os quais a ressecção completa não é possível devido à localização no cérebro devem ser apenas biopsiados. O mesmo se aplica a pacientes em estado geral reduzido que podem não ser capazes de suportar as tensões de uma cirurgia extensa. A utilização de ácido 5-aminolevulínico e de imagens intra-operatórias pode melhorar a extensão da ressecção. Isto leva a um prolongamento da sobrevivência sem progressão [3,4].
Desde 2005, a radioterapia com terapia concomitante com temozolomida seguida de terapia de manutenção com temozolomida até seis ciclos (TMZ/RT -> TMZ) tem sido a terapia padrão para pacientes com glioblastoma recentemente diagnosticado. A radiochemoterapia é superior apenas à radioterapia [5]. Temozolomida é um alquilano que pode ser administrado por via oral e tem um perfil geral de efeito secundário favorável. Os efeitos secundários mais comuns incluem fadiga e náuseas, bem como mielossupressão, alguns dos quais requerem ajuste de dose.
Várias tentativas de suplementar a radiochemoterapia baseada em temozolomida com outras substâncias não conduziram a tempos de sobrevivência prolongados. Isto aplica-se em particular ao anticorpo bevacizumab, que é dirigido contra o factor de crescimento endotelial vascular (VEGF). A adição de bevacizumab à terapia padrão resultou num prolongamento da sobrevivência sem progressão em doentes com glioblastoma recentemente diagnosticado, mas não num prolongamento da sobrevivência global [6,7]. A vacina peptídeo rindopepimut, que visa a variante mutante vIII do “receptor do factor de crescimento epidérmico” (EGFRvIII), também foi investigada num ensaio aleatório em doentes com glioblastoma EGFRvIII-positivo, recentemente diagnosticado. No entanto, não foi encontrada nenhuma vantagem de sobrevivência em comparação com uma vacina placebo [8].
Em contraste com os medicamentos acima mencionados, uma nova abordagem de tratamento com os chamados campos de tratamento de tumores demonstrou prolongar a sobrevivência [9]. Aqui, um campo eléctrico é gerado através de eléctrodos a serem aplicados no crânio, o que deve levar a uma inibição da proliferação de células tumorais. O tratamento com campos de terapia de tumores é, para além da terapia de manutenção com temozolomida. O ideal é que o dispositivo seja usado pelo menos 18 horas por dia. Os efeitos secundários mais comuns incluem a irritação da pele provocada pelos eléctrodos adesivos. Resta saber quantos pacientes irão optar por tal tratamento para além da quimioterapia no futuro. Além disso, a questão do reembolso pelos transportadores de seguros ainda não é actualmente clara na maioria dos países.
A terapia de doentes com glioblastoma mais idosos representa um desafio especial. Entretanto, um estudo randomizado mostrou que a combinação de radioterapia e quimioterapia temozolomida é também superior à radioterapia apenas nestes pacientes. No entanto, a temozolomida apenas conduz a uma vantagem relevante de sobrevivência em doentes com um tumor metilado de MGMT [10]. Assim, só a radioterapia pode ser considerada, particularmente em doentes com mais de 70 anos de idade com um tumor MGMT-unmethylated. Os pacientes com tumores metilados MGMT em que a radiochemoterapia combinada não é indicada, por exemplo, devido a um estado geral reduzido, podem receber monoterapia com temozolomida [11]. Especialmente em pacientes mais velhos em estado geral reduzido, um conceito de terapia paliativa-suportadora deve ser avaliado numa fase precoce, devido ao prognóstico muito desfavorável.
Perspectivas
Actualmente, o foco de interesse científico está principalmente nas abordagens de tratamento imunoterapêutico [12]. Para além dos conceitos avançados de vacinação, estão a ser investigados em particular os inibidores da via de sinalização da “morte celular programada” (PD)-1. O inibidor PD1 nivolumab está actualmente a ser utilizado em duas experiências aleatórias de fase III. O ensaio Checkmate 498 está a comparar a combinação de radioterapia e nivolumab com terapia padrão (TMZ/RT -> TMZ) em doentes com glioblastoma MGMT-unmethylated. O ensaio Checkmate 548 de recrutamento paralelo está a comparar a adição de nivolumab ou placebo à TMZ/RT -> TMZ em doentes com glioblastoma recém-diagnosticado em que o tumor tem metilação do promotor da MGMT. Os resultados deste e de outros estudos mostrarão se as abordagens imunoterapêuticas podem contribuir para um melhor prognóstico em doentes com glioblastoma.
Mensagens Take-Home
- A terapia padrão para um glioblastoma recentemente diagnosticado consiste na ressecção tão completa quanto possível, seguida de radiochemoterapia à base de temozolomida.
- A adição de bevacizumab à terapia padrão não prolonga a sobrevivência em doentes com glioblastoma.
- Um estudo da fase III, que foi avaliado como positivo, mostrou uma extensão da sobrevivência em vários meses através do uso de campos de terapia tumoral.
- Os estudos actualmente em curso estão a investigar várias abordagens de tratamento imunoterapêutico, em particular.
Literatura:
- Ostrom QT, et al: relatório estatístico CBTRUS: tumores primários do cérebro e outros tumores do sistema nervoso central diagnosticados nos Estados Unidos em 2009-2013. Neuro Oncol 2016; 18(Suppl 5): v1-v75.
- Louis DN, et al: The 2016 World Health Organization Classification of Tumours of the Central Nervous System: a summary. Acta Neuropathol 2016; 131(6): 803-820.
- Stummer W, et al: Cirurgia guiada por fluorescência com ácido 5-aminolevulínico para ressecção de glioma maligno: um ensaio aleatório controlado multicêntrico fase III. Lancet Oncol 2006; 7(5): 392-401.
- Senft C, et al: Orientação intra-operatória da ressonância magnética e extensão da ressecção em cirurgia de glioma: um ensaio aleatório e controlado. Lancet Oncol 2011; 12(11): 997-1003.
- Stupp R, et al: Radioterapia mais concomitante e temozolomida adjuvante para glioblastoma. N Engl J Med 2005; 352(10): 987-996.
- Chinot OL, et al: Bevacizumab plus radiotherapy-temozolomide para glioblastoma recém-diagnosticado. N Engl J Med 2014; 370(8): 709-722.
- Gilbert MR, et al: Um ensaio aleatório de bevacizumab para glioblastoma recém-diagnosticado. N Engl J Med 2014; 370(8): 699-708.
- Weller M, et al: Rindopepimut com temozolomida para pacientes com glioblastoma recentemente diagnosticado, EGFRvIII-expressing glioblastoma (ACT IV): um ensaio aleatório, duplo-cego, internacional fase 3. Lancet Oncol 2017; 18(10): 1373-1385.
- Stupp R, et al: Maintenance Therapy With Tumour-Treating Fields Plus Temozolomide vs Temozolomide Alone for Glioblastoma: A Randomized Clinical Trial. JAMA 2015; 314(23): 2535-2543.
- Perry JR, et al: Radiação de curta duração mais temozolomida em doentes idosos com glioblastoma. N Engl J Med 2017; 376(11): 1027-1037.
- Weller M, et al: European Association for Neuro-Oncology (EANO) guideeline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas. Lancet Oncol 2017; 18(6): e315-e329.
- Weiss T, Weller M, Roth P: Imunoterapia para o glioblastoma: conceitos e desafios. Curr Opinião Neurol 2015; 28(6): 639-646.
InFo ONCOLOGy & HEMATOLOGy 2017; 5(6): 16-18