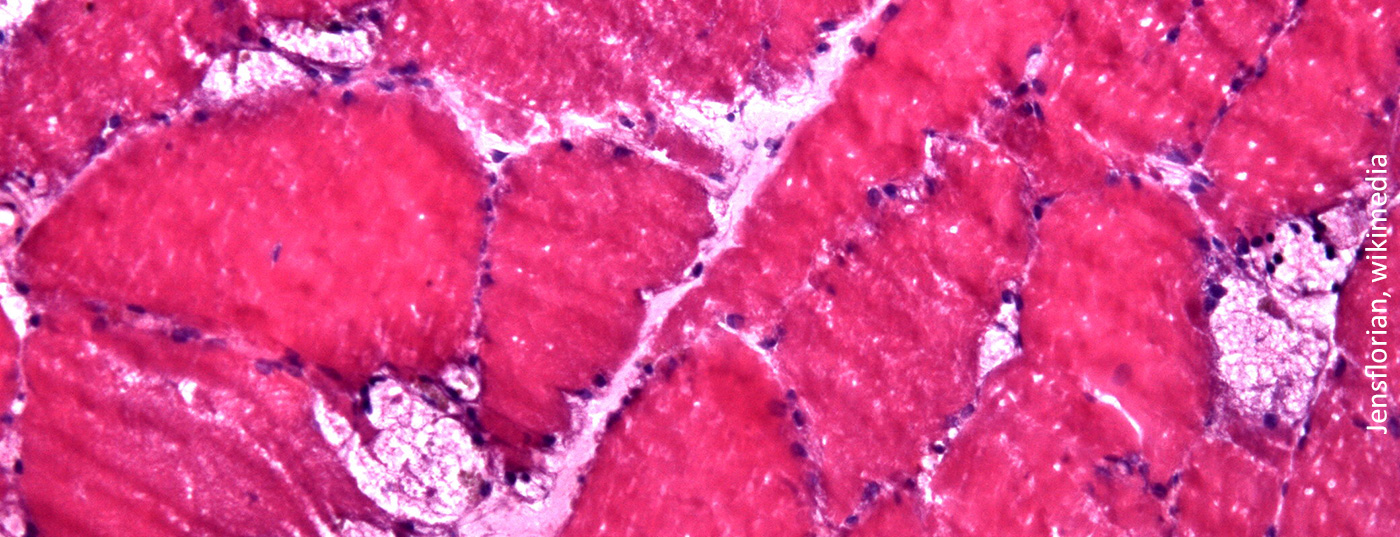
Novos dados do rótulo aberto, extensão a longo prazo do ensaio COMET fase 3 duplo-cego aleatorizado, mostram que as pessoas com doença de Pompe em fase terminal (LOPD) mantiveram melhorias na função respiratória e mobilidade após quase dois anos de tratamento com alfa avalglucosidase. A análise foi apresentada no 18º WORLDSymposium anual.
Avalglucosidase alfa (AVA; Nexviazyme®) é um desenvolvimento adicional da terapia de substituição enzimática com alglucosidase alfa (AL; Myozyme®), que pode retardar a progressão da doença de Pompe. Os resultados do estudo comparativo da fase 3 COMET mostram que a enzima recombinante AVA tem uma ligação qualitativamente melhor ao receptor de manose-6-fosfato do que a AL, o que leva a uma melhor absorção nas células alvo.
Os resultados de eficácia e segurança a longo prazo foram estudados em doentes que tinham recebido tratamento contínuo com AVA (20 mg/kg). Além disso, foram incluídos na análise pacientes que foram tratados com AVA durante pelo menos 48 semanas após terem sido trocados de tratamento anterior com AL (20 mg/kg). Durante as 97 semanas, houve um efeito de tratamento sustentado sob AVA, bem como a estabilização do efeito do tratamento em pacientes trocados de AL, em termos de função respiratória medida pela capacidade vital forçada (CVF) na posição vertical em comparação com a linha de base, e mobilidade medida pelo teste de caminhada de seis minutos (6MWT) em comparação com a linha de base.
Resultados do estudo de extensão a longo prazo COMET fase 3
O tratamento com AVA resultou numa melhoria de 2,65 (1,05) pontos na percentagem de prognóstico de CVF a partir da linha de base, tanto na análise primária como na fase de extensão. Os pacientes tratados com AVA apenas durante o período de extensão mostraram uma melhoria de 0,36 (1,12) pontos em comparação com a linha de base. Nos doentes tratados com AVA durante a análise primária e o período de extensão, a distância percorrida a pé medida com o TC6MW aumentou em média 18,6 (12,01) metros em comparação com a linha de base. Nos doentes tratados com AVA apenas durante o período de extensão, a distância média a pé aumentou 4,56 (12,44) metros da linha de base.
O perfil de segurança era comparável entre os dois braços de tratamento durante o tratamento com AVA. Não foram observados novos sinais de segurança em pacientes que mudaram de AL para AVA durante o período de extensão. Em ambos os grupos, cinco pessoas interromperam o tratamento durante o período de extensão devido a eventos adversos tais como hiperaemia ocular, eritema, urticária, dispneia, enfarte agudo do miocárdio ou adenocarcinoma do pâncreas. Seis participantes sofreram efeitos secundários graves relacionados com o tratamento, possivelmente relacionados com a terapia.
Resultados da extensão a longo prazo do estudo da fase 2 Mini-COMET
Os resultados da fase de extensão do estudo da fase 2 mini-COMET também foram apresentados no WORLDSymposium. O estudo aberto, em doses crescentes e de três breves doses, avaliou a segurança e eficácia da AVA em doentes com menos de 18 anos de idade com doença de Pompe Infantil (OIDP) (uma aplicação ainda em investigação nos EUA) que anteriormente receberam AL durante seis ou mais meses e mostraram ou uma resposta subótima ou um agravamento clínico.
Os pacientes foram inscritos em uma das três coortes: (1) 20 mg/kg AVA cada quinzena (n=6), (2) 40 mg/kg AVA cada quinzena (n=5), e (3) aleatorizado para AVA 40 mg/kg cada quinzena (n=5) ou AL na sua dose estável antes da inclusão na coorte (variando de 20 mg/kg cada quinzena a 40 mg/kg semanalmente n=6). Além disso, todos os 22 participantes participaram numa fase de extensão e receberam até 40 mg/kg de AVA a cada quinzena.
Os eventos adversos relacionados com o tratamento mais frequentemente notificados foram de gravidade ligeira a moderada e incluíram erupções cutâneas (8 participantes), quedas, pneumonia, pirexia (7 cada participantes), dores de cabeça, infecção do tracto respiratório superior (6 cada) e vómitos (5 participantes). Não se registaram efeitos secundários ou mortes graves ou graves relacionados com o tratamento. Na dose mais elevada de AVA (40 mg/kg cada quinzena), não foi observado qualquer risco de segurança acrescido nos participantes que mudaram de AL para AVA.
Na semana 97, os resultados mostraram que os pacientes tratados com AVA tinham uma função motora estável ou melhorada conforme medida pela Medida de Função Motora (GMFM-88), a pontuação total percentual do Teste de Função Motora Rápida (QMFT) e a Escala de Avaliação Pediátrica do Índice de Deficiência (Pompe-PEDI) de Competências Funcionais. Além disso, o Z-score do ventrículo esquerdo (LVMZ) estava no intervalo normal em todos os participantes.
Fonte: “Nexviazyme® (avalglucosidase alfa) mostra melhorias sustentadas na função respiratória e mobilidade em doentes com doença de Pompe” 08.02.2022, Sanofi
PRÁTICA DO GP 2022; 17(6): 45