A exposição ao amianto até 1990 está a ter o seu preço – entre outras coisas através do número ainda crescente de mesoteliomas pleurais malignos na Suíça. A esperança de vida das pessoas afectadas é extremamente baixa, cerca de doze meses, e não existe um procedimento de rastreio adequado. No entanto, com a recente aprovação da primeira opção imunoterapêutica para esta doença, há alguma esperança.
O principal factor de risco é claro: a exposição ao amianto. Contudo, embora a importação e o processamento de amianto tenham sido proibidos na Suíça desde 1 de Março de 1990, o número de casos de mesotelioma pleural maligno continua a aumentar [1,2]. Devido ao período de latência de 20 a 55 anos, não se espera um máximo de novos casos até 2030 [1]. Actualmente, cerca de 200 doenças são diagnosticadas na Suíça todos os anos. Os homens são afectados em 85% dos casos, na sua maioria com mais de 60 anos de idade [3]. Infelizmente, o prognóstico é extremamente desfavorável com um tempo médio de sobrevivência inferior a um ano [4]. Após décadas de cirurgia e quimioterapia, bem como de radioterapia, se necessário, formando a espinha dorsal da terapia, os medicamentos oncológicos modernos entraram recentemente em acção pela primeira vez com a aprovação da dupla imunoterapia usando ipilimumab/nivolumab – esperemos que como um sinal de partida para novas melhorias terapêuticas no futuro.
O amianto como culpado
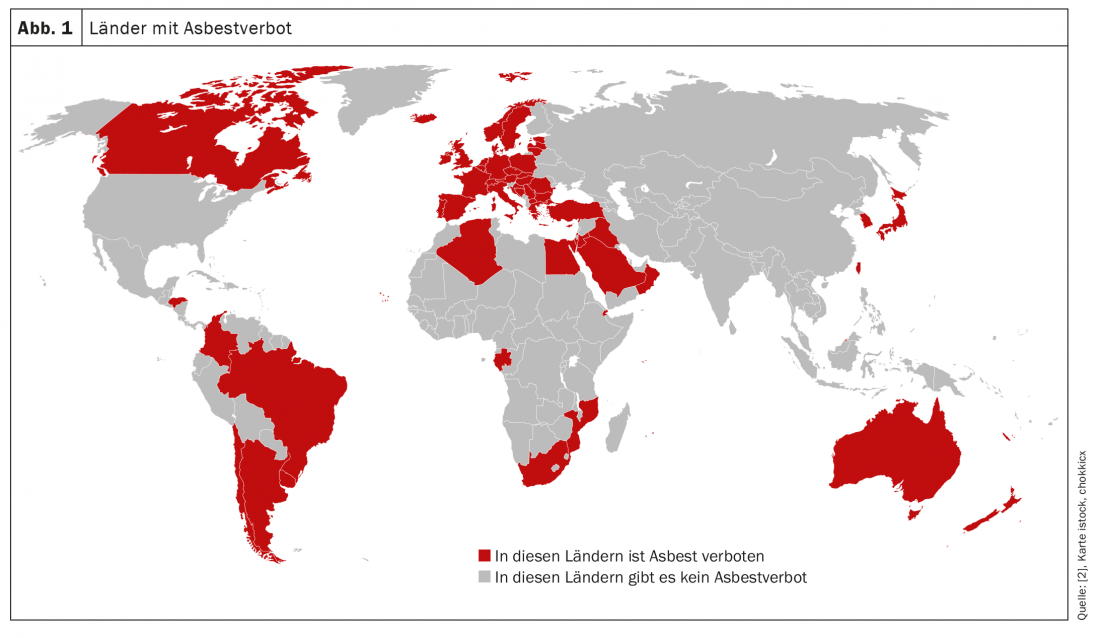
Em 70-90% das pessoas afectadas, o mesotelioma pleural maligno é atribuído à exposição anterior ao amianto [1]. O amianto entra nos pulmões como pó; as fibras mortais são produzidas através do processamento do material. Uma vez inaladas, as fibras de amianto são depositadas nas vias respiratórias e, devido à sua dimensão crítica, não podem ser decompostas nem excretadas. A forma de agulha das fibras permite-lhes migrar para a pleura e até atravessar para o espaço pleural. O resultado: fibrose e, a longo prazo, cancro, sendo as sequelas neoplásicas mais comuns relacionadas com o amianto [5]. Quanto maior for a dose cumulativa, maior é o risco de doença [6]. Mas nem todo o amianto é o mesmo. Por exemplo, o amianto branco (crisótilo) mais utilizado é considerado menos prejudicial do que outros tipos de amianto, como o amianto azul (crocidolite). Em geral, o material de construção ainda utilizado em grandes partes do mundo – o amianto só foi proibido até agora em 67 países (Fig. 1) [2] – é um grupo de minerais inorgânicos cristalinos naturais, os chamados silicatos. Com excelente resistência ao calor e melhores propriedades isolantes [5].
O mesotelioma pleural maligno após exposição profissional ao amianto é considerado uma doença profissional e está, portanto, coberto por um seguro obrigatório de acidentes na Suíça. No entanto, uma vez que a exposição data frequentemente de há várias décadas, nem sempre é fácil chegar a um acordo com ela. Aqueles que tiveram contacto não profissional com o material estão menos seguros financeiramente. Entretanto, os serviços de apoio às pessoas afectadas estão cada vez mais disponíveis, tais como a Fundação para o Fundo de Indemnização das Vítimas do Amianto (EFA) [7].
O papel dos genes
Para além da exposição ao amianto, várias alterações genéticas foram também identificadas nos últimos anos como factores de risco para o desenvolvimento de mesoteliomas pleurais malignos, sobretudo mutações BAP1 (proteína associada a BRCA-1 1), tanto ao nível da proteína como do ADN. Estes são frequentemente observados em famílias com uma incidência superior à média, em doentes jovens e na presença de segundos tumores [6,8]. Globalmente, as mutações BAP1 estão presentes em cerca de dois terços dos mesoteliomas esporádicos [9]. Certas regiões da Turquia, que estão altamente contaminadas com a erionite natural da fibra de amianto, parecem ser particularmente afectadas. Devido a esta ocorrência, bem como às mutações hereditárias do BAP1, até 50% das pessoas morrem de mesotelioma em algumas áreas [9]. A inactivação de mutações de genes supressores de tumores como CDKN2A, LATS-1 ou NF2 também pode promover mesotelioma pleural maligno [9].
Apresentação clínica e diagnósticos
Devido a sintomas não específicos e na sua maioria tardios, a doença só é frequentemente descoberta em fases avançadas. Para além da dispneia, tosse e dores torácicas, a perda de peso é mais comum. As efusões pleurais recorrentes ocorrem em cerca de um terço dos doentes. Mais tarde, hemoptise, disfagia, rouquidão e síndrome de Horners também não são incomuns [10]. Especialmente em casos de derrames pleurais unilaterais ou espessamento pleural, a doença do mesotelioma deve ser considerada [11].
Em primeiro lugar e acima de tudo no diagnóstico está a questão da possível exposição ao amianto no passado. A história da família também desempenha um papel importante. Se a exposição ao amianto permanecer inexplicada, as fibras de amianto podem ser detectadas por microscopia electrónica. No entanto, isto não confirma o diagnóstico de mesotelioma pleural, apenas a exposição. O pré-requisito é uma lavagem broncoalveolar ou uma biópsia pulmonar para obter material [4]. O encaminhamento para um centro especializado deve ser feito o mais cedo possível em caso de suspeita de mesotelioma.
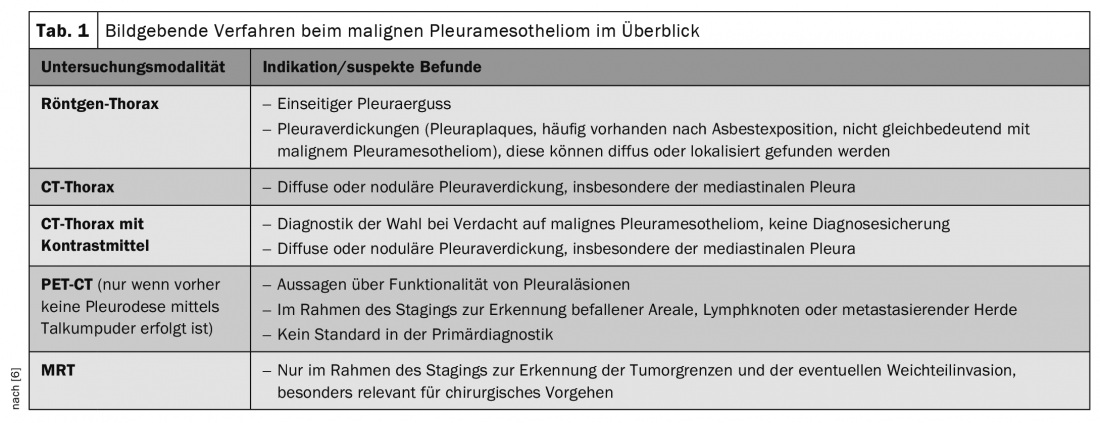
Para além dos procedimentos de imagem, o processamento histopatológico de biópsias e efusões pleurais é de particular importância. Os marcadores tumorais não desempenham actualmente qualquer papel no diagnóstico e também na avaliação da progressão [6]. As imagens utilizando raio-X torácico, ultra-som e/ou TAC podem confirmar o diagnóstico suspeito e determinar o local ideal para a biópsia. O diagnóstico final, contudo, só pode ser confirmado pelo exame histopatológico do tecido. Um tórax CT com meio de contraste é recomendado como diagnóstico de imagem inicial de escolha, onde o mesotelioma pleural maligno se apresenta caracteristicamente como espessamento pleural difuso ou nodular (tab. 1). No decurso da encenação, são também utilizados PET-CT e possivelmente MRI. Em qualquer caso, o estadiamento deve também incluir ultra-sons endobraquiais e mediastinoscopia para determinar o estado dos gânglios linfáticos antes de iniciar a terapia. São também utilizados VATS (toracoscopias vídeo-assistidas) e laparoscopias [6]. A encenação é feita de acordo com a classificação internacional TNM.
Para confirmar o diagnóstico, as biópsias são retiradas de áreas pleurais morfologicamente visíveis e inconspícuas, quer por VATS, biopsia com agulha guiada por ultra-sons ou biopsia pleural aberta [6]. O exame puramente citológico do derrame pleural não pode substituir a biópsia devido à falta de sensibilidade [4]. As análises imunohistoquímicas e genéticas moleculares são realizadas como parte do trabalho histopatológico. Estes servem, por um lado, para provar a origem mesotelial e, por outro lado, para a distinguir de outras alterações malignas. Além disso, os subtipos histológicos estão associados a diferentes proteínas de superfície [8]. Em geral, os subtipos epithelioide, bifásico e sarcomatóide distinguem-se com base nos padrões de crescimento histomorfológico, com os mesoteliomas pleurais epitelioide a revelarem-se mais prognósticos favoráveis do que os sarcomatóide [12].
Terapia: O caminho para a modernidade
Até agora, não existem normas uniformes para o tratamento do mesotelioma pleural maligno. Uma coisa é clara, porém: a monoterapia não parece ser suficiente [13]. O objectivo do tratamento é – se possível – uma ressecção macroscopicamente completa num conceito de tratamento multimodal. Neste contexto, a quimioterapia adjuvante ou neoadjuvante usando platina mais pemetrexed tem sido a base do tratamento até à data. Gemcitabine provou ser igualmente eficaz com uma tolerabilidade significativamente pior [13]. A adição de bevacizumab é uma possibilidade, mas não é aprovada na Suíça [14]. Actualmente, não é recomendada nenhuma terapia de manutenção, e faltam opções bem testadas para a terapia de segunda linha [6]. Em princípio, os doentes devem ser tratados preferencialmente em centros especializados e ter acesso a ensaios clínicos [6].
Para além da cirurgia e quimioterapia, são também utilizados procedimentos radioterápicos. Estes são utilizados, por exemplo, para aliviar a dor e podem ter influência no risco de recorrência, que está actualmente a ser investigado em estudos [6]. A irradiação radical de todo o tumor não é geralmente recomendada fora dos estudos devido à propagação de tumores mais complexos e à exposição à dose resultante. Os sítios de biopsia não devem ser irradiados profilaticamente para evitar a semeadura de células tumorais, ao contrário de suposições anteriores [6].
A terapia cirúrgica radical é geralmente reservada aos doentes sem histologia sarcomatóide. Outros pré-requisitos são um estado de gânglio linfático N<2 e uma fase da UICC <IV. Isto significa que não deve haver metástases [6]. O objectivo não é operar sem tumor residual, mas sim conseguir uma ressecção macroscopicamente completa. Dependendo da situação, a pneumonectomia extrapleural (EPP), a pleurectomia e decorticação (P/D) e a pleurectomia parcial podem ser consideradas como procedimentos [8]. O resultado final é que o benefício destas operações permanece pouco claro, e o ensaio MARS2 está actualmente a investigar o benefício da pleurectomia e decorticação compressiva de lung-preserving em comparação com um procedimento sem cirurgia. As intervenções cirúrgicas são também importantes no quadro de um conceito de tratamento paliativo. Por exemplo, a pleurodese com pó de talco pode ser realizada para derrames pleurais recorrentes [15].
No campo da terapia sistémica, um avanço foi recentemente alcançado após uma longa pausa. Por exemplo, o estudo CheckMate-743 mostrou uma vantagem do tratamento de primeira linha com os dois inibidores de ponto de controlo nivolumab e ipilimumab na situação paliativa [16,17]. A dupla imunoterapia já foi aprovada devido aos resultados convincentes em histologia não-epithelioide, bem como em histologia epithelioide e expressão PD-L1 [14]% ≥1 . No ensaio, resultou numa sobrevivência global (SO) mediana de 18,1 meses, em comparação com 14,1 meses no grupo de quimioterapia (hazard ratio 0,74, p=0,002) [17]. Este primeiro sucesso significativo no campo das modernas terapias oncológicas suscita outras questões. Entre outras coisas, está em discussão a combinação de quimioterapia e imunoterapia, bem como possíveis novas opções na segunda linha. E não são apenas outras novas substâncias activas que poderão em breve encontrar o seu caminho para o tratamento do mesotelioma pleural maligno, mas também vias alternativas de aplicação. Como a elevada taxa de recidivas locais é um problema relevante, as opções terapêuticas localizadas, tais como a terapia intracavitária, estão cada vez mais em foco. Por exemplo, o ensaio INFLuenCe-Meso fase II está actualmente em curso no Hospital Universitário de Zurique, testando a segurança e eficácia da quimioterapia intracavitária após a ressecção cirúrgica [13].
Literatura:
- Beeler P, et al: Fontes de dados sobre a incidência de mesotelioma pleural maligno na Suíça desde 2001. ASU Journal of Medical Prevention. 2021; 09.
- Unia: 30 anos de proibição do amianto. www.unia.ch/de/arbeitswelt/von-a-z/asbest/30-jahre-asbestverbot (último acesso em 30.09.2021).
- Krebsliga Schweiz: Cancro na Suíça: figuras importantes. Situação em Dezembro de 2020. www.krebsliga.ch/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf (último acesso em 30.09.2021).
- Scherpereel A, et al: Guidelines of the European Respiratory Society and the European Society of Thoracic Surgeons for the management of malignant pleural mesothelioma. Eur Respir J. 2010; 35(3): 479-495.
- Duelo T: Guia Oncológico – Mesotelioma Pleural | Causas, Diagnóstico e Tratamento.www.oncology-guide.com/erkrankung/pleuramesotheliom (último acesso 30.09.2021).
- Scherpereel A, et al: ERS/ESTS/EACTS/ESTRO guidelines for the management of malignant pleural mesothelioma. Eur Respir J. 2020; 55(6).
- Fundação EFA. www.stiftung-efa.ch (último acesso em 30.09.2021).
- Baas P, et al: Malignant pleural mesothelioma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2015; 26 Suppl. 5: v31-9.
- Duell T: Terapia sistémica do mesotelioma pleural. Terapia com medicamentos. 2017; 35(06).
- Mesotelioma pleural maligno – sintomas, tratamento e busca médica: Deutscher Verlag für Gesundheitsinformation, Heidelberg, Alemanha; www.leading-medicine-guide.ch/erkrankungen/tumoren/mesotheliom#topics (último acesso 30.09.2021).
- Gill RR: Imagem de mesotelioma. Resultados recentes Cancer Res. 2011; 189: 27-43.
- Husain AN, et al: Guidelines for pathologic diagnosis of malignant mesothelioma: 2012 update of the consensus statement from the International Mesothelioma Interest Group. Arch Pathol Lab Med. 2013; 137(5): 647-667.
- Terapia do mesotelioma pleural maligno. www.usz.ch/fachbereich/thoraxchirurgie/angebot/malignes-pleuramesotheliom (último acesso em 30.09.2021).
- Informação sobre Medicamentos Swissmedic Medicinal Product Information. www.swissmedicinfo.ch (último acesso em 30.09.2021).
- Bielsa S, et al: O tipo tumoral influencia a eficácia da pleurodese em efusões malignas. Lung. 2011; 189(2): 151-155.
- Nowak AK, Jackson A, Sidhu C: Gestão de Mesotelioma Pleural Avançado – Na encruzilhada. Prática de JCO Oncol. 2021: Op2100426.
- Baas P, et al: nivolumab de primeira linha mais ipilimumab em mesotelioma pleural maligno incontestável (CheckMate 743): um ensaio multicêntrico, aleatorizado, com rótulo aberto, fase 3. Lanceta. 2021; 397(10272): 375-386.
InFo ONCOLOGy & HEMATOLOGy 2021; 9(5): 32-33