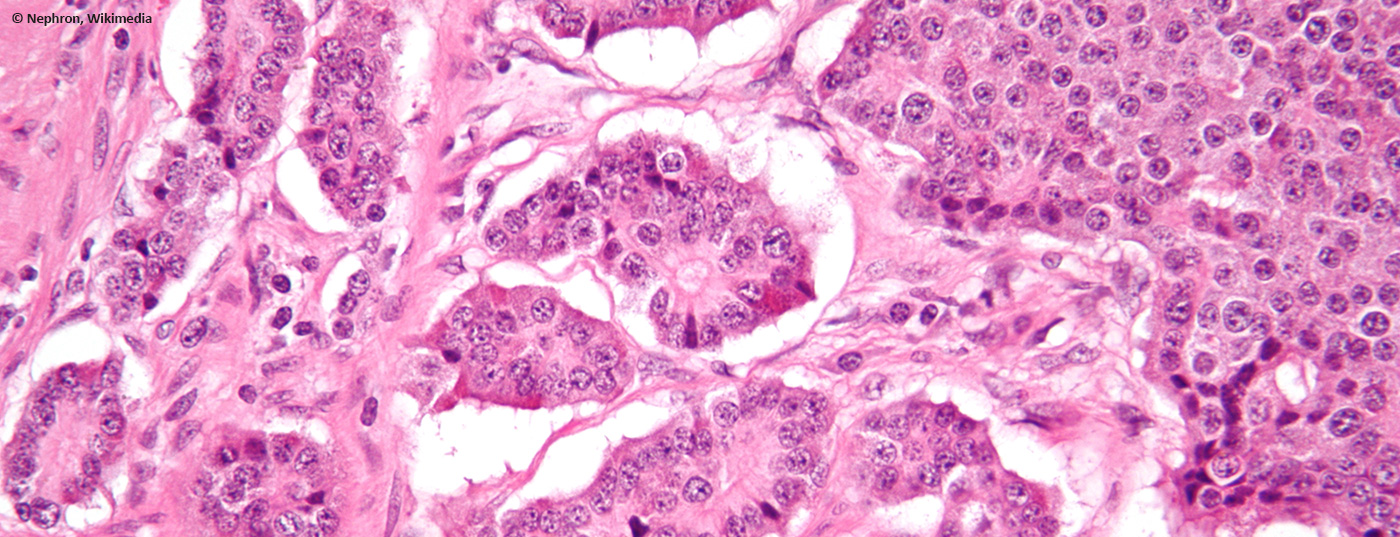
As neoplasias neuroendócrinas ocorrem geralmente esporadicamente e têm frequentemente origem no espaço gastroenteropancreático. São geralmente diagnosticados incidentalmente, uma vez que muitas vezes não funcionam. Por conseguinte, na maioria dos casos é uma doença tumoral já avançada, frequentemente metástaseada.
O termo “neuroendócrina” refere-se a células com características histológicas de tecido glandular que estão geralmente difusamente presentes em vários órgãos do corpo e podem secretar hormonas. Dependendo da função e da localização, são produzidas aminas (por exemplo catecolaminas) ou péptidos (por exemplo somatostatina), que regulam a actividade do tecido circundante. Embriologicamente, foram durante muito tempo considerados como fazendo parte da crista neural, mas agora são considerados como fazendo parte do endoderme, tal como as células exócrinas do tracto gastrointestinal. Historicamente, estas células foram agrupadas num sistema neuroendócrino difuso (anteriormente também chamado APUD (“amine precursor uptake and decarboxylation”)). Contudo, como estes termos não têm qualquer significado histopatológico ou clínico relevante, não devem continuar a ser utilizados.
Se estas células degenerarem, são chamadas neoplasias neuroendócrinas (NEN). Este termo abrangente inclui tanto os tumores neuroendócrinos (NET) e carcinoides do pulmão que proliferam lentamente, como os carcinomas neuroendócrinos (NEC) significativamente mais agressivos e prognósticos desfavoráveis. Todas as recomendações deste artigo serão, portanto, baseadas nesta classificação.
As neoplasias neuroendócrinas ocorrem na sua maioria esporadicamente, com uma incidência estimada de cerca de 5/100.000 habitantes. Um agregado familiar pode ser observado em múltiplas neoplasias endócrinas (MEN) I e II, bem como em doenças raras como a síndrome de von Hippel-Lindau ou neurofibromatose tipo 1 (Recklinghausen). A maior parte do NEN provém do espaço gastroenteropancreático (GEP-NEN), cerca de 25-30% têm origem no pulmão [1].
Sintomatologia
Embora a produção hormonal seja uma característica típica das neoplasias neuroendócrinas, os chamados tumores funcionais – ou seja, tumores cuja produção hormonal e secreção conduzem a sintomas – são raros. As queixas causadas por tumores funcionais dependem da respectiva secreção de substâncias bioactivas. Os insulinomas ou gastrinomas, que representam a maior proporção destes NEN funcionais, levam, por exemplo, a uma hipoglicemia grave, potencialmente fatal, ou a múltiplas ulcerações gástricas (síndrome de Zollinger-Ellison). Outro quadro clínico típico é a síndrome carcinoide, na qual a secreção excessiva de serotonina pode levar a diarreia aguada grave, sintomas de rubor e broncoespasmo. A fibrose endocárdica pode ocorrer como uma complicação tardia, o que pode levar à insuficiência cardíaca com consequências fatais (síndrome de Hedinger).
No entanto, até 90% de todos os NEN são não funcionais e são diagnosticados como achados acidentais ou no contexto de queixas não específicas. Na maioria dos casos, devido ao curso indolente, trata-se de uma doença tumoral avançada, já metástaseada.
Diagnósticos
É sempre necessária uma biopsia para confirmar o diagnóstico. O trabalho histopatológico deve incluir a determinação dos marcadores típicos (sinaptofisina, receptores de somatostatina [SSTR]) e necessariamente a taxa de proliferação (Ki-67 ou MIB-1) ou a taxa de mitose, uma vez que estes são de considerável importância tanto prognóstica como terapêutica. No caso de uma suspeita de síndrome carcinoide, a determinação do ácido 5-hidroxi-indoleacético (5-HIESS, um produto de degradação da serotonina) na urina de 24 horas é um diagnóstico. Outros valores laboratoriais de jejum como a cromogranina A (CgA) e, se necessário, a enolase específica de neurónio (NSE) podem ser usados como marcadores tumorais. Dependendo da clínica, são utilizados outros testes (por exemplo, o teste de jejum para insulinoma). Como perspectiva futura, um novo método também deve ser mencionado aqui: o chamado NETest [2]. É um diagnóstico por PCR a partir de sangue total (“biopsia líquida”), com o qual são examinados 51 filamentos de mRNA específicos da rede. O valor preditivo positivo para o diagnóstico da neoplasia neuroendócrina é superior a 90%, tal como a sensibilidade e especificidade. Os relatórios iniciais têm demonstrado a sua utilidade tanto para o diagnóstico como para a monitorização da resposta ao tratamento. Actualmente, no entanto, esta NETest ainda não está amplamente disponível.
Imagiologia
Para além das imagens habituais, as imagens nucleares funcionais desempenham um papel crucial, tanto na encenação como na selecção terapêutica. Antes de mais, 68Ga-DOTATO PET/CT deve ser mencionado aqui, o que nos últimos anos tem continuamente substituído a cintilografia de octreotídeos menos precisa e mais complexa [3]. Devido a este exame PET significativamente mais sensível, não é raro que ocorra um aumento através da detecção de metástases que não são visíveis na tomografia computorizada. Além disso, pode ser utilizado para detectar a expressão SSTR2 frequentemente presente na superfície celular da rede e assim avaliar a possível utilização da terapia com radionuclídeos (PRRT, ver abaixo). Se o índice de proliferação for elevado ou se a expressão SSTR2 estiver ausente ou for heterogénea, o desempenho adicional do FDG-PET/CT é útil [4], porque as lesões FDG-avid indicam um comportamento mais agressivo e devem ser adicionalmente examinadas biopticamente sempre que possível.
Nova classificação da OMS
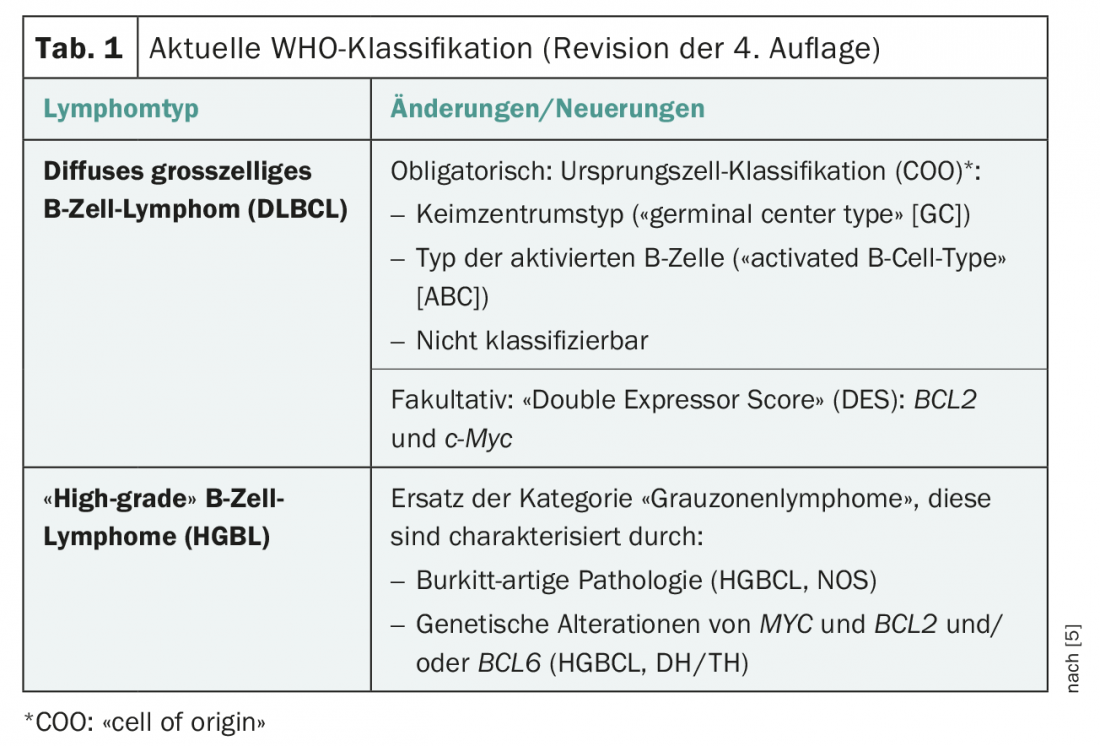
Nas últimas décadas, houve alterações significativas na classificação das neoplasias neuroendócrinas graças a novos achados histopatológicos e clínicos (Tab. 1) . A actual classificação da OMS (2017), em particular para os NENs pancreáticos (novo: panNENs), eliminou o discrepante histopatológico (elevado índice de proliferação
mas baixa taxa de mitose) e características clínicas (prognóstico) foram tidas em conta. Isto resulta na subdivisão em NET G1, NET G2, NET G3 e NEC G3. Desde a classificação de 2010, o termo “carcinoide” só deve ser utilizado para a rede pulmonar (Tab. 2).

Tratamento da rede não-metastática e acompanhamento
A única opção potencialmente curativa para as neoplasias neuroendócrinas é a remoção completa do tumor. No tracto gastrointestinal, isto pode ser feito endoscopicamente, dependendo do tamanho (até 2 cm) e situs. No entanto, a indicação para a ressecção cirúrgica deve ser feita de baixo limiar se houver evidência de infiltração da musculopropria (T2) ou metástases dos gânglios linfáticos [5]. As redes do apêndice são uma situação especial. Na grande maioria dos casos, trata-se de um achado incidental após uma apendicectomia. A decisão de realizar uma hemicolectomia suplementar direita com linfadenectomia depende do tamanho do tumor (>2 cm), profundidade de penetração (>3 mm) na mesoappendix, e invasão vascular (V1) ou linfática (L1) [6].
Ao contrário de outras entidades tumorais, não há indicação de terapia adjuvante em tumores neuroendócrinos. Recomenda-se um acompanhamento regular com endoscopias anuais para NET do estômago ou recto. No caso de NET localmente avançada mas completamente removida cirurgicamente, a imagiologia anual (geralmente TC do abdómen torácico com meio de contraste i.v.) deve ser realizada ao longo da vida.
Opção terapêutica para NEN metastásico
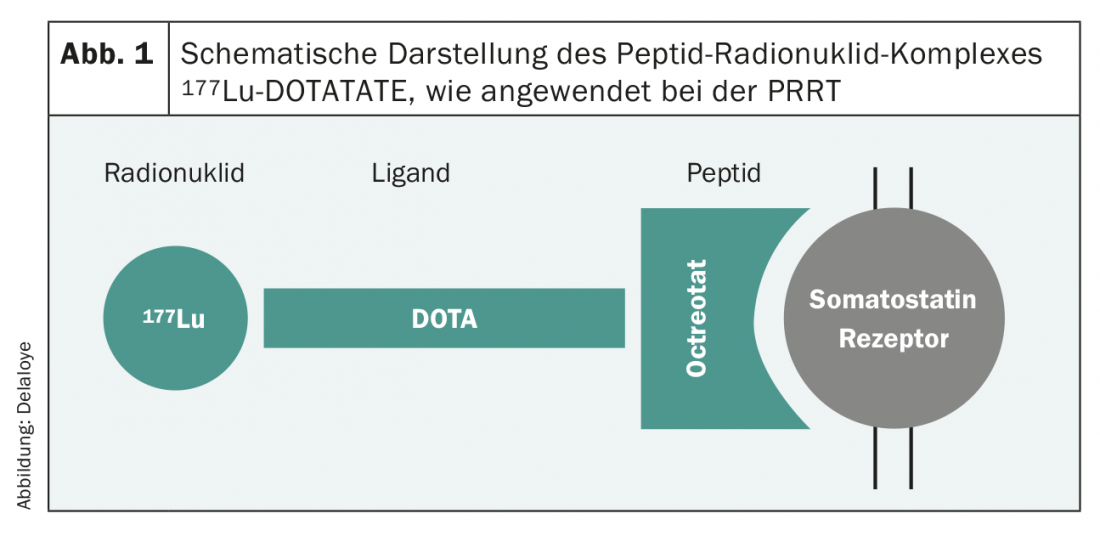
Os novos desenvolvimentos na última década melhoraram dramaticamente o panorama terapêutico e, consequentemente, a sobrevivência dos pacientes. O número de estudos de fase III relevantes para a prática desenvolveu-se quase exponencialmente, e as recomendações das sociedades profissionais baseiam-se em provas cada vez mais sólidas. Basicamente, as opções de tratamento para tumores G1 e G2 são muito semelhantes. Nesta população de doentes, deve ser dada especial atenção aos efeitos secundários da terapia, uma vez que são na sua maioria doentes assintomáticos. No SSTR2-expressor de tumores, numerosos estudos estabeleceram a utilização em primeira linha de análogos de somatostatina [7,8], mesmo em tumores não funcionais. Esta terapia, geralmente bem tolerada, leva frequentemente a um bom controlo do tumor e, portanto, a um prolongamento da sobrevivência sem progressão. Outra opção é a terapia de radionuclídeos receptores de peptídeos (PRRT). Um procedimento em que uma substância radioactiva (90Yttrium ou 177Lutetium), ligada a um peptídeo receptor de somatostatina afim (Octreotide/Octreotate) (Fig. 1), é administrada por via intravenosa como uma infusão e permite a irradiação orientada de células tumorais SSTR2-positivas. Este tratamento é normalmente aplicado quatro vezes seguidas, cada vez com um intervalo de oito semanas. Esta é também uma terapia que é normalmente muito bem tolerada, e cujos resultados foram provados há alguns anos num estudo em grande escala da fase III [9].
A nível molecular, o uso de everolimus como inibidor de mTOR tornou-se estabelecido. O mecanismo de proliferação celular em torno da via PI3K-mTOR desempenha um papel importante nas neoplasias neuroendócrinas, como noutros tumores. Assim, um bom controlo do tumor pode ser alcançado com everolimus [10], mas esta terapia está associada a significativamente mais efeitos secundários.
A quimioterapia é também utilizada para uma maior proliferação de G2-NET e G3-NET. Um estudo da fase II demonstrou a actividade antitumoral da capecitabina e temozolomida (CapTem) nesta coorte de doentes [11]. Embora ainda faltem dados da fase III, esta terapia demonstrou na prática e estabeleceu-se rapidamente como uma alternativa à combinação anterior de estreptozotocina e 5-fluorouracil (STZ+5FU). O perfil de efeito secundário também é favorável aqui e o manuseamento é simples.
Neoplasias neuroendócrinas de grau superior (nomeadamente NEC G3) são tratadas com uma combinação de platina e etoposídeo análogo à terapia para o carcinoma brônquico de pequenas células. Novas terapias com inibidores de pontos de controlo têm mostrado pouco sucesso até agora e geralmente não podem ser recomendadas. Deverão ser investigados mais aprofundadamente em ensaios clínicos.
Mensagens Take-Home
- As células com características histológicas do tecido glandular, que estão geralmente difusamente presentes em vários órgãos do corpo e podem secretar hormonas, são referidas como “neuroendócrinas”. Se degenerarem, são chamadas neoplasias neuroendócrinas (NEN).
- A maior parte do NEN provém do espaço gastroenteropancreático, cerca de 25-30% provêm dos pulmões.
- Os tumores funcionais, tais como insulinomas ou gastrinomas, são raros, mas depois levam a uma hipoglicemia grave e potencialmente fatal ou a múltiplas ulcerações gástricas.
- No entanto, em regra, as NEN não são funcionais e são diagnosticadas como descobertas acidentais ou no contexto de queixas não específicas.
- A única opção potencialmente curativa para as neoplasias neuroendócrinas não-metastáticas é a remoção completa do tumor. Ao contrário de outras entidades tumorais, não há indicação de terapia adjuvante em tumores neuroendócrinos.
- As opções de tratamento para o NEN metastásico melhoraram consideravelmente. Para o SSTR2-expressor de tumores, a utilização de análogos de somatostatina tornou-se estabelecida. As neoplasias neuroendócrinas de grau superior são tratadas com uma combinação de platina e etoposídeo análogo à terapia para o carcinoma brônquico de pequenas células.
Literatura:
- Cives M, et al: CA Cancer J Clin 2018; 68: 471-487.
- Modlin IM, et al: Endocr Relat Cancer 2014; 21(4): 615-628.
- Deppen A, et al: J Nucl Med 2016; 57(6): 872-878
- Kayani I, et al.: Cancer 2008; 112(11): 2447-2455
- Delle Fave G, et al: Neuroendocrinologia 2016; 103(2): 119-124
- Pape UF, et al: Neuroendocrinologia 2016; 103(2): 144-152
- Rinke A, et al: J Clin Oncol 2009; 27(28): 4656-4663.
- Caplin ME, et al: N Engl J Med 2014; 371(3): 224-233.
- Strosberg J, et al: N Engl J Med 2017; 376(2): 125-135
- Yao J, et al: Lancet 2016; 387: 968-977
- Strosberg JR, et al: Cancer 2011; 117(2): 268-275
InFo ONcOLOGy & HaEMATOLOGy 2019; 7(1): 16-18.