A hipertermia é um potente radio-sensibilizador. A base de provas é boa, especialmente para a re-irradiação de recidivas tumorais em áreas anteriormente contaminadas. A radioterapia térmica, como parte de uma terapia curativa primária, está actualmente a ser avaliada.
A hipertermia (HT) pode ser descrita como a forma mais antiga de terapia do cancro. Foi descoberto pela primeira vez em 5000 AC. mencionado nas tradições dos egípcios [1] e mais tarde também na antiguidade por Hipócrates. No início do século XIX, William Coley foi capaz de conseguir a regressão tumoral em doentes com sarcoma injectando lisados bacterianos e produzindo assim sepse com febre alta (hipertermia) [2]. É considerado o fundador da imunoterapia oncológica, embora em alternativa também possa ser considerado como o primeiro utilizador de HT nos tempos modernos. Nos anos 80, o HT apareceu em combinação com a radioterapia (RT), mas não conseguiu obter aceitação devido a concepções erradas sobre a aplicação de calor e falta de possibilidades técnicas de aplicação controlada de calor [3]. Nas últimas duas décadas, os desenvolvimentos técnicos na aplicação do calor e o seu controlo permitiram avaliar o efeito do HT objectivamente e de acordo com os princípios da “medicina baseada em provas”.
Noções básicas
HT é um aumento induzido da temperatura para 39-45°C no tecido tumoral, clinicamente mais comummente usando “hipertermia de temperatura suave” (MTH) de 39-41°C durante uma a duas horas. As temperaturas de >45°C são chamadas de termoablação e têm um mecanismo de acção diferente.
A aplicação de calor no HT pode ser utilizada tanto por
- externamente sob a forma de hipertermia regional de superfície (OHT) (para tumores até 4 cm da superfície da pele), hipertermia regional profunda (THT) (para tumores a mais de 4 cm da superfície da pele), hipertermia parcial do corpo controlada por MR ou de
- intersticiais ou
- intracavitária.
A hipertermia baseada em provas não é utilizada como monoterapia do cancro, mas em combinação com RT ou quimioterapia (ChT). Os melhores dados sobre isto estão em combinação com RT. Tal como demonstrado numa meta-análise de tumores cruzados de estudos randomizados e não randomizados, a termo-radioterapia (HTRT) simultânea leva a uma melhoria de 15 % na resposta completa (CR) em comparação com a RT apenas [4]. Para carcinoma da mama e recidivas da parede torácica mesmo +22% [5], para tumores ORL +23% [6] e carcinomas cervicais +23% [7] (significativo em cada caso: p<0,0001 ou p<0,001). Assim, o benefício de HTRT simultâneo poderia ser documentado especialmente em tumores localmente avançados no que diz respeito à CR e assim melhorar o controlo local.
Como funciona a hipertermia?
O aquecimento do tumor leva ao melhoramento da RT e/ou ChT aplicada ao mesmo tempo. Combinado com o RT, o HT actua como um potente sensibilizador de rádio [4,8–9]. Actua contra as células cancerígenas a vários níveis. HT leva a uma melhoria da microperfusão tumoral através da vasodilatação, em que as células tumorais hipóxicas e, portanto, radioresistentes são melhor oxigenadas [10]. Em combinação com RT, isto leva a um aumento das quebras de fios simples e duplos de ADN. Além disso, HT inibe os subsequentes mecanismos de reparação de ADN [11]. HT induz a estimulação imunitária através do aumento da expressão de proteínas de choque térmico, que, através das células assassinas naturais e das células dendríticas que apresentam antigénio, causam uma maior activação dos linfócitos CD8+ T e, portanto, uma resposta antitumoral específica e mediada pelo sistema imunitário [12]. Assim, para além do efeito local, o HT também pode ter um efeito sistémico.
Em que situações/entidades tumorais é utilizada a hipertermia?
HT pode teoricamente ser utilizado para todas as entidades tumorais, se tecnicamente viável. É utilizado em duas áreas de aplicação: Como radio-sensibilizador em re-irradiação (Re-RT) em tecidos pré-expostos para poupar a dose de radiação ou como radio-sensibilizador em tratamentos primários para aumentar a eficácia da dose de radiação aplicada (Tab. 1) [4,9,13].
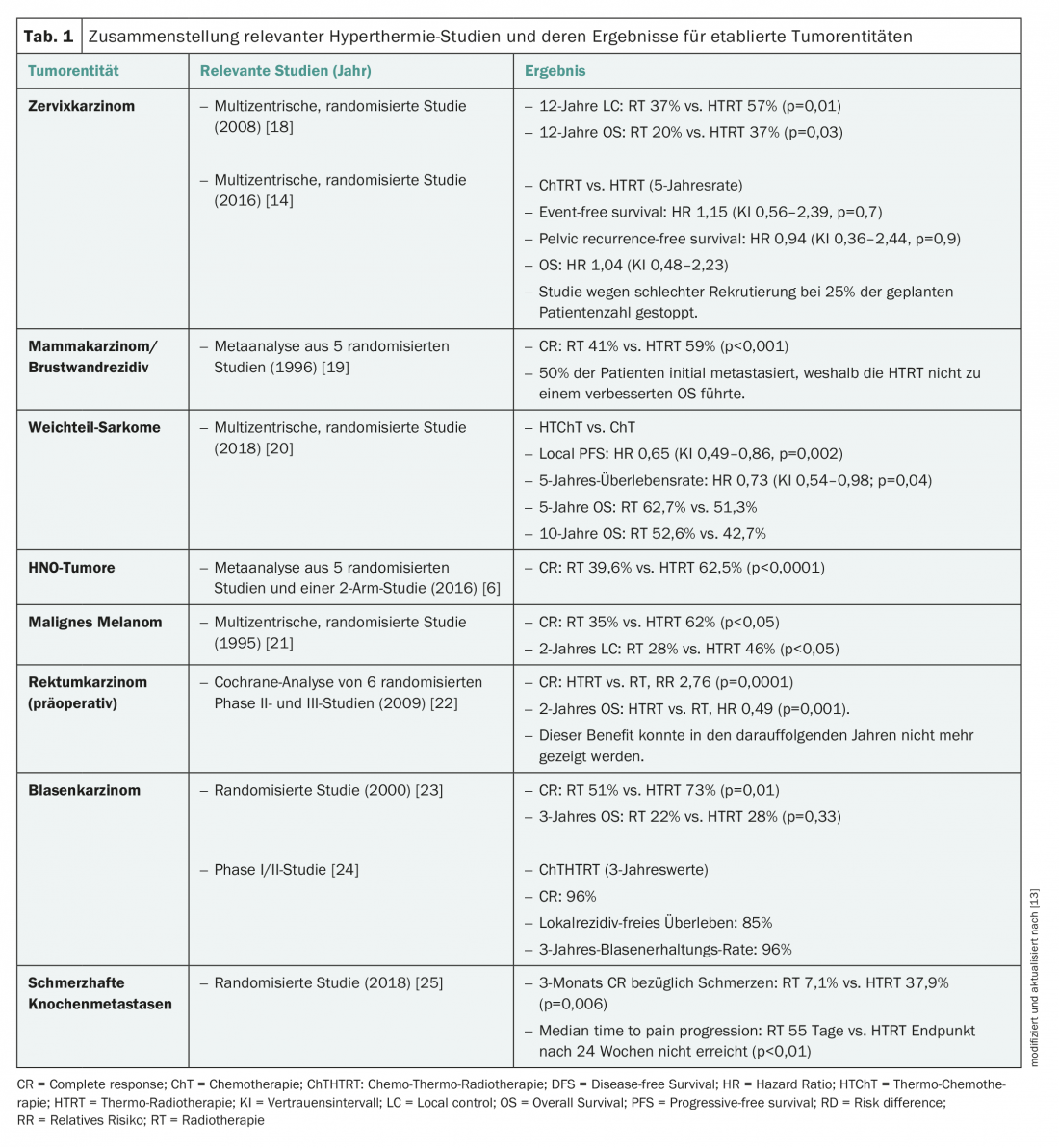
Re-irradiações: No caso de recidivas tumorais em áreas pré-irradiadas, a reirradiação com uma dose de radiação suficiente só pode ser realizada normalmente ao custo de toxicidade da radiação. O tecido pré-irradiado mostra geralmente fibrose com perfusão reduzida. O aquecimento com vasodilatação e melhor microperfusão contraria isto de forma única. Além disso, as outras propriedades de radiosensibilização mencionadas acima entram em jogo. Assim, o HT concomitante permite uma compensação pela aplicação da dose mais baixa. A recorrência local no cancro da mama após a RT adjuvante é a entidade mais frequente e melhor pesquisada [5]. HTRT nesta situação está listada como uma “recomendação de categoria 3” nas Orientações NCCN (Orientações NCCN versão 1.2018, MS-67).
Radio-sensibilizadores em tratamentos primários: Embora tenham sido publicados ensaios e meta-análises aleatórios positivos da fase III em algumas entidades tumorais, o HTRT não está listado como o padrão de ouro em nenhuma entidade tumoral. Numa inspecção mais atenta, é notório que os estudos são na sua maioria mais antigos e que o HTRT foi na sua maioria comparado apenas com o RT, que já não é considerado padrão actualmente. Exemplos típicos são tumores cervicais, rectais, urinários e otorrinolaringológicos. O início de novos estudos multicêntricos e internacionais é dificultado pela baixa densidade dos centros HT europeus e – em comparação com a ligação entre a indústria farmacêutica e a oncologia médica – pela falta de apoio financeiro. Assim, quando o HT está disponível, é sobretudo utilizado como uma alternativa de radiosensibilização em doentes não elegíveis para a terapia de radioterapia.
Uma vez que o HT correctamente executado normalmente não tem qualquer toxicidade adicional relevante [4], o HTRT poderia ser favorecido mesmo no caso de “não-inferioridade” no que diz respeito ao resultado em comparação com a radiochemoterapia (RTChT) devido a menos efeitos secundários. Esta comparação directa só foi investigada em alguns estudos até agora [14]. Assim, há esforços para combinar o HT no tratamento primário curativo no âmbito dos estudos, quer isoladamente com RT ou em conjunto com RTChT resp. ChT a ser aplicado.
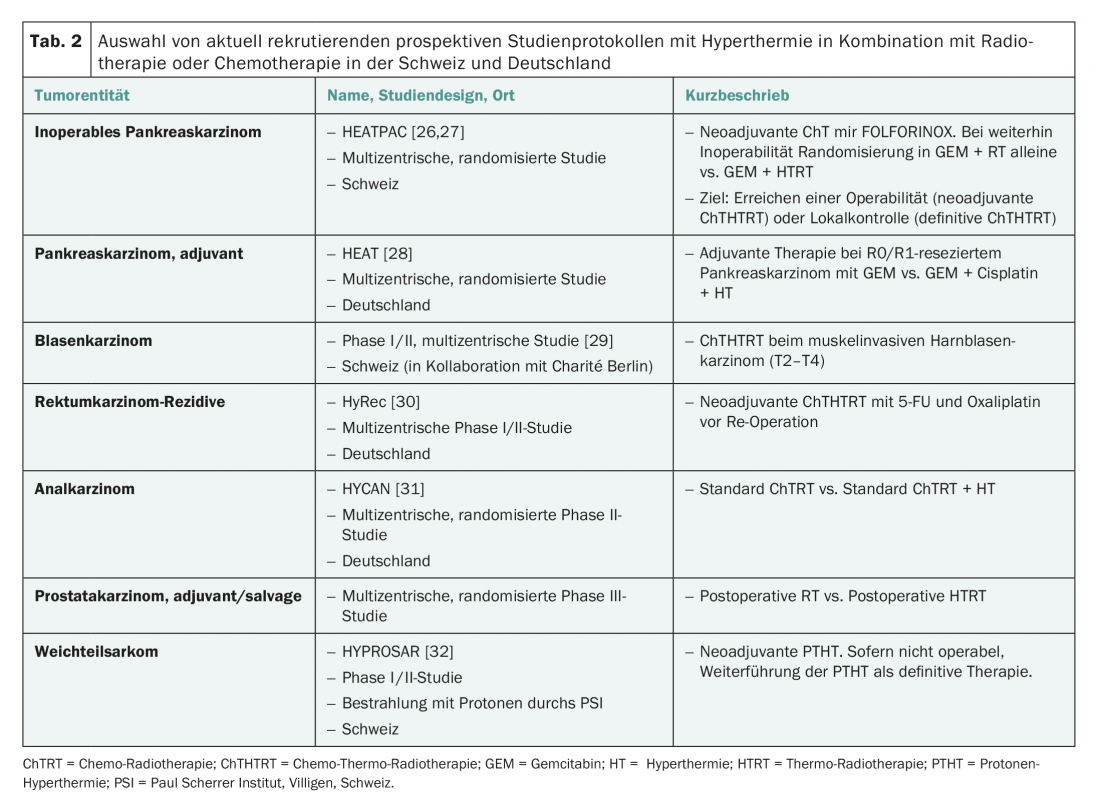
Para efeitos de síntese, uma selecção de protocolos de estudo actualmente a recrutar com HT na Suíça e na Alemanha é compilada no Quadro 2.
Contra-indicações para hipertermia
HT não é aplicável a todos os pacientes. O posicionamento sem dor nas costas e a aplicação de calor deve ser garantido durante cerca de uma hora e meia. ser tolerável. Devido às ondas electromagnéticas, o CDI/pacemakers, juntamente com próteses metálicas e material de osteossíntese perto da área tumoral, são uma contra-indicação. O primeiro pode causar disfunções, o segundo aquecimento local excessivo com queimaduras. Além disso, nem todos os locais de tumores se qualificam para o HT. De um ponto de vista técnico, a região do corpo a ser aquecida deve ser acessível ao aplicador HT. Por exemplo, tumores profundos na zona ORL que não são acessíveis à OHT não podem ser alcançados devido ao aplicador de THT em forma de anéis. Contudo, foi desenvolvido um aplicador especial [15] para este fim. Além disso, os tumores rodeados de ar (por exemplo, tumores pulmonares) podem ser aquecidos com dificuldade devido à baixa condução de calor.
Como é aplicada a hipertermia?
A aplicação de HT depende do dispositivo HT e da localização do tumor (OHT vs. THT). Uma ou duas vezes por semana, geralmente antes da radioterapia, a região tumoral é aquecida a uma temperatura de 41-43°C durante 45-60 minutos.
No THT, uma tomografia computorizada de planeamento é realizada em posição HT (“rede”) antes da primeira sessão, desenhando o volume a ser aquecido em analogia com o PTV (Planning Target Volume). Modelos físicos podem ser utilizados para calcular a temperatura no local alvo através de algoritmos calibrados (semelhantes ao cálculo da dose de radiação planeada no tecido) ou medidos com termometria indirecta em tempo real em locais do corpo ou aberturas (superfície da pele, bexiga, recto, vagina, etc.). O fornecimento de calor é ajustado em conformidade. A mais precisa seria uma medição intersticial da temperatura no tumor. No entanto, a possibilidade de infecção ou de metástases de implantação faz deste tipo de medição a excepção.
A OHT é comparativamente simples. Também aqui, a medição intersticial da temperatura é dispensada. Assim, a medição é feita através de sondas de temperatura sobre a pele, através das quais a aplicação de calor pode ser controlada em tempo real.
Hipertermia na Suíça
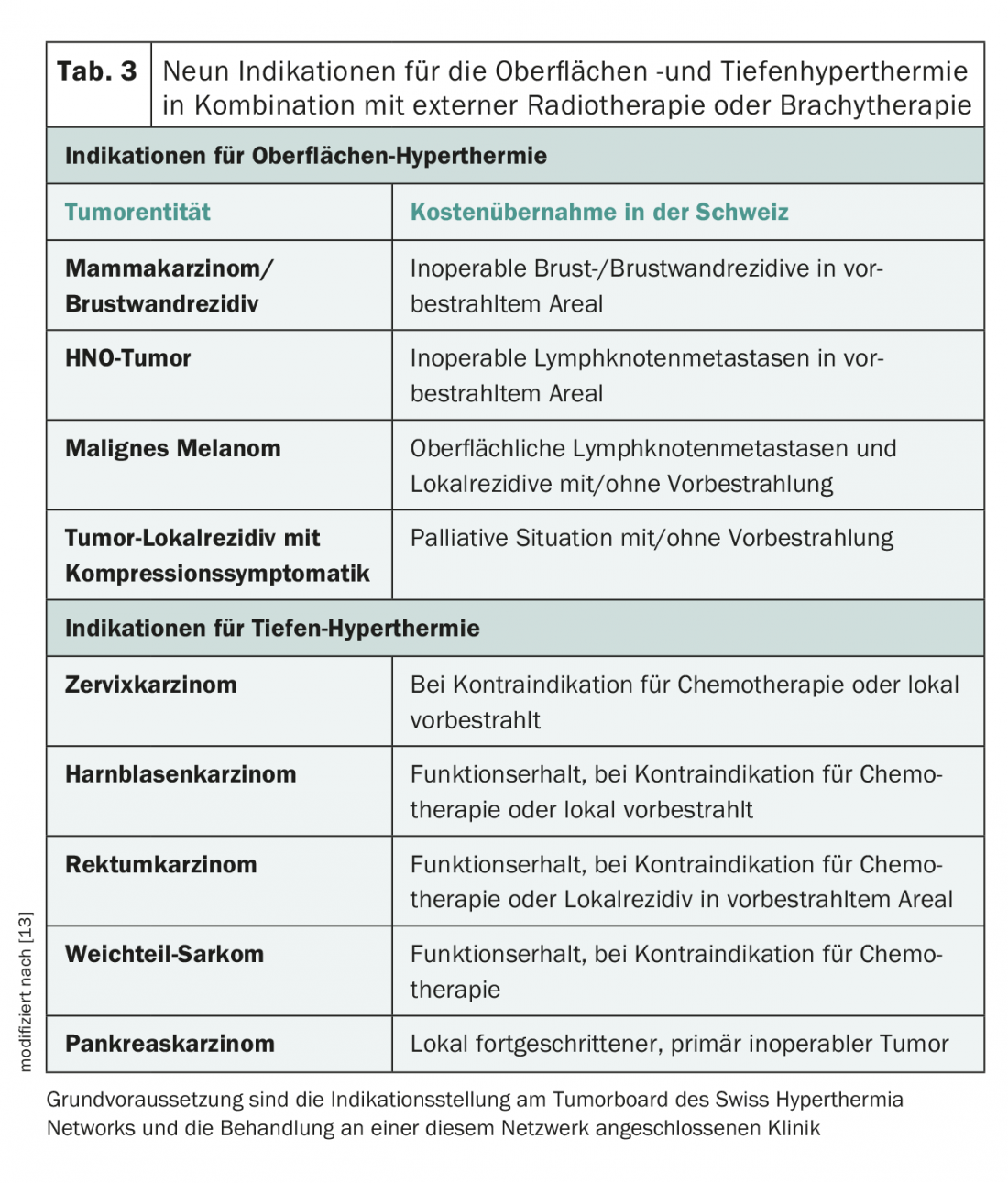
Na Suíça, o HT está totalmente coberto por um seguro de saúde para nove indicações (Tab. 3) com RT ambulatória simultânea, desde que os pacientes sejam apresentados na rede semanal virtual de hipertermia Swiss Hyperthermia Network Tumourboard (SHN) e que a indicação para HT tenha sido feita dentro deste quadro. Como actualmente existem apenas alguns centros HT na Suíça (para THT apenas o Hospital Cantonal Aarau), é necessária uma boa cooperação interinstitucional. O paciente referido externamente é normalmente hipertermizado um dia por semana e irradiado no centro HT. Os restantes, na sua maioria 80% das irradiações, são efectuados pelo médico que os encaminhou.
A Rede Suíça de Hipertermia (SHN) coordena mais estudos HT e projectos técnicos inovadores sob o patrocínio do Hospital Cantonal de Aarau. Por exemplo, um novo dispositivo HT está a ser desenvolvido em colaboração com o ITIS/ETH Zurique [16]. Para mais informações, consulte o artigo recentemente publicado no Swiss Cancer Bulletin [17].
Mensagens Take-Home
- A hipertermia é um potente rádio-sensibilizador com uma boa base de provas, especialmente para a re-irradiação de recidivas tumorais em áreas pré-expostas.
- A hipertermia pode ser utilizada como um radio-sensibilizador alternativo juntamente com a radioterapia em doentes não quimioterápicos no âmbito curativo.
- A termo radioterapia como parte das terapias curativas primárias está a ser avaliada em estudos em curso.
Conflito de interesses: Os autores oferecem hipertermia em combinação com radioterapia no Hospital Cantonal de Aarau. Juntamente com o Dr. med. Markus Notter, Lindenhofspital Bern, eles são os fundadores da Rede Suíça de Hipertermia.
Agradecimentos: Os autores gostariam de aproveitar esta oportunidade para agradecer às seguintes pessoas: Prof. Dr. med. Daniel Aebersold, Departamento Universitário de Rádio-Oncologia, Inselspital Bern pela revisão crítica deste artigo; ao resto da direcção da Swiss Hyperthermia Network (SHN), nomeadamente ao Dr. med. Markus Notter (Lindenhofspital Bern), PD Dr. med. Günther Gruber (Hirslanden Klinik Zurich), Prof. Dr. med. Thomas Ruhstaller (Hospital Cantonal St. Gallen) e Prof. Dr. Nicolaus Andratschke (Hospital Universitário de Zurique); ao resto do grupo de trabalho “Hyperthermia” do Centro de Rádio-Oncologia KSA-KSB, nomeadamente ao Dr. Gerd Lutters, Dietmar Marder, Olaf Timm e Prof. Stephan Scheidegger; à Liga do Cancro Aargau, ao Conselho de Investigação do Hospital Cantonal Aarau, ao Günter-und-Regine-Kelm-
Fundação e o Fundo Isler pelos seus muitos anos de apoio financeiro.
Literatura:
- Breasted JH: O papiro cirúrgico Edwin Schmid. In: Licht S, editor. Calor terapêutico e carvão. 2ª ed. Baltimore: Waverly Press 1930: 196.
- Coley WB: O tratamento de tumores malignos por repetidas inoculações de erisipela, com um relatório de dez casos originais. Am J Med Sci 1893; 105: 488-511.
- Dewhirst MW, et al: Re-estabelecendo a lógica biológica para a terapia térmica. Int J Hyperthermia 2005; 21(8): 779-790.
- Datta NR, et al: Hipertermia local combinada com radioterapia e-/ou quimioterapia: avanços recentes e promessas para o futuro. Cancer Treat Rev 2015; 41: 742-753.
- Datta NR, et al: Hyperthermia and Radiation Therapy in Locoregional Recurrent Breast Cancers: A Systematic Review and Meta-analysis. Int J Radiat Oncol Biol Phys 2016; 94: 1073-1087.
- Datta NR, et al: Hipertermia e radioterapia na gestão de cancros de cabeça e pescoço: Uma revisão sistemática e meta-análise. Int J Hyperthermia 2016; 32: 31-40.
- Datta NR, et al: Hipertermia e radioterapia com ou sem quimioterapia em cancro do colo do útero localmente avançado: uma revisão sistemática com meta-análises convencionais e em rede. Int J Hyperthermia 2016; 32: 809-821.
- Overgaard J: O calor está (ainda) ligado – o passado e o futuro da oncologia da radiação hipertérmica. Radiother Oncol 2013; 109: 185-187.
- Peeken JC, et al: Integrating Hyperthermia into Modern Radiation Oncology: What Evidence Is Necessary? Front Oncol 2017; 7: 132.
- Vaupel PW, et al.: Características fisiopatológicas e vasculares dos tumores e a sua importância para a hipertermia: a heterogeneidade é a questão chave. Int J Hyperthermia 2010; 26(3): 211-223.
- Oei AL, et al.: Efeitos da hipertermia nas vias de reparação do ADN: um tratamento para os inibir a todos. Radiat Oncol 2015; 10: 165.
- Toraya-Brown S, et al: Tumor local hipertermia como imunoterapia para o cancro metastásico. Int J Hyperthermia 2014; 30(8): 531-539.
- Stutz E, et al: Lugar da hipertermia regional na terapia do cancro. Schweiz Med Forum 2017; 17(48): 1074-1076.
- Ludgens LC, et al: Radiation therapy combined with hyperthermia versus cisplatin for locally advanced cervical cancer: Resultados do ensaio aleatório RADCHOC. Radiother Oncol 2016; 120(3): 378-382.
- Verduijn GM, et al: Hipertermia profunda com o sistema HYPERcollar combinado com irradiação para carcinoma avançado de cabeça e pescoço – um estudo de viabilidade. Int J Hyperthermia 2018; 34(7): 994-1001.
- Dressel S, et al.: Novo sistema aplicador de hipertermia permite o planeamento do tratamento adaptativo: resultados clínicos preliminares em animais portadores de tumores. Vet Comp Oncol 2018; 16: 202-213.
- Datta NR, et al: Swiss Hyperthermia Clinical and Research Activities: Integrating with Radiation Therapy. Swiss Cancer Bulletin 2018; 3: 249-252.
- Franckena M, et al: Melhoria a longo prazo dos resultados do tratamento após radioterapia e hipertermia no cancro do colo do útero locoregionalmente avançado: uma actualização do Ensaio Holandês de Hipertermia Profunda. Int J Radiat Oncol Biol Phys 2008; 70: 1176-1182.
- Vernon CC, et al: Radioterapia com ou sem hipertermia no tratamento do cancro da mama localizado superficial: resultados de cinco ensaios controlados aleatorizados. Grupo Internacional de Hipertermias Colaborativas. Int J Radiat Oncol Biol Phys 1996; 35: 731-744.
- Issels RD, et al: Effect of Neoadjuvant Chemotherapy Plus Regional Hyperthermia on Long-term Outcomes Among Patients With Localized High-Risk Soft Tissue Sarcoma: The EORTC 62961-ESHO 95 Randomized Clinical Trial. JAMA Oncol 2018; 4(4): 483-492.
- Overgaard J, et al.: Ensaio aleatório de hipertermia como adjuvante da radioterapia para melanoma maligno recorrente ou metastásico. Sociedade Europeia para a Oncologia Hipertérmica. Lancet 1995; 345: 540-543.
- De Haas-Kock DFM, et al: Hipertermia concomitante e radioterapia para o tratamento do cancro rectal localmente avançado. Cochrane Database Syst Rev 2009; (3): CD006269.
- Van der Zee J, et al: Comparação de radioterapia isolada com radioterapia mais hipertermia em tumores pélvicos localmente avançados: um ensaio prospectivo, randomizado e multicêntrico. Grupo de Hipertermia Profunda Holandês. Lancet 2000; 355: 1119-1125.
- Wittlinger M, et al.: Tratamento quadrimodal do cancro da bexiga T1 e T2 de alto risco: ressecção transuretral do tumor seguido de radiochemoterapia simultânea e hipertermia regional profunda. Radiother Oncol 2009; 93(2): 358-363.
- Chi MS, et al: Comparando a Eficácia da Radiação de Feixe Externo Combinada e Hipertermia contra a Radiação de Feixe Externo Sozinho no Tratamento de Pacientes com Metástases Bony Dolorosas: Um Estudo Prospectivo Fase 3, Randomizado, Controlado. Int J Radiat Oncol Biol Phys 2018; 100(1): 78-87.
- ClinicalTrials.gov: https://clinicaltrials.gov/ct2/show/NCT02439593?term=heatpac&rank=1 [Accessed 19.09.2018]
- Datta NR, et al.: “HEATPAC” – um estudo aleatório fase II de termochemoradioterapia concorrente versus quimioradioterapia apenas em cancro pancreático localmente avançado. Radiat Oncol 2017; 12(1): 183.
- ClinicalTrials.gov: https://clinicaltrials.gov/ct2/show/NCT01077427?term=HEAT&cond=pancreatic+cancer&rank=5 [Accessed 19.09.2018]
- Datta NR, et al: A hipertermia combinada com radioterapia é adequada em doentes idosos com cancros da bexiga invasivos dos músculos? Implicações termo-radiobiológicas de uma auditoria dos resultados iniciais. Int J Hyperthermia 2016; 32: 390-397.
- ClinicalTrials.gov: https://clinicaltrials.gov/ct2/show/NCT01716949?term=hyrec&rank=1 [Accessed 19.09.2018]
- ClinicalTrials.gov: https://clinicaltrials.gov/ct2/show/NCT02369939?cond=anal+cancer+hyperthermia&rank=1 [Accessed 19.09.2018]
- Datta NR, et al: Irradiação de prótons com hipertermia em sarcoma de tecidos moles sem degrau. Int J Particle Ther 2016; 3: 327-336.
InFo ONCOLOGy & HAEMATOLOGy 2018; 6(5): 35-39