O tratamento da artrite reumatóide (AR) fez grandes progressos ao longo dos últimos 20 anos. Isto refere-se tanto à gama de medicamentos disponíveis como à evolução em termos de rapidez de início de acção e taxas de resposta. Os ensaios clínicos da Fase III foram publicados em 2019, particularmente para os inibidores JAK, cujos resultados foram apresentados no Rheumatism Update em Wiesbaden.
As recomendações de actualização de 2019 da Liga Europeia Contra o Reumatismo (EULAR) mostram poucas diferenças em relação às edições anteriores. A recomendação de utilizar no máximo um segundo bloqueador de TNF em caso de falha terapêutica no primeiro bloqueador de TNF é relevante. Os inibidores JAK continuam a ser posicionados após falha de tratamento em csDMARD ou biólogos. Isto pode ser formalmente interpretado no sentido de que uma mudança de um inibidor JAK para outro é possível e sensata em caso de falha terapêutica, explicou o Prof. No entanto, ainda não há dados disponíveis. Tendo em conta a recente aprovação do upadacitinib e em breve também do filgotinib, coloca-se a questão de uma estratégia de comutação óptima, especialmente para os inibidores JAK.
Quatro inibidores JAK disponíveis para RA
No ano passado, o peficitinib recebeu aprovação para o mercado japonês. Assim, existem actualmente quatro inibidores JAK aprovados para o tratamento da AR, embora o peficitinibe ainda não tenha sido aprovado para utilização nos EUA ou na Europa. O perito estava principalmente preocupado com a questão das diferenças específicas de substância em termos de eficácia e perfil de segurança. Tendo em conta a difícil manipulação (necessidade de arrefecimento, administração parentérica), deve afirmar-se que os produtos biológicos não representam a forma ideal de terapia para todos os pacientes, especialmente porque apenas uma minoria consegue uma remissão clínica contínua. A dor, as limitações funcionais, a fadiga e a depressão, por outro lado, representam uma elevada carga de doença para as pessoas afectadas.
A selectividade dos inibidores JAK, ou seja, a inibição de isoformas individuais a uma determinada concentração intracelular, é o foco principal dos estudos. Procura-se assim a relação óptima de eficácia e efeitos secundários, tais como a anemia. O programa de ensaios clínicos fase III para o tofacitinibe e o baricitinibe foi concluído; para o upadacinitib, aguardam-se ainda os resultados de um estudo frente a frente com abatacepção em doentes de AR que não responderam adequadamente à terapia biológica anterior.
Tofacitinib
Com o tofacitinib, não há muito de novo em termos de eficácia, uma vez que está disponível e é bem conhecido nos EUA há muitos anos. O Tofacitinib foi também aprovado na Suíça desde 2013. Uma nova análise post-hoc relativa a doentes seropositivos e seronegativos mostrou uma resposta comparável em ambos os grupos. As taxas de remissão de DAS28 foram ligeiramente inferiores às dos pacientes com PCC.
Na análise, os dados de cinco estudos da fase III foram agrupados e os subgrupos foram definidos com base na serologia: RF+CCP+, RF+CCP-, RF-CCP+ e RF-CCP-. Como resultado, os pacientes com RF+CCP+ tinham uma maior probabilidade de obter uma resposta ACR-20, -50 ou -70 do que os pacientes com RF-CCP. Este resultado foi mostrado para a resposta ACR-20 e -50 para ambos tofacitinib 5 mg duas vezes por dia e tofacitinib 10 mg duas vezes por dia. Em contraste, a resposta do ACR-70 só foi melhor na dose mais elevada [1].
Outro estudo analisou o risco de eventos cardiovasculares sob tofacitinibe. A avaliação de um estudo actual da fase IV comparando o tofacitinibe com bloqueadores de TNF (adalimumab, etanercept) em doentes com mais de 50 anos de idade e pelo menos um factor de risco adicional para eventos cardiovasculares mostrou que o risco de eventos tromboembólicos associados ao tofacitinibe deve ser considerado aumentado.
O risco de embolia pulmonar foi significativamente aumentado com tofacitinib na dose de 10 mg e também mais elevado com 5 mg duas vezes por dia do que em estudos anteriores. Além disso, a mortalidade por todas as causas foi mais elevada abaixo de 10 mg duas vezes por dia do que abaixo de 5 mg duas vezes por dia. A EMA emitiu subsequentemente uma recomendação de que o tofacitinibe não deve ser utilizado em doentes com risco aumentado de tromboembolismo. Os doentes com mais de 65 anos de RA só devem ser tratados com tofacitinibe se não houver alternativa terapêutica. A Prof. Rubbert-Roth comentou que considera a recomendação da EMA baseada num estudo que ainda não foi cientificamente apresentado e discutido “invulgar” e espera que tal aconteça em breve.
Baricitinib
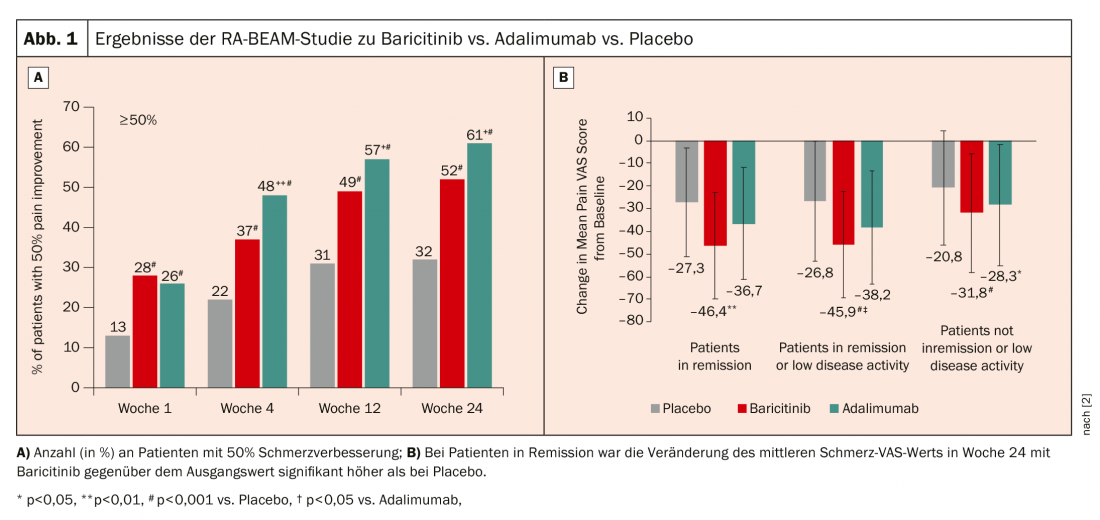
O Baricitinib foi aprovado na Suíça desde 2017 numa dose de 4 mg (2 mg em doentes mais velhos ou em insuficiência renal). No estudo RA-BEAM, o baricitinib 4 mg + MTX foi comparado com adalimumab + MTX e placebo + MTX [2]. Aqui, a melhoria de 50% na dor demonstrou ser melhor com o baricitinibe. (Fig.1A). Se olharmos mais de perto apenas para os pacientes que estão em remissão ou têm baixa actividade da doença, ainda vemos um efeito significativo na dor com baricitinibe. (Fig.1B). O reumatologista só pode especular porque é que isto é assim: “É possível que os receptores de dor também utilizem JAK na sua sinalização, o que significa que também têm efeitos de dor específicos. O efeito positivo também pôde ser observado após uma mudança de adalimumab para baricitinibe após uma semana. 16 determinar.
Relativamente à resposta de vacinação sob baricitinibe, o PCV13 e o toxoide do tétano (TT) foram testados. 106 Os doentes do estudo RA-BEYOND que receberam 2 mg ou 4 mg de baricitinib (com e sem MTX) foram vacinados com PCV13 e contra o tétano. No total, 68% dos pacientes mostraram uma resposta de vacinação suficiente contra o pneumococo, 43% conseguiram um aumento dos títulos de vacinação mais de 4 vezes para o tétano. Um aumento de mais de 2 vezes depois do PCV13 foi alcançado por 74 % dos doentes [3].
Upadacitinib
Segundo o Prof. Rubbert-Roth, um dos estudos mais importantes do ano passado é SELECT-COMPARE, que comparou upadacitinib vs. adalimumab vs. placebo em doentes MTX-IR com RA activa [4]. Neste estudo, havia a opção de mudar de upadacitinib para adalimumab na semana 12 bem como vice-versa (nas semanas 14, 18, 22 e 26) se houvesse menos de 20% de melhoria nas articulações dolorosas e inchadas (pontos finais co-primários ACR20 e DAS28-CRP <2.6).
O estudo de 1629 pacientes com RA activa apesar do MTX mostrou que o upadacitinib (aprovado na Suíça desde a Primavera de 2020) foi estatisticamente mais eficaz do que o adalimumabe: 71% dos pacientes conseguiram uma resposta ACR20 com upadacitinib, apenas 63% com adalimumabe e 36% com placebo. 29% dos doentes conseguiram a remissão segundo a DAS28-CRP, em comparação com apenas 18% em adalimumabe e 6% em placebo. Em termos de efeitos secundários, os aumentos de herper zoster e CK foram mais frequentes com upadacitinib, o tromboembolismo venoso (TEV) ocorreu em 3 doentes com adalimumab vs. 2 doentes com upadacitinib. Olhando para os não-respondedores, verificou-se que a mudança do upadacitinib para o adalimumabe resultou em 13% de remissão, enquanto que inversamente a mudança do adalimumabe para o upadacitinib resultou em 26% de obtenção do resultado desejado.
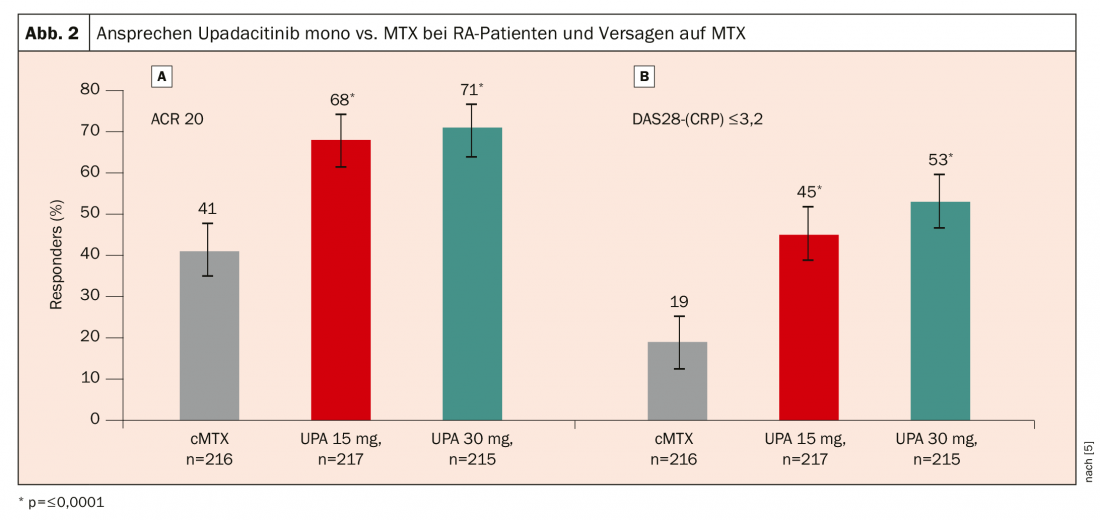
No ensaio SELECT-MONOTHERAPY, 648 pacientes com RA activa, apesar do MTX, foram aleatorizados para continuação da terapia MTX ou upadacitinib 15 mg ou 30 mg em monoterapia [5]. Mais uma vez, verificou-se uma resposta significativamente melhor com o upadacitinib: após 14 semanas, foi alcançada uma resposta ACR20 em 68% dos pacientes com upadacitinib 15 mg e 71% com upadacitinib 30 mg, em comparação com apenas 41% dos pacientes que continuaram a terapia MTX (Fig. 2).
Filgotinibe e peficitinibe
O filgotinib é considerado um inibidor selectivo de JAK1, e o programa de ensaios fase III FINCH1, -2 e -3 foi publicado ou apresentado nos congressos internacionais em 2019. Em FINCH2, a eficácia e segurança do filgotinib (100 mg ou 200 mg diários) em comparação com placebo foi estudada durante 24 semanas em 449 pacientes com AR activa, apesar de uma terapia estável com csDMARD e de falha de tratamento anterior ou intolerância com biólogos (bDMARD) [6]. 23,4% dos pacientes tinham três ou mais bDMARD anteriores; o ponto final primário era a obtenção de uma resposta ACR20 com 12 semanas. O resultado aqui foi que 66% atingiram o ponto final primário no filgotinib 200 mg, 57,5% no filgotinib 100 mg e 31,1% dos doentes com placebo. Em doentes com falha de tratamento a pelo menos três bDMARD, a resposta ACR20 foi de 70,3% em 200 mg de filgotinib, 58,8% em 100 mg e 17,6% em placebo. “Esta será certamente também uma substância que em breve entrará no registo”, o Prof. Rubbert-Roth avaliou os números.
No entanto, o perito não parece estar tão convencido acerca do peficitinib, que será aprovado no Japão em 2019. Ela apenas se referiu a um estudo que analisou o inibidor pan-JAK versus placebo durante 52 semanas em doentes com RA activa apesar dos DMARD convencionais mas sem registar a progressão radiográfica. 507 pacientes foram aleatorizados. O peficitinibe mostrou uma resposta ACR20 de 57,7% às 12 semanas com peficitinibe 100 mg e 74,5% com peficitinibe 150 mg vs. 30,7% com placebo (p<0,001). Contudo, um braço comparador de rótulo aberto com etanercept mostrou que o etanercept superou consistentemente o peficitinib, alcançando uma resposta ACR20 de 83,5%.
Fonte: Rheumatism Update, Wiesbaden (D)
Literatura:
- Bird P, Hall S, Nask P, et al: RMD aberto 2019; 5: e000742; doi:10.1136/rmdopen-2018-000742. (Epub ahead of print).
- Fautrel B, Kirkham B, Pope JE, et al: J Clin Med 2019; 8: 1394-408.
- Winthrop K, Bingham CO, Komocsar WJ, et al: Arthritis Res Ther 2019; 21: 102-112.
- Fleischmann R, Pangan AL, Song ICH, et al: Arthritis Rheumatol 2019; 71 (11): 1788-1800.
- Smolen JS, Pangan AL, Emery P, et al: Lancet 2019; 393: 2303-2311.
- Genovese MC, Kalunian K, Gottenberg JE, et al: JAMA 2019; 322 (4): 315-325.
InFo PAIN & GERIATURA 2020; 2(1): 32-35 (publicado 5.7.20, antes da impressão).