O carcinoma de células Merkel é uma forma rara mas agressiva de cancro de pele. São principalmente as pessoas mais velhas que são afectadas; a idade média no momento do diagnóstico é de 75 anos. Após a excisão cirúrgica do tumor primário, é recomendada a radioterapia adjuvante. Numa fase avançada ou em caso de metástases distantes, a imunoterapia deve ser considerada. O único anticorpo PD-L1 aprovado na Suíça até à data revolucionou as opções de tratamento.
“O carcinoma celular Merkel é extremamente heterogéneo na apresentação clínica”, informou Anja Wysocki, MD, Co-Chefe de Dermatologia no Hospital Cantonal de Lucerna [1]. Para além da forma nodular mais comum, raramente ocorrem variantes em forma de placa; estas encontram-se principalmente no tronco e nas extremidades proximais.
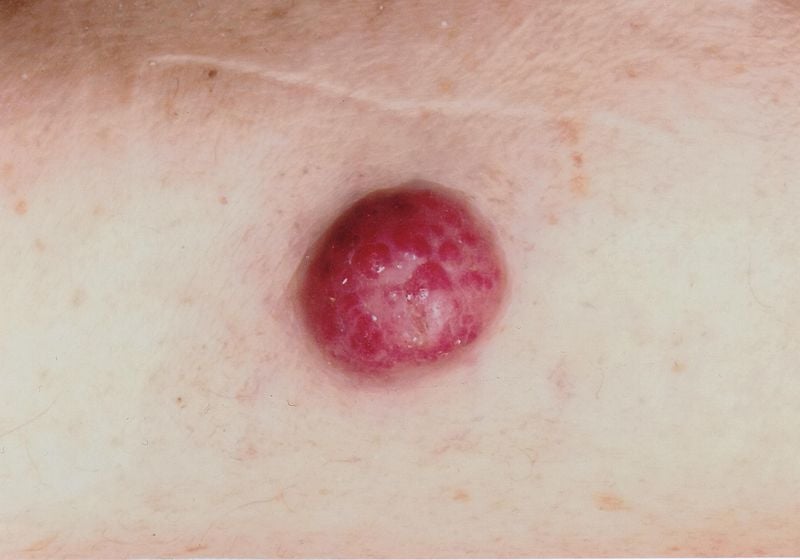
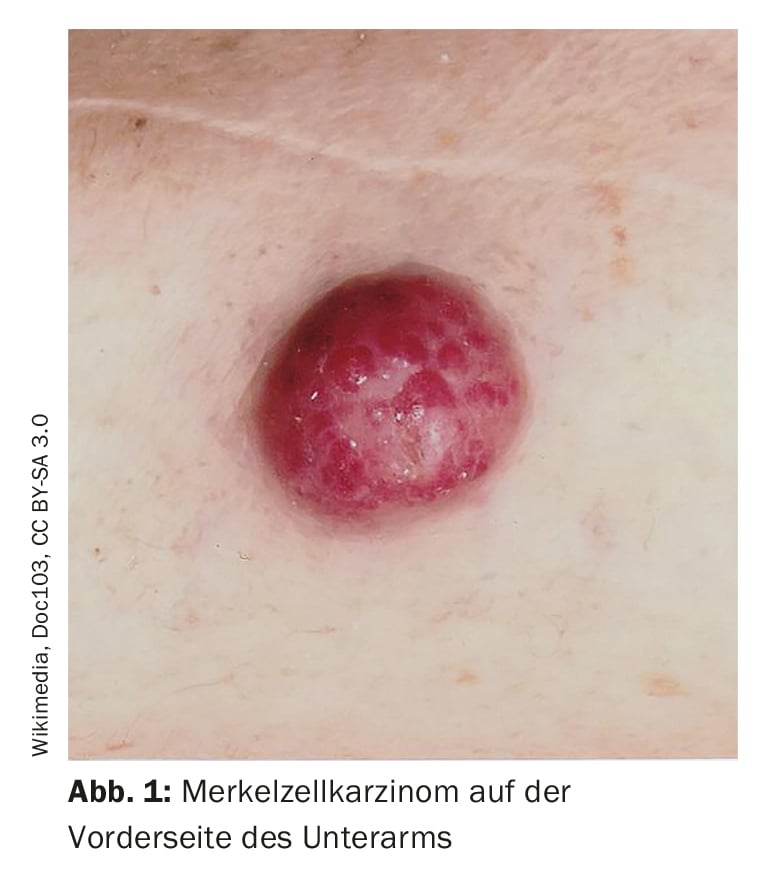
Os erros de diagnóstico são relativamente comuns, salientou o orador. Há confusão com foliculite, dermatofibromas, lipomas ou angiomas, por exemplo, e por vezes um carcinoma celular Merkel é erradamente interpretado como um carcinoma basocelular, espinalioma, melanoma ou sarcoma. O carcinoma de células Merkel (CCM) desenvolve-se rapidamente, geralmente durante semanas a alguns meses, como um tumor assintomático, protuberante, roxo-avermelhado com uma superfície lisa, geralmente brilhante (Fig. 1). Em dermoscopia, MCC presente como áreas cor-de-rosa, sem estrutura, com linhas finas brancas, em fases avançadas também se podem ver ulcerações, metástases de satélite são encontradas com mais frequência. A localização preferida do MCC é a pele cronicamente danificada pelo sol da região da cabeça e pescoço (mais de metade dos casos) e as extremidades distais (cerca de um terço dos casos) [2]. Para além da exposição aos UV como factor de risco significativo de CCM, existe uma associação com o poliomavírus de células Merkel (MCPyV) em mais de metade dos doentes [2].
Além da directriz em língua alemã s2k sobre o carcinoma celular Merkel por Becker et al. foi também publicada em 2022 uma directriz em língua inglesa [2,3]. O orador entrou em mais detalhes sobre algumas recomendações importantes de orientação sobre diagnóstico e terapia.
Como se reconhece o MCC de alto risco?
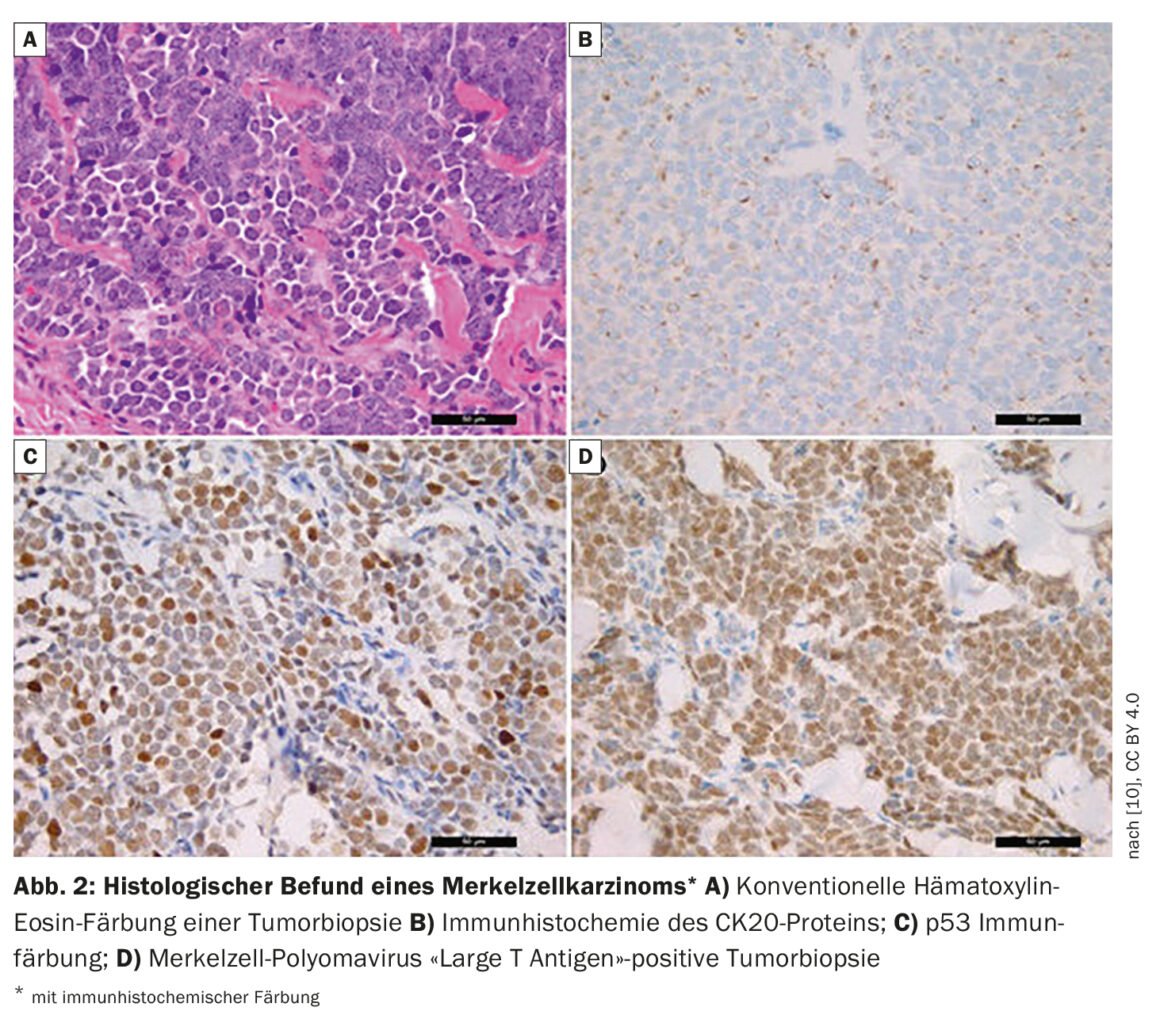
“Um quarto dos doentes já tem metástases linfonodais no diagnóstico inicial e 8% têm metástases distantes”, diz o Dr. Wysocki [1]. Em doentes com suspeita de CCM, é realizada uma biopsia ou excisão total, para além da inspecção. Se forem encontradas provas histológicas de MCC (caixa, Fig. 2) , é tirada uma FDG-PET/CT. Se os resultados forem negativos, ou seja, se o paciente for discreto em relação às metástases nos gânglios linfáticos ou outros órgãos, é realizada uma biopsia de gânglios linfáticos sentinela. As características dos doentes para CCM de alto risco incluem idade superior a 77 anos e exposição UV (o historial de PUVA causa um risco 100 vezes maior). Os homens têm um risco 2,5 vezes maior e as pessoas imunossuprimidas (VIH, malignidades hematológicas, receptores de transplantes de órgãos) também têm um risco acrescido. Outros critérios para um CCM de alto risco são o tamanho do tumor >2 cm, e a invasão profunda para além do tecido adiposo subcutâneo. O orador considera importante que a espessura do tumor e a profundidade de penetração sejam documentadas nos relatórios de patologia. Os pacientes já têm frequentemente gânglios linfáticos patologicamente detectáveis ou há invasão linfovascular. De acordo com as directrizes NCCN (National Comprehensive Cancer Network)2021, esta última é um critério de alto risco [4].
Excisão: é difícil definir uma distância segura óptima
Quanto mais cedo o carcinoma celular Merkel for detectado e completamente removido durante a cirurgia, melhor será o prognóstico. “A definição da margem de segurança no carcinoma celular Merkel é controversa”, sublinhou o Dr. Wysocki [1]. Alguns peritos sugerem que se tome uma distância de segurança de 1 cm e depois uma pós-radiação adjuvante. As distâncias de excisão <1 cm são também toleráveis se for administrada subsequentemente uma pós-radiação adjuvante. A cirurgia de Mohs é tão segura como a escolha de grandes margens de segurança para uma excisão local padrão. Este é o resultado de uma publicação de Carrasquillo et al. publicada em 2022. emergiu [5]. Se não utilizar o adjuvante pós-radiação, deve manter uma distância de segurança de cerca de 2 cm. “Mas a distância de segurança óptima é difícil de definir e deve ser determinada no quadro de tumores em cada caso individual”, salientou o orador [1].
Especialistas aconselham radioterapia adjuvante
Após a cirurgia, a radioterapia adjuvante do leito tumoral e das vias de drenagem linfática circundantes pode reduzir o risco de recidiva da doença. No entanto, a radioterapia adjuvante não só é importante para evitar uma recorrência, como também melhora a sobrevivência global (SO), a sobrevivência sem doenças e contraria a ocorrência de metástases distantes, declarou o Dr. Wysocki [1,3]. A irradiação adjuvante do leito do tumor primário deve ser realizada no prazo de 8 semanas após a excisão cirúrgica com uma dose total de 50-55 Gy para a localização do tumor na região da cabeça e pescoço ou 60-66 Gy para margens microscópicas e macroscópicas positivas. “Quando reexecutamos o tumor primário, também fazemos a biópsia do nó sentinela ao mesmo tempo, se a encenação não for notável”, informou o orador [1]. Isto porque cerca de um quarto dos doentes com CCM já têm metástases linfonodais microscópicas na altura do tumor primário. Contudo, isto é decidido numa base individual, dependendo do estado geral do paciente, da capacidade de ser anestesiado e da localização. No Hospital Cantonal de Lucerna, todos os casos de MCC são discutidos no conselho interdisciplinar de tumores. A radioterapia também pode ser utilizada para complementar a cirurgia e a terapia sistémica para tumores celulares metastáticos de Merkel. Uma recomendação baseada em consenso afirma que no caso de uma biopsia positiva dos gânglios linfáticos sentinela, a pós-radiação adjuvante deve ser realizada na região dos gânglios linfáticos ou combinada com a dissecção completa dos gânglios linfáticos.
anticorpos anti-PDL-1 avelumab – melhores resultados do que a quimioterapia
No passado, as quimioterapias só tinham um SO mediano de 9 meses na situação metastática. Os anticorpos anti-PDL-1 representam um importante passo em frente a este respeito, salientou o Dr. Wysocki [1]. O anticorpo anti-PD-L1 avelumab (Bavencio®) foi aprovado na Suíça para MCC metastásico (mCC) desde 2017 [6]. No ensaio fase II JAVELIN Merkel 2000, a avelumab foi avaliada em doentes que já tinham recebido pelo menos uma terapia citostática prévia para MCC [7,8].
Nos 88 pacientes estudados com avelumab de segunda linha, foi alcançada uma taxa de resposta objectiva de 33% após um seguimento mediano de 65 meses; a duração mediana da resposta foi de 40,5 meses [7]. A taxa média de sobrevivência sem progressão (PFS) foi de 2,7 meses e a taxa PFS após 24 meses foi de 26%. O SO mediano era de 12,6 meses e a taxa de SO era de 31% após 42 meses. Estes são resultados muito bons em comparação com a quimioterapia, resumiu o orador [2]. O estudo foi subsequentemente alargado para incluir doentes na primeira linha de terapia [9]. Dos 116 pacientes tratados com avelumab como primeira linha (seguimento mediano: 21,2 meses), 35 pacientes responderam durante um período de ≥6 meses, correspondendo a uma taxa de resposta duradoura (DRR) de 30,2%. A taxa de resposta global (ORR) foi de 39,7%. O PFS mediano foi de 4,1 meses e o OS de 1 ano foi cerca de 60%, o que foi ligeiramente superior ao do avelumab como terapia de primeira linha, o orador explicou [1,2]. Os efeitos secundários induzidos pela terapia ocorreram em 81% dos doentes tratados com avelumab, mas eram na sua maioria ligeiros (fadiga, fraqueza, comichão). Foram documentados efeitos secundários graves (na sua maioria de grau 3 ou 4) em 14,7% dos participantes do estudo.
Globalmente, a conclusão relativa ao avelumab como opção terapêutica é extremamente positiva. “Podemos realmente oferecer aos pacientes uma boa terapia de sistema”, resumiu o Dr. Wysocki [1]. A dose recomendada é de 10 mg/kg a cada quinze dias. O tratamento é dado até que ocorra uma progressão ou efeitos secundários graves. “Infelizmente, ainda não há aprovação para tratamento adjuvante ou neoadjuvante”, disse o orador [1].
Congresso: Dia da Derma Suíça
Literatura:
- “Update Merkel cell carcinoma”, Anja Wysocki, MD, Swiss Derma Day 12.01.2023
- Becker JC, et al: S2k guideline – Merkel cell carcinoma – Update 2022. J Dtsch Dermatol Ges 2023; 21(3): 305-317.
- Gauci ML, et al.: Fórum Europeu de Dermatologia (EDF), Associação Europeia de Dermato-Oncologia (EADO) e Organização Europeia para a Investigação e Tratamento do Cancro (EORTC). Diagnóstico e tratamento do carcinoma celular de Merkel: Directriz interdisciplinar europeia baseada no consenso – Actualização 2022. Eur J Cancer 2022; 171: 203-231.
- NCCN Clinical Practice Guidelines in Oncology: Merkel Cell Carcinoma, Versão 1.2021 – 18 de Fevereiro de 2021, https://merkelcell.org/wp-content/uploads/2021/02/NCCN-2021.pdf,(último acesso 21/03/2023).
- Carrasquillo OY, et al: Mohs Micrographic Surgery Versus Wide Local Excision in the Treatment of Merkel Cell Carcinoma: A Systematic Review. Dermatol Surg 2022; 48(2): 176-180.
- Informação sobre drogas, www.swissmedicinfo.ch,(último acesso 21.03.2023)
- D’Angelo SP, et al.: Avelumab in patients with previously treated metastatic Merkel cell carcinoma (JAVELIN Merkel 200): updated overall survival data after >5 years of follow-up. ESMO Open. 2021; 6(6): 10029.
- Kaufman HL, et al.: Updated efficacy of avelumab in patients with previously treated metastatic Merkel cell carcinoma after ≥ 1 year of follow-up: JAVELIN Merkel 200, a phase 2 clinical trial. J Immunother Cancer 2018; 6(1): 7.
- D’Angelo SP, et al: Avelumab de primeira linha numa coorte de 116 pacientes com carcinoma celular metastático de Merkel (JAVELIN Merkel 200): análises primárias e biomarcadores de um estudo de fase II. J Immunother Cancer 2021; 9(7): e002646.
- Mokánszki A, et al.: Molecular Profiling of Merkel Cell Polyomavirus-Associated Merkel Cell Carcinoma and Cutaneous Melanoma. Diagnostics 2021, 11, 212. https://doi.org/10.3390/diagnostics11020212, www.mdpi.com/2075-4418/11/2/212, (último acesso em 21.03.2023)
DERMATOLOGIE PRAXIS 2023; 33(2): 45–46
InFo ONKOLOGIE & HÄMATOLOGIE 2023; 11(2): 22–23