Un régime de traitement efficace de la maladie de Parkinson est étroitement lié à une approche personnalisée. Les défis sont différents selon l’âge de la maladie et le sous-type de la maladie. Outre le contrôle des symptômes non moteurs, l’accent est mis sur le traitement des troubles moteurs. C’est surtout à long terme que les combinaisons permettent d’obtenir un contrôle efficace.
Le syndrome parkinsonien idiopathique (SPI) est une maladie systémique qui peut provoquer de multiples symptômes dans de nombreux organes. La plupart d’entre eux sont de nature non-motrice. Il s’agit notamment de troubles psychologiques tels que la dépression, l’apathie ou l’anxiété, d’un dysfonctionnement olfactif, de troubles visuels, de symptômes gastro-intestinaux, de troubles du sommeil ou de troubles cardiovasculaires autonomes. En conséquence, les patients atteints de SPI présentent des résultats pathologiques dans 80 à 100 % des tests olfactifs quantitatifs, comme l’a montré le professeur Claudia Trenkwalder, Kassel (Allemagne). Environ 51% des personnes atteintes présentent une anosmie, 35% un trouble olfactif sévère et 14% un trouble olfactif modéré. Les troubles gastro-intestinaux tels que les troubles de la motilité peuvent être dus à différentes causes. Par exemple, une hyperperméabilité de la paroi intestinale, des dépôts d’alpha-synucléine dans le plexus myentérique ou des modifications de la composition du microbiote. En outre, 80% des personnes atteintes développent une dysphagie cliniquement significative au cours de la maladie. Elle s’accompagne d’une réduction significative de la qualité de vie, de difficultés à prendre les médicaments et d’une malnutrition. L’origine est multifactorielle, avec des voies dopaminergiques et non dopaminergiques du réseau central de la déglutition et des influences neuromusculaires périphériques. Des thérapies orthophoniques, une optimisation de la médication dopaminergique ainsi qu’un entraînement intensif de la force musculaire expiratoire peuvent aider dans ce cas, selon l’experte.
Coup d’œil sur les symptômes moteurs
Les symptômes moteurs de l’IPS comprennent la bradykinésie, la rigidité et les tremblements. Ce sont également eux qui déterminent le diagnostic. Lars Timmermann, de Giessen (Allemagne), a souligné qu’il est essentiel de détecter chaque sous-type et son évolution afin de mettre en place une gestion efficace du traitement. En effet, l’évolution clinique d’une maladie de Parkinson à tremblement dominant, par exemple, est nettement plus lente que celle des autres formes. Dans les premiers stades de la maladie, les traitements sont généralement très efficaces. Mais au fur et à mesure de l’évolution, les complications motrices s’aggravent et des troubles de la marche ou des dysarthries peuvent apparaître. La phase tardive se caractérise alors par une dépendance croissante et souvent une démence.
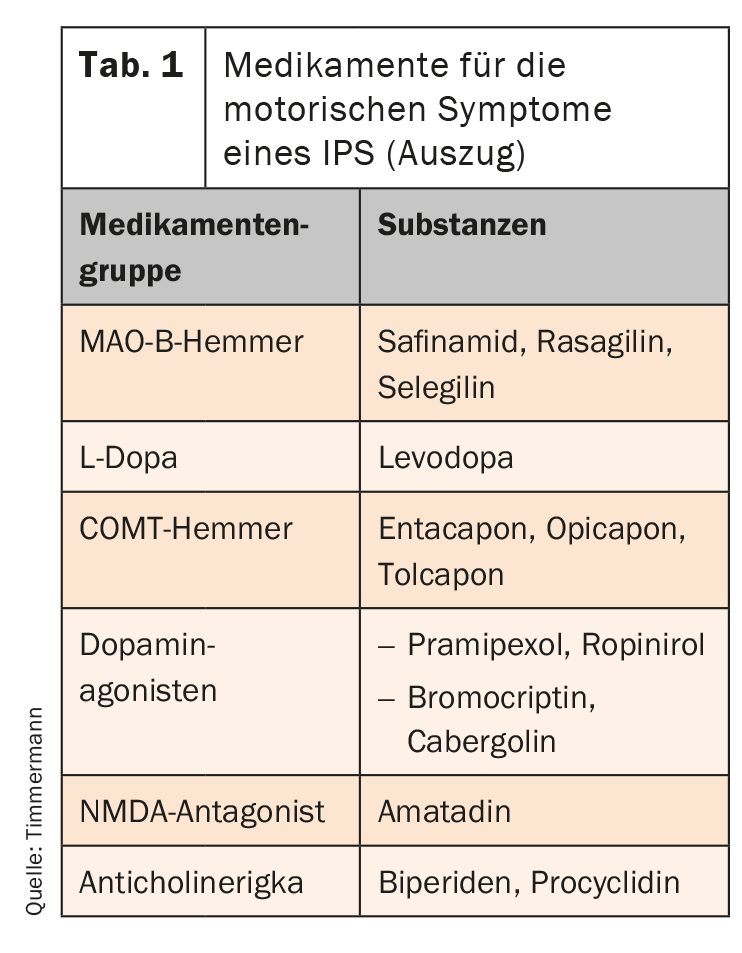
Le portefeuille pharmacologique s’est considérablement élargi au cours des dernières années. Six groupes de médicaments sont aujourd’hui disponibles (tableau 1). La L-Dopa est utilisée en premier lieu, également en combinaison avec un inhibiteur de la décarboxylase. Elle est transformée en dopamine dans le SNC et est donc disponible en tant que transmetteur. Toutefois, des fluctuations d’efficacité apparaissent lors d’une utilisation à long terme. Ils se manifestent d’abord par une détérioration en fin de dose, mais peuvent aller jusqu’à des états “off” imprévisibles. Un inhibiteur de la MAO-B, par exemple, peut alors être utilisé comme traitement complémentaire. En inhibant sélectivement la MAO-B, ils augmentent la concentration de dopamine et présentent une très bonne tolérance. Le safinamide présente un double mécanisme d’action. Une inhibition sélective et réversible de la monoamine oxydase (MAO)-B et une régulation simultanée de la libération de glutamate, qui augmente dans la maladie de Parkinson, permettent d’obtenir un contrôle équilibré et durable des symptômes moteurs.
Éviter l’escalade
Dans les cas particulièrement graves, lorsque les interventions pharmacologiques ne sont plus efficaces, le traitement peut être escaladé à l’aide de procédures de stimulation continue. La stimulation cérébrale profonde est actuellement la méthode la plus étudiée. Elle peut améliorer de manière significative un mauvais état de mobilité, des fluctuations et des dyskinésies. La perfusion jéjunale par pompe à L-dopa peut améliorer les fluctuations et l’administration sous-cutanée d’apomorphine par un système de pompe est surtout efficace sur les fluctuations, mais pas sur les dyskinésies.
Source : DGN 2020
InFo NEUROLOGIE & PSYCHIATRIE 2021, 19(1) : 21 (publié le 3.2.21, ahead of print)