Si un patient souffre d’apnée obstructive du sommeil (AOS), il est prédisposé à toute une série de comorbidités, des maladies cardiovasculaires aux maladies rénales, pulmonaires et neuropsychiatriques. Mais il existe également de plus en plus de preuves de l’effet inverse. Des chercheurs irlandais ont étudié les relations entre le SAOS et la comorbidité, en se concentrant sur les comorbidités qui montrent des preuves d’une relation bidirectionnelle.
Les mécanismes possibles associés au SAOS qui contribuent à la comorbidité comprennent l’hypoxie intermittente, la pression intrathoracique fluctuante et les micro-excitations récurrentes, qui sont des caractéristiques intégrales de l’apnée obstructive. Les conséquences cellulaires ou moléculaires peuvent inclure l’excitation sympathique, l’inflammation systémique et le stress oxydatif, en plus des dysfonctionnements métaboliques et endothéliaux, écrivent le Dr Margaret Gleeson et le Pr Walter McNicholas de l’École de médecine de l’University College Dublin et du Département de médecine respiratoire et du sommeil du groupe hospitalier St Vincent, Dublin [1]. Différents mécanismes peuvent prévaloir pour certaines comorbidités.
Obésité
Environ 70% des patients atteints de SAOS sont obèses, et inversement, 50% des personnes ayant un indice de masse corporelle (IMC) >40 ont un SAOS avec un indice d’apnée-hypopnée (IAH) >10. Un IMC plus élevé entraîne typiquement un SAOS plus sévère, en particulier chez les hommes et dans la population jeune. La plupart des recherches se sont concentrées sur l’obésité en tant que facteur de risque du SAOS, mais il existe des preuves que la relation est bidirectionnelle.
L’accumulation de graisse dans la région cervicale contribue au rétrécissement de l’oropharynx, ce qui entraîne un risque accru de collapsus des voies respiratoires supérieures. De plus, l’obésité abdominale réduit la traction des voies respiratoires supérieures, ce qui constitue une autre prédisposition au collapsus. En outre, l’hypoxie intermittente, qui est une caractéristique centrale du SAOS, déclenche une réaction pro-inflammatoire dans le tissu adipeux viscéral et contribue à la résistance à l’insuline.
L’effet thérapeutique est une perte de poids importante, notamment après une chirurgie bariatrique. En revanche, une intervention diététique seule n’a eu qu’un faible effet sur une période de suivi de 10 ans, écrivent les auteurs. Les patients souffrant de SAOS avec un petit volume maxillomandibulaire préexistant ont tiré le plus grand bénéfice d’une perte de poids, ce qui indique une interaction importante entre l’anatomie des voies respiratoires supérieures et les effets de l’obésité.
Les hommes en surpoids souffrant de SAOS perdent moins de poids en réponse à un programme d’alimentation et d’exercice d’un an que les hommes en surpoids similaires ne souffrant pas de SAOS. Alors que le traitement par pression positive continue (PPC) est très efficace pour contrôler le SAOS, paradoxalement, certains patients prennent du poids après le début du traitement par PPC, en particulier les femmes et les patients non-adipeux. Dans l’ensemble, la relation entre l’obésité et le SAOS est synergique en termes de risque cardiométabolique, et un grand nombre de mécanismes intermédiaires potentiels, y compris l’inflammation, le dysfonctionnement endothélial et la résistance à l’insuline, sont renforcés par la présence simultanée des deux maladies, constatent le Dr Gleeson et le Pr McNicholas.
BPCO
La relation entre la BPCO et le SAOS est décrite comme “complexe” par les auteurs : Certains facteurs, tels que l’hyperinflation pulmonaire, protègent contre le SAOS, tandis que d’autres, tels que la rétention de liquide, favorisent le SAOS. L’augmentation de l’IMC et les antécédents de tabagisme sont positivement corrélés à la probabilité de SAOS chez les patients atteints de BPCO (figure 1).
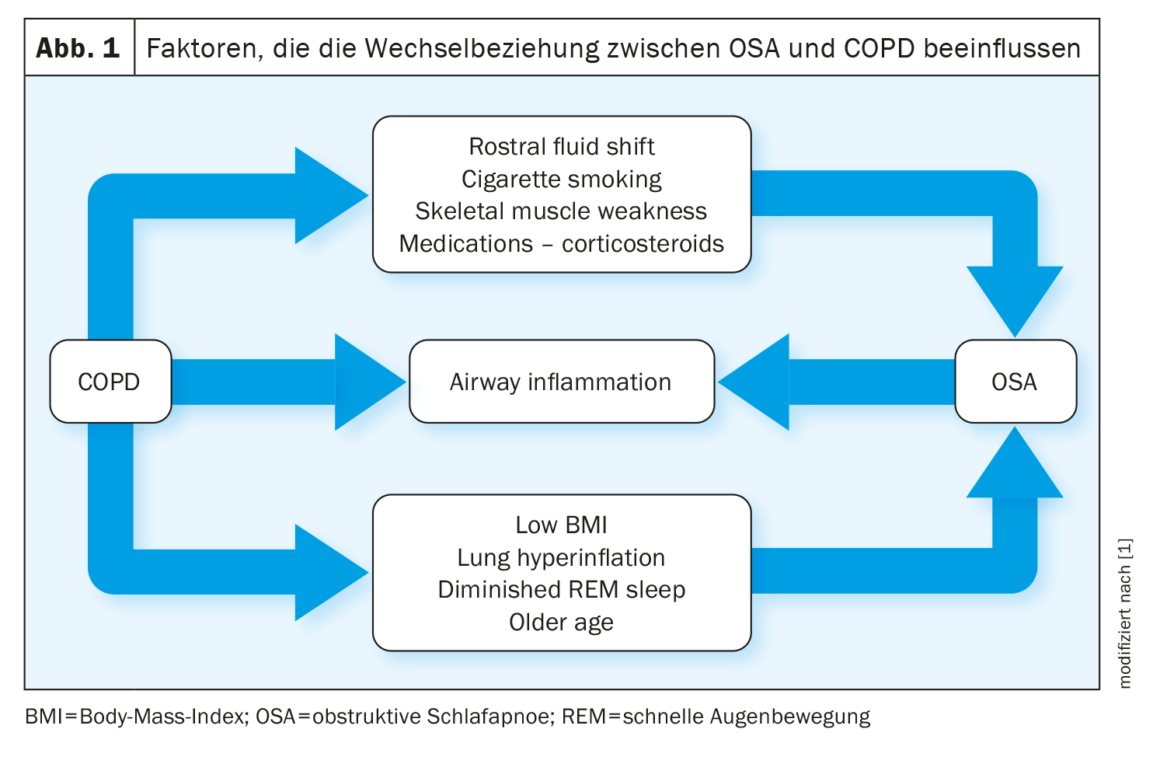
Les travaux sur le SAOS en tant que facteur de risque de la BPCO ont abouti à des conclusions divergentes. Ainsi, une étude montre une prévalence plus élevée de BPCO et d’asthme chez les patients atteints de SAOS par rapport à une population témoin correspondante, en particulier chez les femmes. L’AOS semble également aggraver l’inflammation des voies respiratoires inférieures chez les patients atteints de BPCO, et des études animales rapportent que l’hypoxie chronique intermittente contribue aux lésions pulmonaires chez la souris en induisant une inflammation et un stress oxydatif.
Les patients atteints de chevauchement BPCO-OSA traités par PPC à long terme ont une survie similaire à celle des patients atteints de BPCO seule, tandis que les patients atteints de chevauchement non traités par PPC ont une mortalité et un taux d’hospitalisation pour exacerbation aiguë plus élevés. Ces résultats soulignent l’importance de la détection d’un SAOS concomitant chez les patients atteints de BPCO sévère afin de choisir le traitement optimal, ont déclaré le Dr Gleeson et le Pr McNicholas.
Diabète
Le diabète et le SAOS coexistent souvent, et il y a de plus en plus de preuves d’une relation bidirectionnelle.
Plusieurs études de cohorte transversales ont montré une association indépendante avec le diabète de type 2 et la résistance à l’insuline, une estimation groupée du risque relatif de diabète à partir de neuf études originales était de 1,69 (IC à 95% 1,45-1,80). Les mécanismes du diabète et de la résistance à l’insuline comprennent l’hypoxie intermittente et la fragmentation du sommeil, qui entraînent une excitation sympathique et une inflammation. Une étude de cohorte portant sur 8678 adultes dépistés pour le SAOS a rapporté que les personnes souffrant d’un SAOS sévère avaient 30% de risques supplémentaires de développer un diabète par rapport aux personnes ne souffrant pas de SAOS, après un suivi moyen de 67 mois après contrôle des facteurs confondants.
Un traitement par PPC seul pendant 24,5 semaines n’a pas favorisé la sensibilité à l’insuline chez les patients non diabétiques atteints de SAOS, contrairement à la perte de poids. Les études de contrôle randomisées sur la PPC chez les diabétiques souffrant de SAOS ont donné des résultats mitigés.
Certaines conséquences du diabète sucré pourraient prédisposer au SAOS, y compris la neuropathie, qui affecte les muscles des voies respiratoires supérieures, et les troubles du contrôle respiratoire. Une étude prospective portant sur près de 300 000 professionnels de la santé a révélé que le SAOS était un facteur de risque indépendant du diabète émergent, mais qu’inversement, le diabète insulinodépendant était un facteur de risque indépendant du SAOS chez les femmes.
Hypertension
Alors que l’hypertension est très fréquente chez les patients souffrant de SAOS, la grande majorité des recherches sur ce sujet se sont concentrées sur le SAOS en tant que facteur de risque d’hypertension.
De nombreuses études épidémiologiques basées sur la population indiquent clairement que le SAOS est un facteur de risque d’hypertension systémique, souvent avec un profil de pression artérielle (PA) nocturne qui ne diminue pas. Les données de la Sleep Heart Health Study ont montré une association dose-dépendante avec l’hypertension prévalente et la Wisconsin Cohort Study a rapporté une présence plus importante d’hypertension associée au SAOS après 4 ans de suivi. Les données de l’étude ESADA, à laquelle ont participé 4372 patients atteints de SAOS léger, ont trouvé une association indépendante avec l’hypertension prévalente, et une étude prospective portant sur 744 patients atteints de SAOS léger/modéré et normotensifs au départ a rapporté une association avec l’hypertension émergente à 9 ans chez les patients <60 ans.
Il existe des preuves limitées que l’hypertension peut prédisposer au SAOS. Les données issues d’études sur les animaux et les petits humains indiquent que les variations de la pression artérielle peuvent affecter le tonus des voies respiratoires supérieures en présentant des changements inhibiteurs dans l’électromyogramme (EMG). Cela indique que la réduction de la pression artérielle peut améliorer le débit d’air et réduire la sévérité du SAOS.
Insuffisance cardiaque
La relation bidirectionnelle entre l’apnée du sommeil et l’insuffisance cardiaque peut s’expliquer en partie par des facteurs de risque communs tels que l’âge, un IMC élevé et un mode de vie sédentaire. Les mécanismes d’unification, notamment la rétention et la redistribution des fluides, entraînent une relation bidirectionnelle dans laquelle il peut être difficile d’établir la cause et l’effet.
Le SAOS est associé à un risque accru d’apparition et de progression de la maladie coronarienne, de l’insuffisance cardiaque congestive et de la mortalité cardiovasculaire. Il peut induire un remodelage cardiaque, ce qui contribue à l’insuffisance cardiaque, et peut altérer la fonction cardiaque de manière aiguë, aggravant ainsi les épisodes d’insuffisance cardiaque aiguë. Les patients dont l’IAH est plus élevé présentent un degré plus important de dysfonctionnement diastolique. Les patients sans SAOS ou avec un SAOS léger avaient une incidence d’événements mortels réduite de 50% par rapport aux patients avec une maladie modérée ou sévère non traitée. Le SAOS peut avoir un impact négatif sur le pronostic de l’insuffisance cardiaque et est associé à une augmentation des hospitalisations et de la mortalité après la sortie chez les patients atteints de SAOS hospitalisés.
Le traitement du SAOS par PPC améliore les critères cardiovasculaires intermédiaires tels que la pression artérielle, la fréquence et le rythme cardiaques et la fraction d’éjection. Dans une étude, on a constaté une augmentation de 9% de la fraction d’éjection du ventricule gauche (FEVG), en plus d’une diminution diurne de la fréquence cardiaque et de la pression artérielle, ce qui pourrait refléter une réduction de l’excrétion urinaire nocturne d’épinéphrine. Cependant, alors qu’une amélioration physiologique immédiate a été démontrée avec le traitement par PPC, il n’existe pas de données sur les effets à long terme démontrant une amélioration de la mortalité et de la survie sans transplantation.
Dans un essai contrôlé randomisé (ECR) portant sur des patients atteints de SAOS sévère, la restriction sodée et le traitement diurétique n’ont entraîné qu’une amélioration limitée de l’IAH, ce qui suggère que l’accumulation de liquide n’explique que partiellement l’étiologie du SAOS en cas d’insuffisance cardiaque. Lors d’une exacerbation aiguë d’une insuffisance cardiaque diastolique hypertensive, le traitement diurétique a entraîné une réduction du poids corporel, une augmentation du calibre pharyngé et une diminution de 17 de l’IAH. Inversement, dans une étude d’observation, le traitement diurétique a amélioré le SAOS chez les patients obèses ou hypertendus, mais aucune amélioration significative de la sévérité du SAOS n’a été observée chez les patients souffrant d’insuffisance cardiaque.
Dysfonctionnement rénal
Les connaissances actuelles indiquent que les maladies rénales et l’apnée du sommeil ont une relation bidirectionnelle. La prévalence du SAOS est jusqu’à dix fois plus élevée chez les patients atteints de maladie rénale chronique (MRC) que dans la population générale, mais le SAOS reste sous-détecté chez les MRC, expliquent les chercheurs irlandais. L’incidence du SAOS augmente proportionnellement à la sévérité de l’IRC, ce qui renforce son rôle dans la pathogenèse. Une étude clinique a rapporté une prévalence du SAOS de 27%, 41% et 57% respectivement chez les patients avec DFGe >60, les patients avec DFGe <60 mais sans traitement de substitution rénale, et les patients sous hémodialyse.
Les facteurs qui contribuent au SAOS dans l’IRC comprennent une sensibilité accrue au chimioréflexe, une diminution de la clairance des toxines urémiques et une hypervolémie. Dans un groupe de 40 patients hémodialysés, 70% avaient un IAH >15 et un volume de liquide extracellulaire plus important dans tout le corps, y compris les volumes du cou, du thorax et des jambes, bien qu’il n’y ait pas de différence d’IMC par rapport à ceux ayant un IAH <5.
Une surcharge hydrique accrue prédit une aggravation du SAOS, et un traitement agressif de l’insuffisance rénale terminale (IRT) peut en réduire la sévérité. La dialyse quotidienne, la dialyse nocturne et la dialyse péritonéale automatisée nocturne ont été traitées dans des études d’observation avec des avantages pour le SAOS liés à la réduction de l’IAH, à la réduction de la congestion des voies respiratoires et à l’amélioration de la clairance urémique. La transplantation rénale inverse bon nombre des complications métaboliques de l’IRT et ralentit la progression des comorbidités associées, mais son rôle dans les bénéfices du SAOS reste sans résultat.
Alors que le SAOS peut survenir à la suite d’une IRC, il existe des preuves qu’il peut également contribuer à l’IRC et au déclin progressif du DFG. Le SAOS a également été associé à une morbidité et une mortalité plus élevées chez les patients atteints d’IRT, ce qui peut être lié aux effets aggravants des comorbidités telles que les maladies cardiovasculaires et cérébrovasculaires, y compris les troubles du rythme, les maladies coronariennes et les accidents vasculaires cérébraux.
Les maladies rénales induites par le SAOS peuvent être expliquées par deux mécanismes primaires : L’hypertension et l’hypoxie intrarénale avec hyperfiltration glomérulaire. La médullaire rénale est particulièrement sensible à l’hypoxie, ce qui provoque un stress oxydatif, une inflammation systémique et un dysfonctionnement endothélial, et conduit à une lésion tubulo-interstitielle, qui est la caractéristique de l’IRC. Les épisodes d’apnée stimulent le système nerveux sympathique et le système SRAA, ce qui entraîne une hypertension systémique et glomérulaire, des lésions vasculaires et une rigidité de la paroi artérielle, aboutissant à une ischémie rénale.
Dans une étude, le traitement par PPC a eu un effet positif initial sur l’hémodynamique rénale chez des patients ayant une fonction rénale normale, ce qui suggère un bénéfice dans le ralentissement des lésions rénales. Cependant, le rôle de la PPC dans l’atténuation de la progression du dysfonctionnement rénal dans le SAOS est incertain, peu d’études se concentrent sur les patients avec une IRC existante.
Accident vasculaire cérébral
Les troubles respiratoires du sommeil (TRS) sont fréquents chez les patients ayant subi un accident vasculaire cérébral. On ne sait pas si le SAOS constitue un facteur provocateur, en potentialisant des facteurs de risque vasculaire connus tels que l’hypertension, ou s’il est la conséquence d’une lésion cérébrale liée à un accident vasculaire cérébral.
Le SAOS est un facteur de risque d’accident vasculaire cérébral et multiplie par environ deux l’incidence des accidents vasculaires cérébraux. Une méta-analyse a identifié une incidence accrue d’accidents vasculaires cérébraux chez les patients souffrant de SAOS non traité, même en tenant compte des facteurs de confusion potentiels tels que l’âge, l’IMC, le diabète et l’hypertension. Des études d’observation indiquent que la PPC réduit le risque d’accident vasculaire cérébral chez les patients souffrant de SAOS, en particulier chez les patients qui suivent le traitement. Des ECR ont suggéré qu’une observance du traitement de >4 h pourrait apporter un certain bénéfice.
La prévalence du SAOS est élevée en cas d’AVC, un tiers des survivants documentant un IAH >30, bien qu’il soit possible qu’un AVC révèle un SAOS préexistant. L’architecture du sommeil après un AVC peut affecter les mécanismes de contrôle de la respiration au niveau central, mais plus particulièrement, un AVC peut affecter la fonction musculaire des voies respiratoires supérieures, augmentant ainsi la possibilité d’effondrement.
Dépression
La dépression et le SAOS peuvent présenter des symptômes similaires, notamment des difficultés de concentration, des troubles de la mémoire et de la fatigue, qui compliquent leur évaluation clinique et leur diagnostic (figure 2). Les troubles du sommeil sont un symptôme auto-déclaré fréquent de la dépression et peuvent constituer un symptôme prédictif du développement ultérieur de la dépression. Une théorie plus récente suggère que les personnes souffrant de dépression ont un risque plus élevé de SAOS plus tard dans leur vie. Les mécanismes attendus qui sous-tendent chaque processus comprennent la fragmentation du sommeil, les réveils fréquents et les épisodes d’hypoxie intermittents qui entraînent une hypoperfusion cérébrale et un dysfonctionnement des neurotransmetteurs. Malgré la plausibilité biologique, il existe peu de recherches sur d’éventuelles relations bidirectionnelles, et les résultats ont été contradictoires.
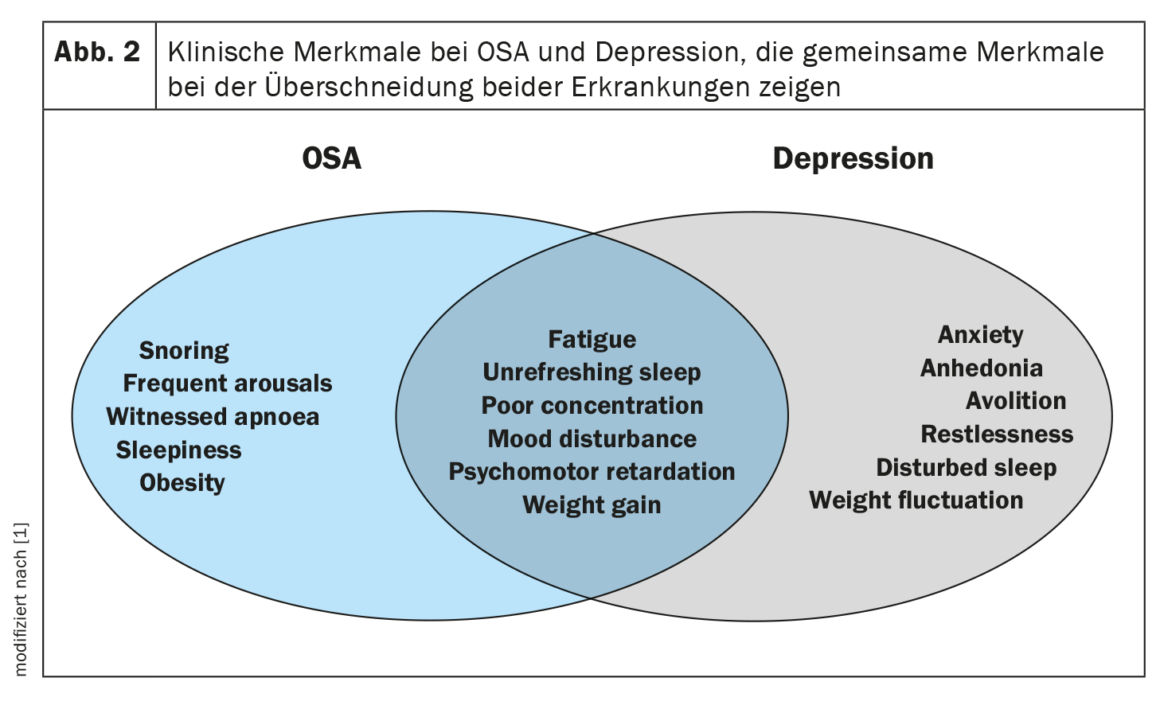
Dans les cohortes cliniques, la prévalence de la dépression dans le SAOS varie de 20 à 40%, et il semble y avoir une augmentation de l’odds ratio de la dépression avec la sévérité de la SDB. Cependant, d’autres études de moindre envergure ont rapporté que la présence ou la sévérité du SAOS n’étaient pas des prédicteurs indépendants des scores de dépression ou des hospitalisations subséquentes.
Un traitement du SAOS par PPC pendant 5 heures ou plus par nuit pendant au moins 3 mois a amélioré les symptômes dépressifs, y compris les idées suicidaires, indépendamment de l’utilisation d’antidépresseurs.
Inversement, la dépression n’a pas encore été bien étudiée en tant que cause potentielle du SAOS. Les rapports de prévalence indiquent que 15% des patients psychiatriques hospitalisés souffrant de dépression majeure (MDD) présentent un IAH élevé lors de la polysomnographie de nuit et que 18% des patients souffrant de MDD répondent également aux critères diagnostiques du SAOS.
Une revue d’études prospectives portant sur cinq antidépresseurs différents a révélé que seuls deux d’entre eux avaient un impact positif sur la réduction de l’IAH, mais aucun sur la somnolence ou la qualité du sommeil. En outre, un SAOS non diagnostiqué peut s’aggraver avec certains traitements pharmacologiques ciblant la dépression, dont la prise de poids est un facteur possible. Les benzodiazépines peuvent augmenter la fréquence et la durée des épisodes d’apnée en affectant le tonus des voies aériennes supérieures et le seuil d’excitation.
Littérature :
- Gleeson M, McNicholas WT : Relations bidirectionnelles de la comorbidité avec l’apnée obstructive du sommeil. Eur Respir Rev 2022 ; 31 : 210256 ; doi : 10.1183/16000617.0256-2021.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2023 ; 5(1) : 24-25











