La schizophrénie est due, entre autres, à un dérèglement dopaminergique. Tous les antipsychotiques approuvés pour leur traitement sont des antagonistes des récepteurs dopaminergiques, en particulier des récepteurs D2 et D3. Les trois agonistes partiels de la dopamine D2 aripiprazole, brexpiprazole et cariprazine sont des antipsychotiques significativement meilleurs que le placebo dans le traitement médicamenteux des troubles schizophréniques.
Le mécanisme d’action des antipsychotiques actuellement introduits soutient l’hypothèse neurobiologique selon laquelle la schizophrénie est caractérisée, entre autres, par un dérèglement dopaminergique [1]. Tous les antipsychotiques approuvés pour leur traitement sont des antagonistes des récepteurs de la dopamine, en particulier des récepteurs D2 et D3. Au cours des 20 dernières années, trois nouveaux antipsychotiques ont été introduits en Suisse pour le traitement de la schizophrénie; ils appartiennent au groupe des agonistes partiels des récepteurs dopaminergiques D2: aripiprazole, brexpiprazole et cariprazine. Leurs propriétés pharmacologiques et cliniques ont été décrites en détail par Eich et Gertsch dans cette revue en 2019 [2]. Le présent article vise à mettre à jour la littérature publiée depuis lors, mais aussi à présenter certains sujets de manière plus approfondie, en mettant l’accent sur le brexpiprazole. Cependant, les recommandations de traitement et les examens récents [3–5] montrent également que les données relatives aux nouveaux représentants de ce groupe de médicaments, le brexpiprazole et la cariprazine, sont encore rares par rapport à celles de l’aripiprazole, qui est disponible depuis près de 20 ans. Il est particulièrement frappant de constater que les comparaisons directes entre ces trois antipsychotiques sont extrêmement rares, tant au niveau de leur efficacité clinique que de leur profil d’effets secondaires (tolérance, sécurité) [6].
Hypothèses neurobiologiques de la schizophrénie: Aspects pharmacologiques
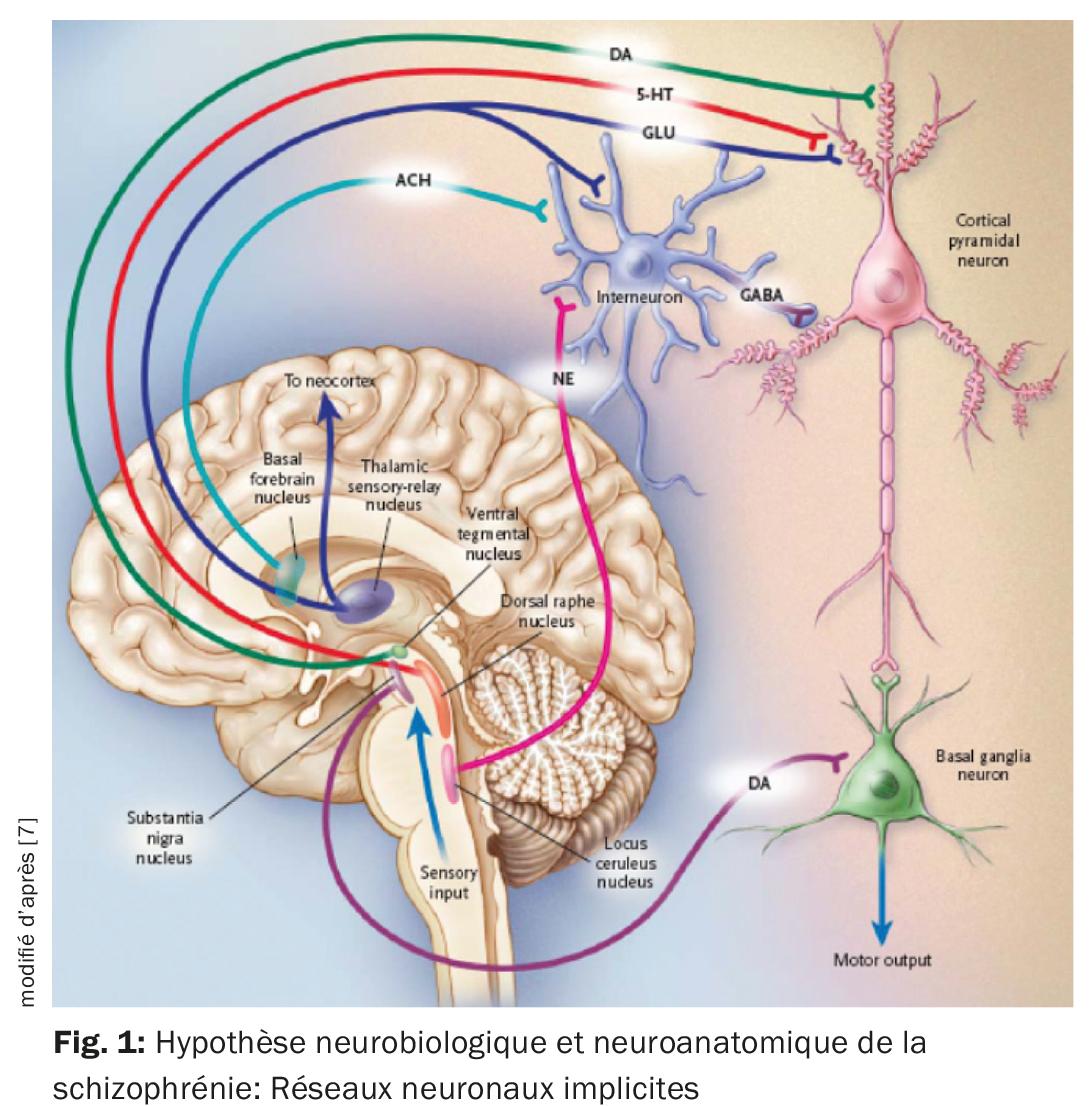
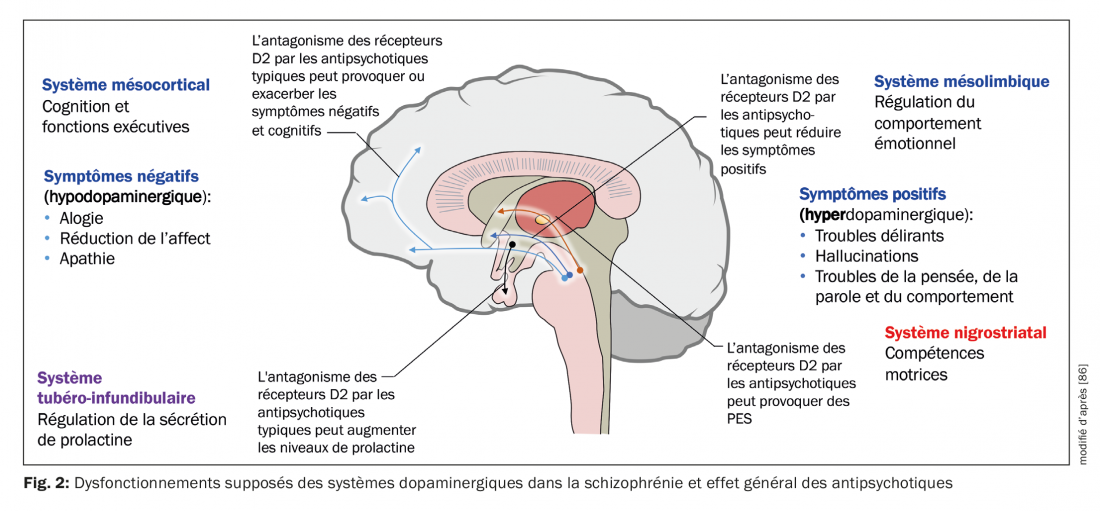
Une hypothèse neurobiologique de la schizophrénie est basée sur l’hypothèse que le thalamus ne remplit plus son rôle d’organe de filtrage des stimuli externes (fig. 1) [7]. Les informations sensorielles sont conduites des noyaux thalamiques aux neurones pyramidaux du cortex limbique et du néocortex par des afférences stimulantes glutamatergiques. Une réponse excessive des neurones pyramidaux pourrait être le mécanisme responsable de la psychose, ce qui correspond à l’hyper-stimulation observée chez les patients schizophrènes. Différents noyaux sous-corticaux facilitent la réponse des neurones. Le dysfonctionnement de divers neurotransmetteurs tels que le glutamate, la dopamine (DA), le GABA, la sérotonine (5-HT) et la noradrénaline est postulé en relation avec l’éthiopathogénie de la schizophrénie [7,8]. Il est possible que le système glutamatergique soit principalement affecté, mais les médicaments qui inhibent sélectivement la neurotransmission glutamatergique et qui se sont avérés utiles dans le traitement de la psychose sont encore en phase de développement [9]. Or, tous les antipsychotiques actuellement disponibles ont un mécanisme dopaminergique mais pas tous un mécanisme sérotoninergique. La DA de l’aire tegmentale ventrale active les récepteurs D1 et D2, qui augmentent la réponse neuronale au glutamate. La sérotonine provenant du noyau du raphé dorsal active les récepteurs 5-HT2A, ce qui facilite la libération de glutamate par les terminaux nerveux. Indirectement, l’activité glutamatergique peut être réduite via un effet sur la 5-HT et la DA. Les antipsychotiques inhibent généralement l’effet stimulant de la DA et de la 5-HT, y compris celui de la DA de la substantia nigra dans les ganglions de la base, et ils provoquent ainsi des troubles moteurs (fig. 2). Pour préciser le rôle des différentes régions anantomiques, il existe désormais des preuves d’une activité dopaminergique accrue dans la zone mésolimbique. Il serait responsable de la symptomatologie positive ou psychotique telle que les hallucinations et les délires, tandis qu’une activité réduite dans le système mésocortical avec des projections vers le cortex frontal correspondrait à une neurotransmission hypodopaminergique. Elle serait responsable de symptômes négatifs tels que l’apathie, l’anhédonie, le retrait social et le manque de réflexion (fig. 2) [10].
Ce bref aperçu néglige la discussion sur le rôle des récepteurs D1, D3, 5-HT1a et 5-HT2 et leur pharmacologie [11]. Il est maintenant frappant de constater que la cariprazine a une affinité plus élevée pour les récepteurs D3 que l’aripiprazole et le brexpiprazole [12,13]. La cariprazine a une affinité pour les récepteurs D3 qui est 10 fois plus élevée que pour les récepteurs D2. Il existe maintenant une hypothèse, basée sur des modèles animaux, selon laquelle les antagonistes des récepteurs D3 influencent favorablement les troubles cognitifs en augmentant la transmission dopaminergique dans le cortex préfrontal. En termes de mécanisme, la cariprazine, par exemple, annule une déficience déclenchée par la phénycyclidine (PCP), un antagoniste des récepteurs NMDA du glutamate. Cependant, l’antagonisme D3 seul n’est pas suffisant pour obtenir un effet antipsychotique. D’autre part, il est rappelé que certains antipsychotiques tels que la lurasidone, l’amisulpride, le brexpiprazole et, dans une moindre mesure, l’aripiprazole sont de puissants antagonistes des récepteurs 5-HT7 par rapport à d’autres antipsychotiques dont la cariprazine, mécanisme qui expliquerait également les effets bénéfiques sur les troubles cognitifs [5,14,15].
Pharmacologie des agonistes partiels des récepteurs dopaminergiques D2
Or, alors que la plupart des antipsychotiques sont des antagonistes purs de la dopamine, les agonistes D2 partiels ont dans une certaine mesure la propriété d’agir comme des agonistes lorsque l’activité dopaminergique est faible, comme on pense qu’elle l’est dans le système mésocortical dans la schizophrénie, et comme des antagonistes lorsque l’activité dopaminergique est élevée, comme elle l’est dans le système mésolimbique [10]. C’est pourquoi certains auteurs qualifient l’effet de ces médicaments de «stabilisateurs du système dopaminergique» (DSS), peut-être dans le sens d’une stratégie marketing [16].
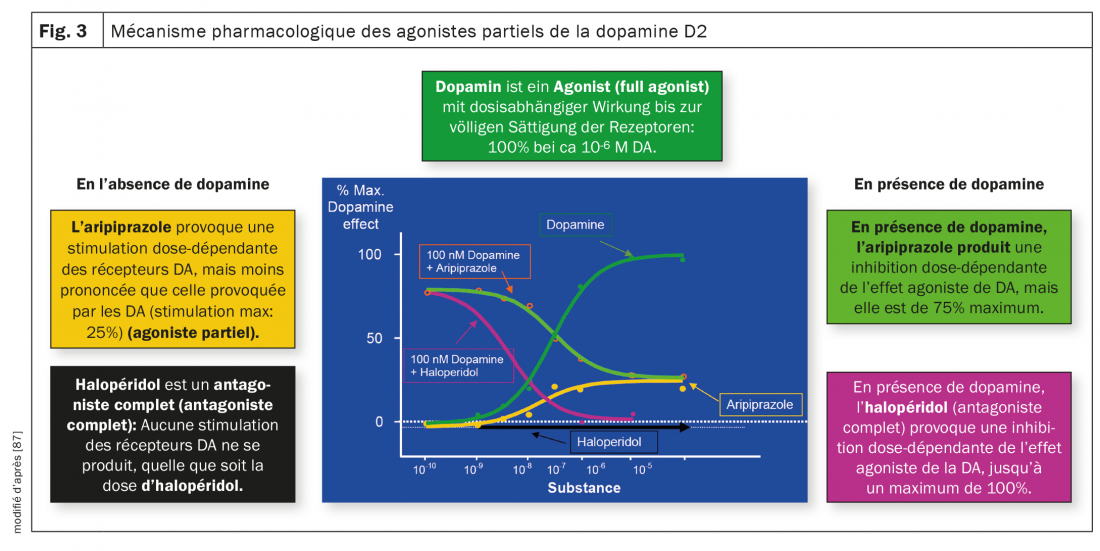
Figure 3 illustre les différences entre les antagonistes et les agonistes partiels. La dopamine elle-même est un agoniste, l’antipsychotique classique halopéridol est un antagoniste sans aucun effet agoniste sur les récepteurs de la dopamine, tandis que l’aripiprazole a un effet agoniste sur ces récepteurs en l’absence ou à faible concentration de dopamine jusqu’à un maximum de 25%. En présence de dopamine, l’halopéridol a également un effet purement antagoniste grâce à sa plus forte affinité pour ces récepteurs, tandis que l’activité de l’aripiprazole est antagoniste avec une inhibition maximale de 75%. Le brexpiprazole et la cariprazine ont un effet similaire à celui de l’aripiprazole. Comme mentionné ci-dessus, la cariprazine se distingue des deux autres antipsychotiques apparentés par son affinité particulièrement prononcée pour les récepteurs D3 et son activité agoniste partielle au niveau de ce récepteur, ce qui pourrait également expliquer un effet sur les symptômes négatifs et les troubles cognitifs.
L’hypothèse de la noradrénaline dans la schizophrénie: Aspects pharmacologiques
Bien que l’aripiprazole, le brexpiprazole et la cariprazine partagent la propriété d’être des agonistes D2 partiels, leur effet sur le système noradrénergique est différent. La première question est de savoir s’il existe des preuves de son dysfonctionnement dans les troubles schizophréniques et si l’effet thérapeutique des antipsychotiques peut s’expliquer par ce système de neurotransmetteurs. On suppose que l’hyperactivité du système noradrénergique plutôt que celle du système dopaminergique joue un rôle dans le développement des symptômes positifs, tandis que l’hypoactivité du système noradrénergique est déterminante pour les symptômes négatifs [17]. Récemment, un groupe d’auteurs a formulé de manière extensive l’hypothèse selon laquelle la phénoménologie de la schizophrénie, en particulier les symptômes cognitifs, s’explique par une interaction anormale entre la susceptibilité génétique et le dysfonctionnement noradrénergique induit par le stress du locus coeruleus (un noyau de neurones noradrénergiques) [18]. La recherche actuelle sur la schizophrénie est effectivement axée sur les aspects de la génétique – du développement (phase de vie prénatale et postnatale, enfance, adolescence, âge adulte) – du stress, mais il est également vrai que l’hypothèse noradrénergique n’est pas un point focal pour le moment et qu’elle ne doit en aucun cas être considérée isolément des autres hypothèses.
Cependant, il existe également des résultats pharmacologiques intéressants sur l’hypothèse noradrénergique de la schizophrénie. Une méta-analyse suggère que la comédication («augmentation») avec les α2-antagonistesmirtazapine ou mianserin améliore l’efficacité des antagonistes D2 dans le traitement de la schizophrénie en réduisant les symptômes négatifs [19]. Selon une revue de 2020, pratiquement tous les antipsychotiques, y compris l’aripiprazole et le brexpiparzole, sont des antagonistes des récepteurs α1, α2a et α2b, mais les données correspondantes font défaut pour la cariprazine [20]. Jusqu’à présent, ces propriétés pharmacologiques ont surtout été associées à des effets secondaires. En fait, l’asénapine (au niveau des récepteurs α2b) et le brexpiprazole (au niveau des récepteurs α2c) se distinguent chacun comme les antagonistes les plus puissants. Les études animales permettent d’émettre l’hypothèse qu’un blocage des récepteurs α1contribue à l’amélioration des symptômes positifs et celui des récepteurs α2à l’amélioration des symptômes négatifs et cognitifs. L’antagonisme α2c serait possiblement responsable des effets procognitifs et de l’amélioration de l’anxiété et de la dépression [21]. Ces récepteurs ont une distribution différente dans le cerveau: les récepteurs α2 sont répandus et plus fréquents (90%) que les récepteurs α2c (10%), qui sont principalement localisés dans le striatum, l’hippocampe et le cortex [22].
Métabolisme et pharmacocinétique de l’aripiprazole, du brexpiprazole et de la cariprazine
Les trois agonistes partiels D2 sont des dérivés de la pipérazine structurellement similaires, mais ils diffèrent dans leur métabolisme (fig. 4, tab. 1). On remarque que la cariprazine est l’isomère trans d’un composé chimique, l’isomère cis étant moins actif pharmacologiquement [23]. L’aripiprazole et le brexpiprazole n’ont pas une structure qui entraîne une telle isomérie cis-trans.
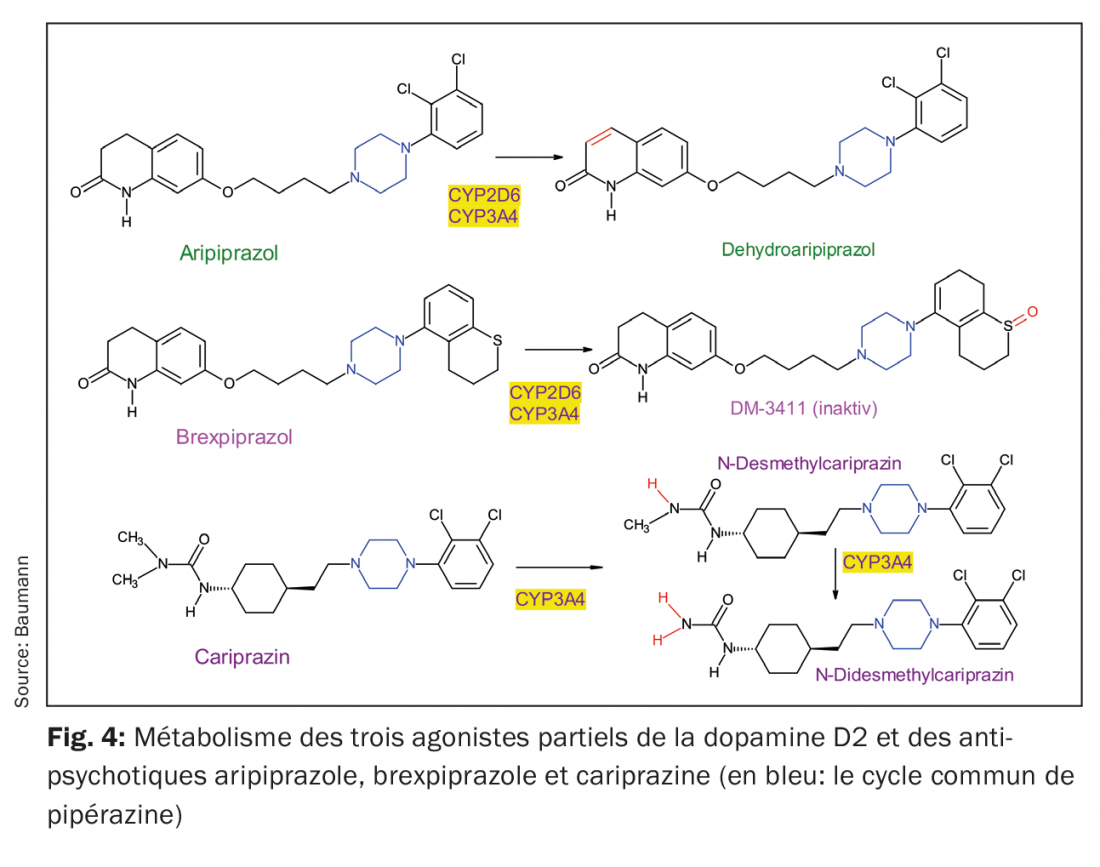
L’aripiprazole est déshydraté en déhydroaripiprazole, qui exerce une activité pharmacologique similaire à celle de sa substance mère. Le Brexpiprazole est sulfoxydé par le CYP2D6 en un métabolite (DM-3411) [24], qui est cependant significativement moins actif pharmacologiquement que la substance mère et ne pénètre pas non plus dans le cerveau [24]. Cela n’était pas nécessairement prévisible puisque, par exemple, le métabolite sulfoxyde de la thioridazine, la mésoridazine, était également sur le marché comme antipsychotique. La biotransformation de la cariprazine est plus compliquée car, bien que la desméthylcariprazine, pharmacologiquement active, soit formée par une N-déméthylation initiale, ses concentrations à l’équilibre dans le sang des patients traités par la cariprazine sont nettement inférieures à celles de la substance mère et du métabolite suivant, qui est également le produit d’une N-déméthylation: Il s’agit de la N-didesméthylcariprazine, pharmacologiquement active, dont les concentrations à l’état d’équilibre dépassent celles de la cariprazine en raison de sa demi-vie d’élimination particulièrement longue (tab. 1) [25,26].
Étant donné qu’il n’existe pratiquement aucune publication à ce jour sur la signification clinique du polymorphisme génétique du CYP2D6 dans le traitement des patients par le brexpiprazole (ou la cariprazine), le sujet ne sera que brièvement abordé ici. Non seulement l’aripiprazole mais aussi son métabolite actif sont des substrats du CYP2D6; leurs taux plasmatiques dépendent fortement du génotype du CYP2D6. Cela explique la recommandation formulée dans des articles de synthèse et des méta-analyses récentes d’envisager le génotypage du CYP2D6 chez les patients traités par aripiprazole dans certaines conditions. Ceci est également vrai pour le brexpiprazole, également un substrat du CYP2D6, mais les données sont limitées [27-30]. Ainsi, à part une étude japonaise, il n’y a pas d’études pharmacogénétiques publiées sur le brexpiprazole: Elle n’a étudié que les métaboliseurs normaux (extensifs (EM) et intermédiaires (IM) des substrats du CYP2D6, car il n’existe pratiquement pas de couples présentant une déficience génétique du CYP2D6 (métaboliseurs pauvres (PM)) dans ce groupe de personnes. Une étude basée sur un modèle pharmacocinétique doit également être mentionnée. Une simulation est utilisée pour comparer la pharmacocinétique du brexpiprazole chez les métaboliseurs dits «extensifs» (normaux) avec la cinétique chez les PM telle que calculée selon le modèle théorique [31]. Ces études confirment la recommandation d’adapter la dose de brexpiprazole au génotype CYP2D6 du patient. Cela signifie qu’il faut prescrire environ la moitié de la dose habituelle pour les patients présentant une déficience génétique ou une dose plus élevée pour les métaboliseurs ultra-rapides. La dose des deux antipsychotiques doit également être diminuée en cas de comédication par des inhibiteurs puissants du CYP2D6 tels que la fluoxétine ou la paroxétine. Pour les trois agonistes partiels D2, la dose doit être ajustée à la baisse en cas de comédication avec des inhibiteurs du CYP3A4 tels que le kétoconazole, et augmentée si des médicaments inducteurs du CYP3A4 tels que la carbamazépine ou certains extraits de millepertuis contenant de l’hyperforine sont prévus en comédication. La plupart des données n’ont été recueillies que pour l’aripiprazole [32,33]. Le brexpiprazole lui-même inhibe modérément le CYP2B6, et faiblement les CYP2C9, CYP2C19, CYP2D6 et CYP3A4, et son effet inhibiteur sur les molécules transporteuses telles que la P-glycoprotéine (P-gP) est également peu pertinent d’un point de vue clinique selon les expériences in vitro. Le brexpiprazole n’est pas non plus un substrat de la P-gP [34].
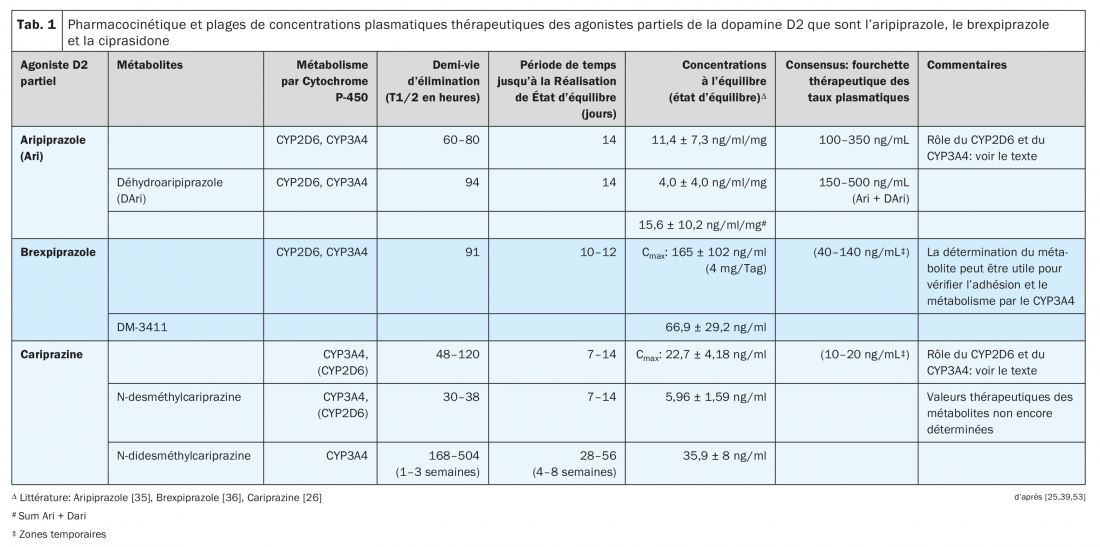
Le tableau 1 présente des exemples de concentrations à l’équilibre dans le sang mesurées chez des volontaires ou des patients lors de l’administration de l’un des trois agonistes partiels D2 [26,35,36].
Agonistes D2 partiels sous forme de préparations à effet retard et leur pharmacocinétique
Des préparations d’antipsychotiques à effet retard existent depuis des décennies, par exemple avec le décanoate d’haloparidol, en estérifiant les groupes hydroxy existants des médicaments avec des acides gras longs [37–39]. Ils sont ensuite dissous dans de l’huile et administrés au patient par voie intramusculaire sous forme d’IAL (antipsychotique injectable à action prolongée). Cette technique n’était plus applicable à des produits tels que la rispéridone, car ils ne possèdent pas de groupe OH estérifiable. Pour eux, une nouvelle technique a été utilisée en injectant ces antipsychotiques enfermés dans des microsphères. Comme ni l’aripiprazole, ni le brexpiprazole, ni la cariprazine ne sont des composés hydroxylés (fig. 1), une méthode similaire devrait être développée pour eux. Jusqu’à présent, il n’existe sur le marché qu’une préparation LAI pour l’aripiprazole, mais des études sont en cours dans le but de proposer également le brexpiprazole comme LAI [40]. Il existe même deux formes de dépôt pour l’aripiprazole: l’aripiprazole monohydrate a été introduit en Suisse, tandis que l’aripiprazole lauroxil est également disponible aux Etats-Unis [41]. Il est le produit d’une liaison covalente de l’acide laurique (acide dodécanoïque) à un atome d’azote de l’aripiprazole (fig. 4) [42]. Le médecin traitant doit en tenir compte pour les patients étrangers, car les dosages diffèrent pour les deux préparations. Etant donné que les antipsychotiques dépots atypiques présentent souvent un problème de prise de poids et d’IMC et d’élévation de la prolactine (exception : aripiprazole) [43], il serait avantageux de disposer également de LAI de brexipirazole et de cariprazine [44], qui présentent un profil plus favorable à cet égard, comme indiqué ci-dessous.
Mesure de la liaison des agonistes partiels D2 dans le système nerveux central à l’aide de la tomographie par émission de positrons (TEP)
Une question importante est de savoir dans quelle mesure les antipsychotiques sont actifs dans le cerveau et dans quelle mesure ils se lient aux récepteurs importants sur le plan thérapeutique. Les études TEP ont d’abord réussi à démontrer la liaison de l’aripiprazole aux récepteurs D2 et D3 dans le cerveau humain [45–48]. La saturation complète de la liaison des récepteurs D2/D3 centraux est atteinte à des concentrations plasmatiques aussi faibles que 100–150 ng/mL d’aripiprazole chez les patients schizophrènes traités par cet antipsychotique [47], avec une concentration plasmatique moyenne d’aripiprazole de 228 ng/mL dans l’ensemble du groupe de patients (n=16) de cette étude (s.d.: 142 ng/mL) a été mesurée.
De telles études TEP ont également été publiées pour la cariprazine [49] et le brexpiprazole [24,50,51]. Selon le ligand TEP utilisé, il n’est pas possible de distinguer la liaison aux récepteurs D2 ou D3. Cette technique ne permet pas non plus de déterminer directement la proportion du métabolite actif dans la liaison, de sorte qu’elle fournit en fait la preuve de la liaison de la «fraction active» (à savoir aripiprazole + déhydroaripiprazole; brexpiprazole; cariprazine + N-desméthlycariprazine + N-didesméthylcariprazine). Comme le brexpiprazole n’a pas de métabolites actifs, la liaison observée ne concerne que la molécule mère, puisque de plus le métabolite ne pénètre pas dans le cerveau [24]. Une autre limite de la technique TEP est que la proportion respective d’antagonisme/agonisme ne peut être obtenue directement à partir des données recueillies. Les études TEP fournissent néanmoins des résultats très importants, comme l’observation qu’il existe également une courbe dose-réponse pour le brexpiprazole entre son niveau plasmatique et sa liaison aux récepteurs D2/D3 dans la zone striatale, comme cela a déjà été rapporté pour l’aripiprazole [45]. Quatre heures après l’administration d’une dose unique (5 ou 6 mg) de brexpiprazole, la liaison atteint 77–78% dans le putamen et le caudate; elle reste relativement stable jusqu’à 23,5 h après l’administration [51]. Il est rappelé qu’un effet antipsychotique a une plage de liaison de 60 à 80%, et qu’une liaison plus forte augmente le risque d’effets secondaires extrapyramidaux [52], ce qui peut être le cas avec les antagonistes D2/D3 purs plutôt qu’avec les agonistes D2 partiels comme l’aripiprazole [45]. Avec une liaison de 50% de la liaison maximale (Omax: environ 90–95%), les taux plasmatiques correspondants de brexpiprazole seraient d’environ 8 ng/mL [51]. Si les données sont maintenant extrapolées au traitement avec des doses multiples de 2 mg/jour de brexpiprazole, on peut s’attendre à une liaison des récepteurs D2/D3 de plus de 80%, ce qui est un peu plus élevé que la valeur rapportée dans une autre étude TEP en raison du choix d’un ligand différent [50].
Études des relations: Niveaux plasmatiques des agonistes partiels D2 – effet clinique
Pour l’aripirazole en particulier, il existe plusieurs études sur la relation entre ses taux plasmatiques et son effet clinique chez les patients schizophrènes. Les directives consensuelles du groupe AGNP-TDM (Arbeitsgemeinschaft für Neuropsychopharmakologie und Pharmakopsychiatrie) [53] et celles publiées par l’American Society of Clinical Psychopharmacology [54] recommandent des fourchettes de concentrations plasmatiques, qui sont présentées dans le tableau 1. Les plages de concentrations plasmatiques indiquées pour le brexpiprazole et la cariprazine doivent être considérées comme provisoires en raison de l’insuffisance des données. Les fourchettes indiquées pour la cariprazine ne précisent pas si elles incluent également les métabolites.
Études récentes sur l’efficacité clinique de l’aripiprazole, du brexpiprazole et de la cariprazine
Au cours des deux dernières années, plusieurs études ont été publiées sur les propriétés cliniques du brexpiprazole [55] et de la cariprazine [56,57]. En l’absence d’études comparatives directes entre les trois agonistes partiels de D2, les études de réseau doivent être utilisées pour des comparaisons indirectes [6,58]. Une méta-analyse de l’efficacité clinique de 32 antipsychotiques oraux a montré que pratiquement tous ces médicaments étaient significativement plus bénéfiques que le placebo [58], notamment l’aripiprazole, le brexpiprazole et la cariprazine. Cela concernait le score total ainsi que les symptômes positifs, négatifs et dépressifs. La présentation des données suggère néanmoins que le brexpiprazole diffère moins que l’aripiprazole et la cariprazine du placebo. Les auteurs justifient ce choix en observant qu’au fil des décennies, l’effet placebo dans ces études comparatives n’a cessé d’augmenter, ce qui était particulièrement évident avec le plus récent agoniste partiel D2. Le brexpiprazole s’est avéré meilleur que le placebo en ce qui concerne le «fonctionnement social», contrairement à l’aripiprazole, qui ne différait pas du placebo, alors qu’il n’y avait pas de données à ce sujet pour la cariprazine. En comparant les données sur l’arrêt du traitement, l’aripiprazole et le brexpiprazole ont obtenu de meilleurs résultats que le placebo, contrairement à la cariprazine. Pour une comparaison mutuelle des propriétés cliniques de ces antipsychotiques directs, des études comparatives directes seraient maintenant nécessaires, mais jusqu’à présent elles n’existent que dans une mesure limitée [59,60], à savoir seulement sous la forme d’une étude ouverte et exploratoire de 6 semaines entre l’aripiprazole et le brexpiprazole [61].
Cependant, une étude sur la cariprazine a attiré l’attention en montrant qu’elle était significativement plus efficace que la rispéridone pour le traitement des symptômes négatifs chez les patients schizophrènes présentant des symptômes négatifs prédominants [62,63]. Malheureusement, cette étude n’a pas encore été reproduite pour confirmer ce résultat important. Dans une méta-analyse intéressante qui incluait également d’autres antipsychotiques, on a constaté que les doses quotidiennes optimales pour le traitement des symptômes négatifs et positifs différaient selon les médicaments: Aripiprazole (11,9 mg [pour les symptômes négatifs], 11 mg [pour les symptômes positifs]). Les doses correspondantes sont pour le brexpiprazole: (2,1 mg, respectivement 4 mg); pour la cariprazine: (4 mg et 6,51 mg respectivement): il s’agit, au sens strict, de la dose ED95 (dose efficace 95%) à laquelle les symptômes respectifs sont réduits au maximum [64]. Dans une étude similaire, l’ED95 a également été calculé, c’est-à-dire la réduction de 95% des symptômes positifs mesurés avec l’échelle PANSS ou BPRS par rapport au placebo [65]: Elle est de 11,5 mg/jour (dose équivalente à 1 mg/jour de rispéridone: 1,8 mg/jour) pour l’aripiprazole, de 3,36 mg/jour (0,54 mg/jour) pour le brexpiprazole et de 7,6 mg/jour pour la cariprazine. La courbe dose-réponse pour le brexpiprazole et la cariprazine montre un plateau à des doses plus élevées, et une courbe en forme de cloche pour l’aripiprazole, ce qui signifie que des doses plus élevées ne promettent aucun effet supplémentaire.
Effets indésirables des médicaments (EIM)
A quelques exceptions près, les antipsychotiques encore utilisés aujourd’hui ne diffèrent pas significativement dans leur efficacité clinique sur les troubles schizophréniques [58]. Leurs profils d’effets secondaires sont différents, comme le montrent trois revues remarquables ou méta-analyses en réseau [58,6,25] (tab. 2) et d’autres publications [20,66,67]. De nombreux effets indésirables des antipsychotiques présentent une dépendance à la dose selon la littérature, comme cela a été documenté pour l’aripiprazole mais pas encore pour le brexpiprazole et la cariprazine [68].
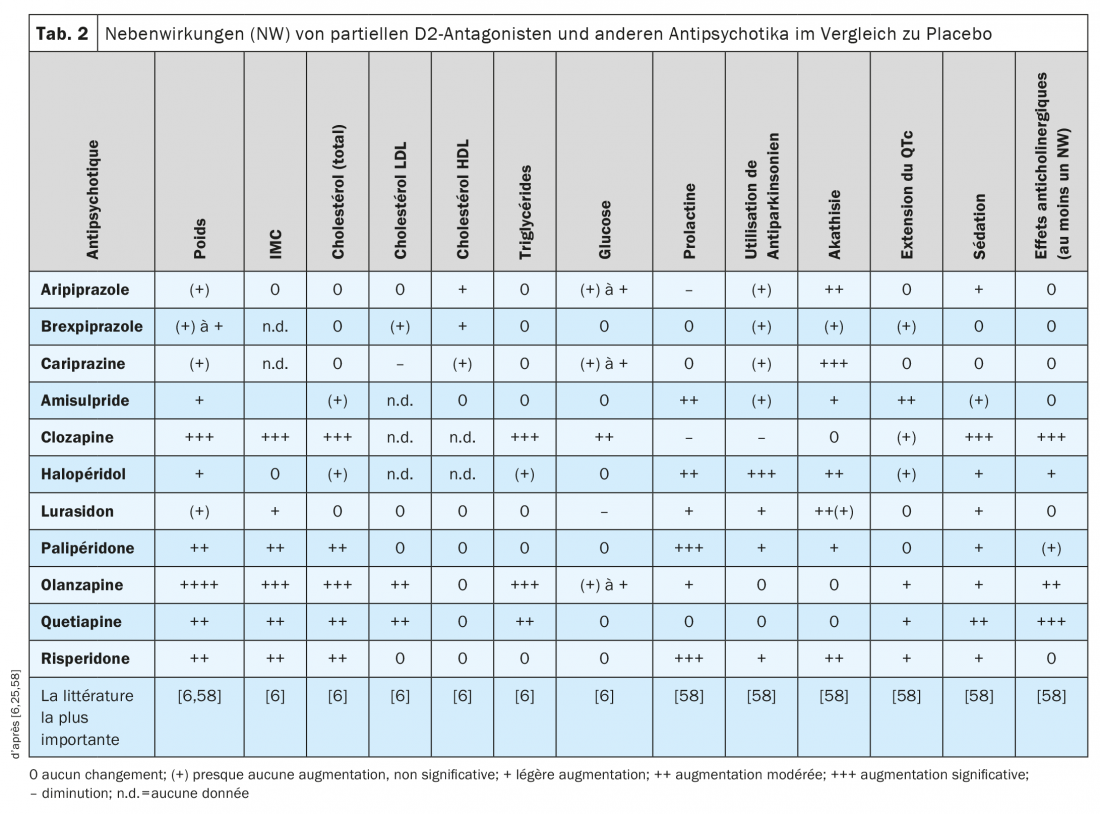
Dans l’étude comparative directe entre le brexpiprazole et l’aripiprazole citée précédemment, l’acathisie est apparue moins fréquemment sous brexpiprazole (9,4%) que sous aripiprazole (21,2%), mais les deux inhibiteurs partiels de D2 ne différaient pas significativement en termes d’effet clinique [61], ni en termes de taux de prolactine mesurés. Cependant, après 6 semaines de pharmacothérapie, une prise de poids cliniquement significative (≥7%) est survenue chez de nombreux patients à la fois dans le groupe brexpiprazole (35% des patients) et dans le groupe aripiprazole (19%): un résultat confirmé par une analyse de réseau [60] mais qui semble plutôt élevé selon d’autres études [59,69]. Comme dans tableau 2 d’après les données de la littérature, les trois agonistes partiels de type D2 se comportent plutôt bien par rapport à de nombreux autres antipsychotiques en termes de prise de poids ou d’augmentation de l’IMC. Il peut y avoir une prise de poids chez certains patients et une perte de poids chez d’autres, mais cela ne fait que refléter la largeur de l’intervalle de confiance non indiqué ici (le plus souvent IC: 95%), qui s’exprime plus ou moins dans ces calculs statistiques d’un médicament à l’autre. L’aripiprazole a tendance à donner des résultats légèrement plus favorables que le brexpiprazole et la cariprazine [6,25,58], et dans une étude rétrospective récente, on a constaté que le poids corporel et l’IMC augmentaient de manière significative chez les patients traités par le brexpiprazole mais pas par la cariprazine [70]. Par rapport à plusieurs autres antipsychotiques de 2ème génération, la dyslipidémie est moins fréquente avec les trois agonistes partiels D2 (tab. 2).
Si l’on se réfère à nouveau à l’étude comparative [61], l’ECG n’a montré en moyenne pratiquement aucune modification et, le cas échéant, des modifications cliniquement non pertinentes sous aripiprazole et brexpiprazole. Ces mesures sont néanmoins appropriées, car chez un patient sous brexpiprazole, la valeur du QTcF a augmenté (399 ms avant le traitement; 442 ms à l’arrêt du traitement). Le traitement a également dû être arrêté chez un patient sous aripiprazole en raison de modifications de l’ECG. D’autres études de comparaison directe de ce type seraient nécessaires pour montrer des différences claires entre ces agonistes D2 partiels.
Par rapport aux autres antipsychotiques à fort antagonisme D2, les antagonistes D2 partiels n’augmentent pas la prolactine dans le sang (tab. 2). Avec l’aripiprazole, comme avec la clozapine, on peut même occasionnellement observer une diminution des taux de prolactine par rapport au placebo. L’aripiprazole est donc considéré comme la première option pour réduire les taux plasmatiques élevés de prolactine chez les patients schizophrènes [71]. Une étude pharmacocinétique a montré des corrélations négatives significatives entre les taux de prolactine et les concentrations plasmatiques d’aripiprazole et la somme de l’aripiprazole et du déhydro-aripiprazole chez des patients schizophrènes traités par aripiprazole. Une hypoprolactinémie (<8 ng/mL) est survenue chez plusieurs patients, bien que les conséquences cliniques possibles ne soient pas claires (dysfonctionnement érectile, production de lait réduite, symptômes d’anxiété) [72]. Par contre, les patients sous aripiprazole ou cariprazine souffrent plus fréquemment d’akathisie que sous brexpiprazole (tab. 2).
Une «augmentation» du traitement antidépresseur avec un maximum de 2 mg/jour de brexpiprazole chez les patients déprimés [73] qui ne répondent pas à la monothérapie par antidépresseurs est une option thérapeutique intéressante [74]. Cependant, la polymédication comporte également des risques, comme le décrit le rapport d’un patient qui a développé une hypomanie après une semaine de comédication avec le brexpiprazole, après que le patient déprimé avait répondu de manière inadéquate à un traitement combiné avec la mirtazapine et la duloxétine. Il est frappant de constater qu’après l’arrêt du brexpiprazole, cet effet secondaire a disparu [75]. Cette observation serait plus ou moins en accord avec les résultats de 2 études ne montrant aucun bénéfice du brexpiprazole par rapport au placebo dans le traitement de la manie bipolaire [76].
Questions cliniques particulières
La dyskinésie tardive: Une méta-analyse récente des études sur les PES chez les patients psychiatriques traités par antipsychotiques a révélé une prévalence élevée d’effets secondaires moteurs : PES: 20%; akathisie: 11%; dyskinésie tardive: 7% [77]. Le même groupe d’auteurs a rapporté une incidence annuelle de dyskinésie tardive de 0,68 à 6,5%. Ils surviennent chez environ 15 à 30% des patients traités de façon chronique par des antipsychotiques [78]. Aujourd’hui, les antipsychotiques peuvent être prescrits plus fréquemment, non seulement pour les troubles schizophréniques mais aussi pour les troubles bipolaires et comme médicament d’appoint pour les psychoses affectives. Il est donc urgent de se demander dans quelle mesure les médicaments modernes tels que les antipsychotiques agonistes partiels D2 peuvent provoquer une dyskinésie tardive. La question de la dyskinésie tardive est également d’actualité puisque la deutetrabenazine et la valbenazine ont été introduites avec l’indication de dyskinésie tardive aux USA mais pas encore en Suisse [79]. L’aripiprazole provoque moins de dyskinésie tardive que l’halopéridol selon une étude plus ancienne [80]. Une revue de 2018 a décrit la survenue de ces EIM après un traitement par aripiprazole, mais peut-être en raison de leur introduction récente, aucun cas de ce type n’a encore été rapporté après un traitement par brexpiprazole ou des cas de cariprazine [81].
Agonistes D2 partiels chez les patients psychogériatriques: Les antipsychotiques font généralement l’objet d’une mise en garde quant à leur utilisation chez les patients psychogériatriques souffrant de psychose associée à la démence. Le risque de mortalité est augmenté chez les patients traités par des antipsychotiques atypiques (y compris l’aripiprazole) par rapport au placebo, c’est-à-dire à la suite d’effets indésirables cardio-vasculaires (par exemple, insuffisance cardiaque, mort subite d’origine cardiaque), infectieux (par exemple, pneumonie) ou cérébro-vasculaires. Cependant, il existe également des études sur l’effet des agonistes partiels de type D2 chez les patients agités atteints de la maladie d’Alzheimer. Par exemple, deux essais contrôlés par placebo sur 12 semaines ont récemment démontré une efficacité satisfaisante et une tolérance relativement bonne du brexpiprazole à 2 mg/jour chez des patients Alzheimer agités, où la symptomatologie cible était l’agitation [82]. Le succès de cette étude a ensuite motivé les fabricants de brexpiprazole à réaliser d’autres études. Une revue récemment publiée sur les nouveaux développements pharmacothérapeutiques chez les patients psychogériatriques cite cette étude dans ce domaine [82], mais aucune ne fait référence à l’aripiprazole ou à la cariprazine [83].

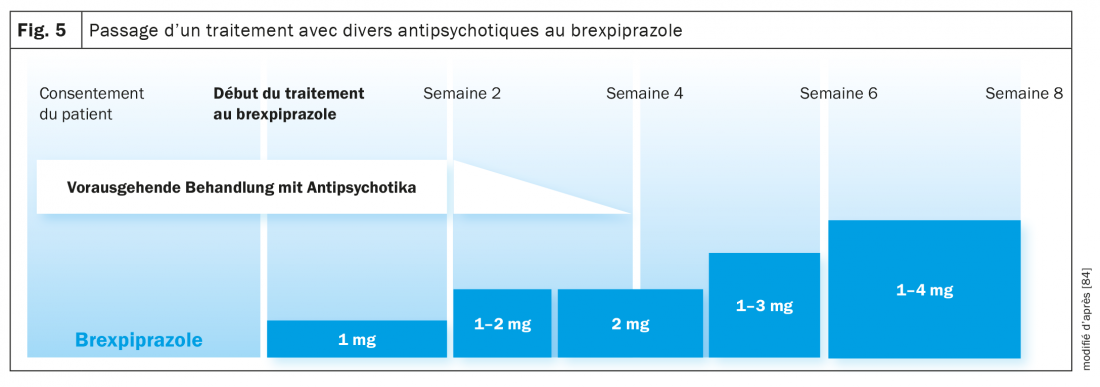
Passage d’un traitement antipsychotique au brexpiprazole: Dans une étude clinique, les conséquences du passage de patients souffrant de schizophrénie ou de psychose affective d’un traitement avec différents antipsychotiques au brexpiprazole ont été étudiées (fig. 5) [84]. Le changement a été réalisé en quatre semaines en maintenant le traitement antipsychotique précédent pendant quatre semaines. Il a été progressivement abandonné au début de la troisième semaine, et à partir de la quatrième semaine, seul le brexpiprazole a été poursuivi, qui avait été introduit au début de la première semaine à faible dose (1 mg/jour, puis 1–2 mg/jour, 4 mg/jour) (fig. 5). La dose maximale de brexpiprazole était de 4 mg/jour (chez 50% des 200 patients), mais elle était ajustée individuellement en fonction des critères CGI. Après la huitième semaine de l’étude, le taux d’interruption a atteint 17%. Comme plus ou moins attendu, ce taux n’était que de 4,9% chez les patients passés de l’aripiprazole au brexpiprazole, mais de 25,4% chez les patients traités par d’autres antipsychotiques. En résumé, une période de transition de 4 semaines semble être un peu trop courte, surtout en cas de traitement antérieur avec, par exemple, l’olanzapine, qui se caractérise par des propriétés anticholinergiques. Il faut aussi prendre en considération que les longues demi-vies (tab. 1) de l’aripiprazole, du brexpiprazole et de la cariprazine font que les concentrations à l’équilibre ne sont pas atteintes avant 10 jours. Dans une autre étude de conversion, il a été démontré que l’introduction du brexpiprazole avait un effet bénéfique sur la symptomatologie préexistante du PES. On a constaté non seulement une augmentation du cholestérol HDL et une diminution du poids corporel et de l’IMC des patients, mais aussi une diminution significative du taux de prolactine (la majorité des patients étaient prétraités par la rispéridone ou la palipéridone) [85]. Cet effet bénéfique du brexpiprazole a également été observé chez le patient décrit ici. (description du cas) après être passé de la rispéridone à l’agoniste partiel D2.
Remarques finales
En comparant le profil pratique souhaité des antipsychotiques présenté par Eich et Gentsch (2019) dans leur revue concernant leur sécurité et leur tolérance optimales [2], à savoir: pas ou peu de PES, pas d’agranulocytose, pas/peu de prise de poids, pas ou peu de sédation, pas de cardiotoxicité (pas d’allongement de l’intervalle QTc, pas d’hypotension), pas d’élévation de la prolactine/pas de dysfonctionnement sexuel, pas/peu d’interactions, les trois agonistes partiels D2 aripiprazole, brexpiprazole et cariprazine répondent à certains de ces souhaits de manière satisfaisante. Néanmoins, après environ 70 ans de recherche à orientation biologique, on aimerait voir un «saut quantique» dans le développement de médicaments antipsychotiques efficaces. Cela ne sera probablement possible que lorsque la recherche nous aura apporté davantage de connaissances sur les causes neurobiologiques des troubles schizophréniques, que nous pourrons ensuite utiliser pour développer de nouveaux outils thérapeutiques.
Messages Take-Home
- Les trois agonistes partiels de la dopamine D2, l’aripiprazole, le brexpiprazole et la cariprazine, ont un effet antipsychotique significativement meilleur que le placebo dans le traitement médicamenteux des troubles schizophrènes.
- En termes de sécurité et de tolérance, ils sont plus avantageux que de nombreux autres antipsychotiques de première et de deuxième génération, notamment en ce qui concerne l’utilisation de médicaments antiparkinsoniens, ainsi que l’augmentation du poids corporel et du taux de prolactine. Le risque d’effets secondaires métaboliques et anticholinergiques est faible. D’autre part, la survenue d’une akathisie est particulièrement digne d’être mentionnée lors d’un traitement par cariprazine et aripiprazole.
- L’aripiprazole et le brexpiprazole étant métabolisés par le CYP2D6, mais aussi comme la cariprazine par le CYP3A4, le risque d’interactions pharmacocinétiques (inhibition, induction) doit être considéré pour les trois antipsychotiques.
- En fonction du génotype CYP2D6 du patient, des ajustements de dose d’aripiprazole ou de brexpiprazole sont recommandés.
- Il y a un manque de données sur les recommandations pour le suivi thérapeutique (TDM) du brexpiprazole et de la cariprazine.
Bibliographie:
- McCutcheon RA, Reis Marques T, Howes OD: Schizophrenia – An Overview. JAMA psychiatry 2020;77(2): 201–210.
- Eich P, Gentsch K: Gemeinsamkeiten und Unterschiede der partiellen Dopamin-Agonisten. InFo Neurologie & Psychiatrie 2019; 17(6): 16–21.
- Barnes TR, Drake R, Paton C, et al.: Evidence-based guidelines for the pharmacological treatment of schizophrenia: Updated recommendations from the British Association for Psychopharmacology. J Psychopharmacol. 2020;34(1): 3–78.
- Sakurai H, Yasui-Furukori N, Suzuki T, et al.: Pharmacological Treatment of Schizophrenia: Japanese Expert Consensus. Pharmacopsychiatry. 2021;54(2): 60–67.
- Frankel JS, Schwartz TL: Brexpiprazole and cariprazine: distinguishing two new atypical antipsychotics from the original dopamine stabilizer aripiprazole. Ther Adv Psychopharmacol. 2017;7(1): 29–41.
- Pillinger T, McCutcheon RA, Vano L, et al.: Comparative effects of 18 antipsychotics on metabolic function in patients with schizophrenia, predictors of metabolic dysregulation, and association with psychopathology: a systematic review and network meta-analysis. The lancet Psychiatry. 2020;7(1): 64–77.
- Freedman R: Schizophrenia. New England Journal of Medicine. 2003; 349: 1738–1749.
- McCutcheon RA, Krystal JH, Howes OD: Dopamine and glutamate in schizophrenia: biology, symptoms and treatment. World Psychiatry. 2020; 19(1): 15–33.
- Koblan KS, Kent J, Hopkins SC, et al.: A Non-D2-Receptor-Binding Drug for the Treatment of Schizophrenia. N Engl J Med. 2020;382(16): 1497–1506.
- Lieberman JA: Dopamine partial agonists: a new class of antipsychotic. CNSDrugs. 2004;18(4): 251–267.
- Kondej M, Stepnicki P, Kaczor AA: Multi-Target Approach for Drug Discovery against Schizophrenia. Int J Mol Sci. 2018;19(10).
- Stahl SM: Drugs for psychosis and mood: unique actions at D3, D2, and D1 dopamine receptor subtypes. CNS Spectr. 2017; 22(5): 375–384.
- Neill JC, Grayson B, Kiss B, et al.: Effects of cariprazine, a novel antipsychotic, on cognitive deficit and negative symptoms in a rodent model of schizophrenia symptomatology. Eur Neuropsychopharmacol. 2016;26(1): 3–14.
- Risbood V, Lee JR, Roche-Desilets J, Fuller MA: Lurasidone: an atypical antipsychotic for schizophrenia. Ann Pharmacother 2012; 46(7–8): 1033–1046.
- Harvey PD, Siu CO, Hsu J, et al.: Effect of lurasidone on neurocognitive performance in patients with schizophrenia: A short-term placebo- and active-controlled study followed by a 6-month double-blind extension. Eur Neuropsychopharmacol. 2013;23(11): 1373–1382.
- Kikuchi T, Maeda K, Suzuki M, et al.: Discovery research and development history of the dopamine D2 receptor partial agonists, aripiprazole and brexpiprazole. Neuropsychopharmacol Rep. 2021;41(2): 134–143.
- Yamamoto K, Shinba T, Yoshii M: Psychiatric symptoms of noradrenergic dysfunction: a pathophysiological view. Psychiatry Clin Neurosci 2014;68(1): 1–20.
- Maki-Marttunen V, Andreassen OA, Espeseth T: The role of norepinephrine in the pathophysiology of schizophrenia. Neurosci Biobehav Rev. 2020;118: 298–314.
- Hecht EM, Landy DC: Alpha-2 receptor antagonist add-on therapy in the treatment of schizophrenia; a meta-analysis. Schizophr Res. 2012; 134(2–3): 202–206.
- Siafis S, Tzachanis D, Samara M, Papazisis G: Antipsychotic Drugs: From Receptor-binding Profiles to Metabolic Side Effects. Current neuropharmacology 2018; 16(8): 1210–1223.
- Maletic V, Eramo A, Gwin K, Offord SJ, Duffy RA. The Role of Norepinephrine and Its alpha-Adrenergic Receptors in the Pathophysiology and Treatment of Major Depressive Disorder and Schizophrenia: A Systematic Review. Front Psychiatry. 2017;8:42.
- Uys MM, Shahid M, Harvey BH: Therapeutic Potential of Selectively Targeting the alpha2C-Adrenoceptor in Cognition, Depression, and Schizophrenia-New Developments and Future Perspective. Front Psychiatry 2017; 8: 144.
- Yuan R-X, Xu J-W, Song L-H, et al.: A convenient and practical synthesis of the cis isomer of the first orally active dopamine D3-Preferring D3-D2 receptor partial agonist cariprazine. Synthetic Communications 2021; 51(14): 2127–2134.
- Sasabe H, Koga T, Furukawa M, et al.: Pharmacokinetics and metabolism of brexpiprazole, a novel serotonin-dopamine activity modulator and its main metabolite in rat, monkey and human. Xenobiotica 2021; 51(5): 590–604.
- Keks N, Hope J, Schwartz D, et al.: Comparative Tolerability of Dopamine D2/3 Receptor Partial Agonists for Schizophrenia. CNS Drugs 2020.
- Nakamura T, Kubota T, Iwakaji A, et al.: Clinical pharmacology study of cariprazine (MP-214) in patients with schizophrenia (12-week treatment). Drug Des Devel Ther 2016; 10: 327–338.
- Milosavljevic F, Bukvic N, Pavlovic Z, et al.: Association of CYP2C19 and CYP2D6 Poor and Intermediate Metabolizer Status With Antidepressant and Antipsychotic Exposure: A Systematic Review and Meta-analysis. JAMA psychiatry 2021; 78(3): 270–280.
- Islam F, Men X, Yoshida K, et al.: Pharmacogenetics-Guided Advances in Antipsychotic Treatment. Clin Pharmacol Ther 2021; 110(3): 582–588.
- Bousman CA, Bengesser SA, Aitchison KJ, et al.: Review and Consensus on Pharmacogenomic Testing in Psychiatry. Pharmacopsychiatry 2021; 54(1): 5–17.
- Carvalho Henriques B, Yang EH, et al.: How Can Drug Metabolism and Transporter Genetics Inform Psychotropic Prescribing? Frontiers in genetics 2020; 11: 491895.
- Elmokadem A, Bruno CD, Housand C, Jordie EB, Chow CR, Lesko LJ, et al. Brexpiprazole Pharmacokinetics in CYP2D6 Poor Metabolizers: Using Physiologically Based Pharmacokinetic Modeling to Optimize Time to Effective Concentrations. J Clin Pharmacol. 2021.
- Waade RB, Christensen H, Rudberg I, et al.: Influence of comedication on serum concentrations of aripiprazole and dehydroaripiprazole. Ther Drug Monit 2009; 31(2): 233–238.
- Castberg I, Spigset O: Effects of comedication on the serum levels of aripiprazole: evidence from a routine therapeutic drug monitoring service. Pharmacopsychiatry 2007; 40(3): 107–110.
- Sasabe H, Koga T, Furukawa M, Matsunaga M, et al.: In vitro evaluations for pharmacokinetic drug-drug interactions of a novel serotonin-dopamine activity modulator, brexpiprazole. Xenobiotica 2021; 51(5): 522–535.
- Kirschbaum KM, Muller MJ, Malevani J, et al.: Serum levels of aripiprazole and dehydroaripiprazole, clinical response and side effects. World J Biol Psychiatry 2008; 9(3):212–218.
- Ishigooka J, Iwashita S, Higashi K, et al. Pharmacokinetics and Safety of Brexpiprazole Following Multiple-Dose Administration to Japanese Patients With Schizophrenia. J Clin Pharmacol 2018; 58(1): 74–80.
- Correll CU, Kim E, Sliwa JK, et al.: Pharmacokinetic Characteristics of Long-Acting Injectable Antipsychotics for Schizophrenia: An Overview. CNS Drugs 2021; 35(1): 39–59.
- Toja-Camba FJ, Gesto-Antelo N, Maronas O, et al.: Review of Pharmacokinetics and Pharmacogenetics in Atypical Long-Acting Injectable Antipsychotics. Pharmaceutics 2021; 13(7).
- Schoretsanitis G, Baumann P, Conca A, et al.: Therapeutic Drug Monitoring of Long-Acting Injectable Antipsychotic Drugs. Ther Drug Monit 2021; 43(1): 79–102.
- Wu B, Wu L, He Y, et al.: Engineered PLGA microspheres for extended release of brexpiprazole: in vitro and in vivo studies. Drug development and industrial pharmacy 2021; 47(6): 1001–1010.
- Citrome L: Aripiprazole long-acting injectable formulations for schizophrenia: aripiprazole monohydrate and aripiprazole lauroxil. Expert Rev Clin Pharmacol 2016; 9(2): 169–186.
- Hard ML, Mills RJ, Sadler BM, et al.: Aripiprazole Lauroxil: Pharmacokinetic Profile of This Long-Acting Injectable Antipsychotic in Persons With Schizophrenia. J Clin Psychopharmacol 2017; 37(3): 289–295.
- Saucedo Uribe E, Carranza Navarro F, Guerrero Medrano AF, et al.: Preliminary efficacy and tolerability profiles of first versus second-generation Long-Acting Injectable Antipsychotics in schizophrenia: A systematic review and meta-analysis. J Psychiatr Res 2020; 129: 222–233.
- de Filippis R, De Fazio P, Gaetano R, et al.: Current and emerging long-acting antipsychotics for the treatment of schizophrenia. Expert Opin Drug Saf 2021; 20(7): 771–790.
- Yokoi F, Grunder G, Biziere K, et al.: Dopamine D2 and D3 receptor occupancy in normal humans treated with the antipsychotic drug aripiprazole (OPC 14597): a study using positron emission tomography and [11C]raclopride. Neuropsychopharmacology 2002; 27(2): 248–259.
- Mamo D, Graff A, Mizrahi R, et al.: Differential effects of aripiprazole on D(2), 5-HT(2), and 5-HT(1A) receptor occupancy in patients with schizophrenia: a triple tracer PET study.[see comment]. American Journal of Psychiatry 2007; 164(9): 1411–1417.
- Grunder G, Fellows C, Janouschek H, et al.: Brain and plasma pharmacokinetics of aripiprazole in patients with schizophrenia: an [18F]fallypride PET study. Am J Psychiatry 2008; 165(8): 988–995.
- Sparshatt A, Taylor D, Patel MX, Kapur S: A systematic review of aripiprazole–dose, plasma concentration, receptor occupancy, and response: implications for therapeutic drug monitoring. J Clin Psychiatry 2010; 71(11): 1447–1456.
- Girgis RR, Slifstein M, D’Souza D, et al.: Preferential binding to dopamine D3 over D2 receptors by cariprazine in patients with schizophrenia using PET with the D3/D2 receptor ligand [(11)C]-(+)-PHNO. Psychopharmacology (Berl) 2016; 233 (19–20): 3503–3512.
- Girgis RR, Forbes A, Abi-Dargham A, Slifstein M: A positron emission tomography occupancy study of brexpiprazole at dopamine D2 and D3 and serotonin 5-HT1A and 5-HT2A receptors, and serotonin reuptake transporters in subjects with schizophrenia. Neuropsychopharmacology 2020; 45(5): 786–792.
- Wong DF, Raoufinia A, Bricmont P, et al.: An open-label, positron emission tomography study of the striatal D2/D3 receptor occupancy and pharmacokinetics of single-dose oral brexpiprazole in healthy participants. Eur J Clin Pharmacol 2021;77(5): 717–725.
- Gründer G, Carlsson A, Wong DF: Mechanism of new antipsychotic medications – Occupancy is not just antagonism. Archives of General Psychiatry 2003; 60: 974–977.
- Hiemke C, Bergemann N, Clement HW, et al.: Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology: Update 2017. Pharmacopsychiatry 2018; 51(1/2): 9–62.
- Schoretsanitis G, Kane JM, Correll CU, et al.: Blood Levels to Optimize Antipsychotic Treatment in Clinical Practice: A Joint Consensus Statement of the American Society of Clinical Psychopharmacology and the Therapeutic Drug Monitoring Task Force of the Arbeitsgemeinschaft fur Neuropsychopharmakologie und Pharmakopsychiatrie. J Clin Psychiatry 2020; 81(3).
- Frampton JE: Brexpiprazole: A Review in Schizophrenia. Drugs 2019; 79(2): 189–200.
- Mucci F, Della Vecchia A, Baroni S, Marazziti D: Cariprazine as a therapeutic option for schizophrenia: a drug evaluation. Expert Opin Pharmacother 2021; 22(4): 415–426.
- Laszlovszky I, Barabassy A, Nemeth G: Cariprazine, A Broad-Spectrum Antipsychotic for the Treatment of Schizophrenia: Pharmacology, Efficacy, and Safety. Adv Ther 2021; 38(7): 3652–3673.
- Huhn M, Nikolakopoulou A, Schneider-Thoma J, et al.: Comparative efficacy and tolerability of 32 oral antipsychotics for the acute treatment of adults with multi-episode schizophrenia: a systematic review and network meta-analysis. Lancet 2019; 394(10202): 939–951.
- Watanabe Y, Yamada S, Otsubo T, Kikuchi T: Brexpiprazole for the Treatment of Schizophrenia in Adults: An Overview of Its Clinical Efficacy and Safety and a Psychiatrist’s Perspective. Drug Des Devel Ther 2020; 14: 5559–5574.
- Kishi T, Ikuta T, Matsuda Y, et al.: Aripiprazole vs. brexpiprazole for acute schizophrenia: a systematic review and network meta-analysis. Psychopharmacology (Berl) 2020; 237(5): 1459–1470.
- Citrome L, Ota A, Nagamizu K, et al.: The effect of brexpiprazole (OPC-34712) and aripiprazole in adult patients with acute schizophrenia: results from a randomized, exploratory study. Int Clin Psychopharmacol 2016; 31(4): 192–201.
- Nemeth G, Laszlovszky I, Czobor P, et al.: Cariprazine versus risperidone monotherapy for treatment of predominant negative symptoms in patients with schizophrenia: a randomised, double-blind, controlled trial. Lancet 2017; 389(10074): 1103–1113.
- Fleischhacker W, Galderisi S, Laszlovszky I, et al.: The efficacy of cariprazine in negative symptoms of schizophrenia: Post hoc analyses of PANSS individual items and PANSS-derived factors. Eur Psychiatry 2019; 58: 1–9.
- Sabe M, Zhao N, Crippa A, Kaiser S: Antipsychotics for negative and positive symptoms of schizophrenia: dose-response meta-analysis of randomized controlled acute phase trials. NPJ Schizophr 2021; 7(1): 43.
- Leucht S, Crippa A, Siafis S, et al.: Dose-Response Meta-Analysis of Antipsychotic Drugs for Acute Schizophrenia. Am J Psychiatry 2020;177(4): 342–353.
- Citrome L: The ABC’s of dopamine receptor partial agonists – aripiprazole, brexpiprazole and cariprazine: the 15-min challenge to sort these agents out. Int J Clin Pract 2015; 69(11): 1211–1220.
- Citrome L: Activating and Sedating Adverse Effects of Second-Generation Antipsychotics in the Treatment of Schizophrenia and Major Depressive Disorder: Absolute Risk Increase and Number Needed to Harm. J Clin Psychopharmacol. 2017;37(2): 138–147.
- Yoshida K, Takeuchi H: Dose-dependent effects of antipsychotics on efficacy and adverse effects in schizophrenia. Behav Brain Res 2021; 402: 113098.
- Huhn M, Nikolakopoulou A, Schneider-Thoma J, et al.: Comparative efficacy and tolerability of 32 oral antipsychotics for the acute treatment of adults with multi-episode schizophrenia: a systematic review and network meta-analysis. Lancet 2019.
- Greger J, Aladeen T, Lewandowski E, et al.: Comparison of the Metabolic Characteristics of Newer Second Generation Antipsychotics: Brexpiprazole, Lurasidone, Asenapine, Cariprazine, and Iloperidone With Olanzapine as a Comparator. J Clin Psychopharmacol 2021; 41(1): 5–12.
- Labad J, Montalvo I, Gonzalez-Rodriguez A, et al.: Pharmacological treatment strategies for lowering prolactin in people with a psychotic disorder and hyperprolactinaemia: A systematic review and meta-analysis. Schizophr Res 2020; 222: 88–96.
- Tasaki M, Yasui-Furukori N, Kubo K, et al.: Relationship of Prolactin Concentrations to Steady-State Plasma Concentrations of Aripiprazole in Patients With Schizophrenia. Ther Drug Monit 2021; 43(4): 589–592.
- Thase ME, Zhang P, Weiss C, et al.: Efficacy and safety of brexpiprazole as adjunctive treatment in major depressive disorder: overview of four short-term studies. Expert Opin Pharmacother 2019; 20(15): 1907–1916.
- Kishi T, Sakuma K, Nomura I, et al.: Brexpiprazole as Adjunctive Treatment for Major Depressive Disorder Following Treatment Failure With at Least One Antidepressant in the Current Episode: a Systematic Review and Meta-Analysis. Int J Neuropsychopharmacol 2019; 22(11): 698–709.
- Lafreniere S, Picotte F, Legare N: Hypomania in a depressed man following the introduction of brexpiprazole: A case report. Encephale 2021;47(2): 185–186.
- Vieta E, Sachs G, Chang D, et al.: Two randomized, double-blind, placebo-controlled trials and one open-label, long-term trial of brexpiprazole for the acute treatment of bipolar mania. J Psychopharmacol 2021; 35(8): 971–982.
- Ali T, Sisay M, Tariku M, et al.: Antipsychotic-induced extrapyramidal side effects: A systematic review and meta-analysis of observational studies. PLoS One 2021; 16(9): e0257129.
- Ali Z, Roque A, El-Mallakh RS: A unifying theory for the pathoetiologic mechanism of tardive dyskinesia. Med Hypotheses 2020; 140: 109682.
- Bashir HH, Jankovic J: Treatment of tardive dyskinesia. Neurol Clin 2020; 38: 379–396.
- Amada N, Akazawa H, Ohgi Y, et al.: Brexpiprazole has a low risk of dopamine D2 receptor sensitization and inhibits rebound phenomena related to D2 and serotonin 5-HT2A receptors in rats. Neuropsychopharmacol Rep 2019; 39(4): 279–288.
- Carbon M, Kane JM, Leucht S, Correll CU: Tardive dyskinesia risk with first- and second-generation antipsychotics in comparative randomized controlled trials: a meta-analysis. World Psychiatry 2018; 17(3): 330–340.
- Grossberg GT, Kohegyi E, Mergel V, et al.: Efficacy and Safety of Brexpiprazole for the Treatment of Agitation in Alzheimer’s Dementia: Two 12-Week, Randomized, Double-Blind, Placebo-Controlled Trials. Am J Geriatr Psychiatry 2020; 28(4): 383–400.
- Aftab A, Lam JA, Liu F, et al.: Recent developments in geriatric psychopharmacology. Expert Rev Clin Pharmacol 2021; 14(3): 341–355.
- Ishigooka J, Usami T, Iwashita S, et al.: Post-hoc analysis investigating the safety and efficacy of brexpiprazole in Japanese patients with schizophrenia who were switched from other antipsychotics in a long-term study (Secondary Publication). Neuropsychopharmacol Rep. 2020;40(2): 122–129.
- Ichinose M, Miura I, Horikoshi S, et al.: Effect of Switching to Brexpiprazole on Plasma Homovanillic Acid Levels and Antipsychotic-Related Side Effects in Patients with Schizophrenia or Schizoaffective Disorder. Neuropsychiatr Dis Treat 2021; 17: 1047–1053.
- Stahl SM: Stahl’s essential psychopharmacology: neuroscientific basis and practical application. 4th ed. New York, USA: Cambridge University Press; 2013. 626 p.
- Bandelow B, Meier A: Aripiprazole, a «dopamine-serotonin system stabilizer» in the treatment of psychosis. German Journal of Psychiatry 2003; 6: 9–16.