Le carcinome à cellules de Merkel est une forme rare mais agressive de cancer de la peau. Les personnes âgées sont les plus touchées, l’âge moyen au moment du diagnostic étant de 75 ans. Après l’excision chirurgicale de la tumeur primaire, une radiothérapie adjuvante est recommandée. A un stade avancé ou en présence de métastases à distance, une immunothérapie doit être envisagée. Le seul anticorps anti-PD-L1 autorisé à ce jour en Suisse a révolutionné les possibilités de traitement.
“Le carcinome à cellules de Merkel est extrêmement hétérogène dans sa présentation clinique”, a rapporté le Dr Anja Wysocki, co-médecin-chef du service de dermatologie de l’hôpital cantonal de Lucerne [1]. Outre la forme nodulaire, qui est la plus fréquente, des variantes en plaques sont rarement observées ; elles se trouvent principalement sur le tronc et les extrémités proximales.
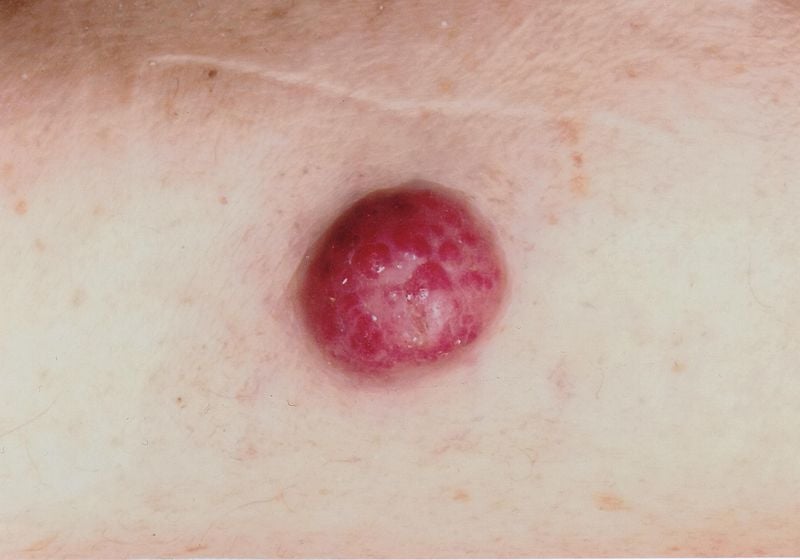
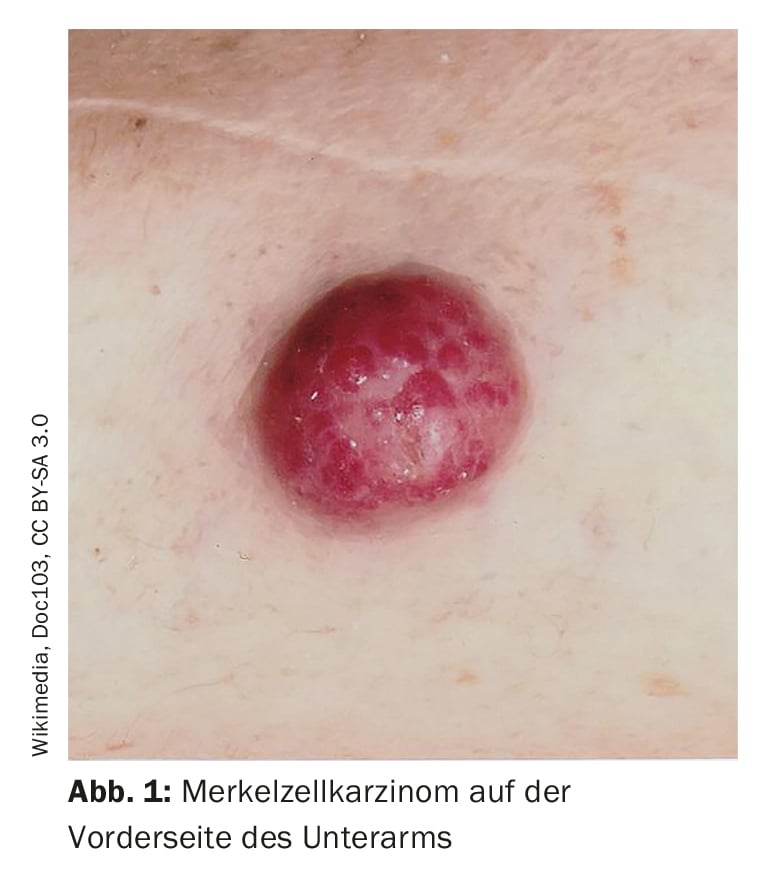
Les erreurs de diagnostic sont relativement fréquentes, a fait remarquer l’intervenante. Il y a confusion, par exemple, avec les folliculites, les dermatofibromes, les lipomes ou les angiomes, et parfois un carcinome à cellules de Merkel est interprété à tort comme un carcinome basocellulaire, un carcinome spinocellulaire, un mélanome ou un sarcome. Le carcinome à cellules de Merkel (CCM) se développe rapidement, généralement en quelques semaines à quelques mois, sous la forme d’une tumeur asymptomatique, rebondissante et élastique, de couleur rouge-violet, avec une surface lisse et généralement brillante. (Fig. 1). En dermatoscopie, les MCC se présentent sous la forme de zones roses, sans structure, avec de fines lignes blanches ; à un stade avancé, on peut également observer des ulcérations, et les métastases satellites sont plus fréquentes. La localisation préférée du MCC est la peau chroniquement endommagée par le soleil de la région tête-cou (plus de la moitié des cas) et des extrémités distales (environ un tiers des cas) [2]. Outre l’exposition aux UV comme facteur de risque significatif du MCC, il existe une association avec le polyomavirus à cellules de Merkel (MCPyV) chez plus de la moitié des patients [2].
Outre la ligne directrice s2k en langue allemande sur le carcinome à cellules de Merkel de Becker et al. une guideline en anglais est également parue en 2022 [2,3]. L’intervenante a abordé plus en détail certaines recommandations importantes des lignes directrices en matière de diagnostic et de traitement.
Comment reconnaître un MCC à haut risque ?
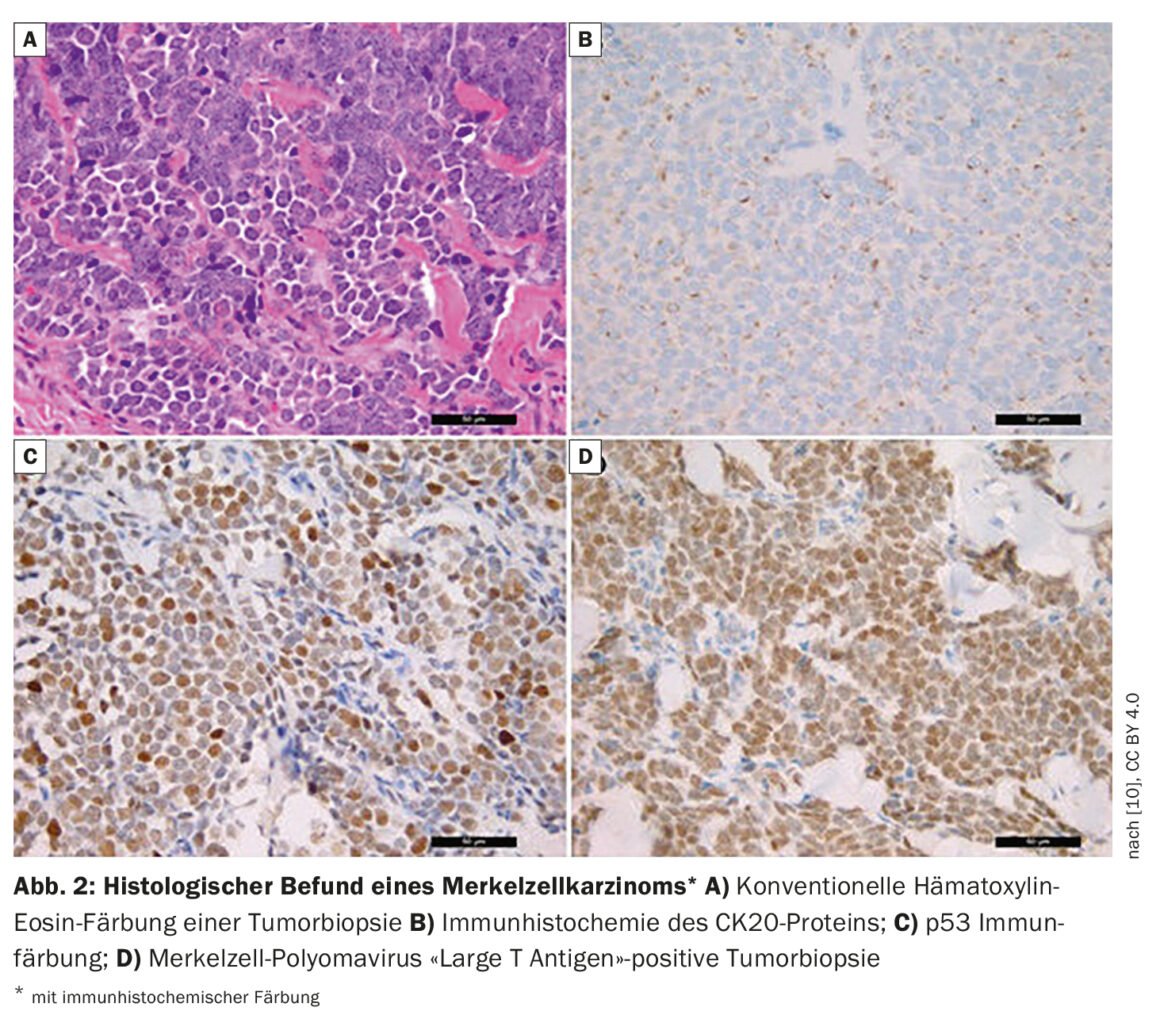
“Un quart des patients ont déjà des métastases dans les ganglions lymphatiques au moment du diagnostic initial et 8% ont des métastases à distance”, a déclaré le Dr Wysocki [1]. Chez les patients suspects de MCC, une biopsie ou une excision totale est effectuée en plus de l’inspection. Si un MCC a été prouvé histologiquement (encadré, Fig. 2), un FDG-PET/CT est réalisé. Si le résultat est négatif, c’est-à-dire que le patient ne présente pas de métastases dans les ganglions lymphatiques ou dans d’autres organes, une biopsie du ganglion lymphatique sentinelle est effectuée. Les caractéristiques des patients pour un MCC à haut risque incluent un âge supérieur à 77 ans et une exposition aux UV (des antécédents de PUVA conditionnent un risque 100 fois plus élevé). Les hommes ont un risque 2,5 fois plus élevé et les personnes immunodéprimées (VIH, hémopathies malignes, transplantés d’organes) ont également un risque accru. Les autres critères d’un MCC à haut risque sont la taille de la tumeur >2 cm, et l’invasion profonde au-delà du tissu adipeux sous-cutané. L’intervenante estime qu’il est important que l’épaisseur de la tumeur et la profondeur de pénétration soient documentées dans les rapports de pathologie. Souvent, les patients ont déjà des ganglions lymphatiques pathologiquement détectables ou il y a une invasion lymphovasculaire. Ce dernier serait un critère de haut risque selon les lignes directrices 2021 du NCCN (National Comprehensive Cancer Network)[4].
Excision : la distance de sécurité optimale est difficile à définir
Plus le carcinome à cellules de Merkel est détecté tôt et entièrement retiré lors de l’opération, meilleur est le pronostic. “La définition de la marge de sécurité dans le carcinome à cellules de Merkel est controversée”, a expliqué le Dr Wysocki [1]. Certains experts proposent de prendre une marge de sécurité de 1 cm et de procéder ensuite à une irradiation adjuvante. Les distances d’exérèse <1 cm sont également tolérables si l’on procède ensuite à une ré-irradiation adjuvante. La chirurgie de Mohs est aussi sûre que si l’on choisissait de grandes marges de sécurité pour une excision locale standard. C’est ce qui ressort notamment d’une publication de Carrasquillo et al. publiée en 2022. [5]. Si vous n’effectuez pas de ré-irradiation adjuvante, vous devez respecter des distances de sécurité d’environ 2 cm. “Mais la distance de sécurité optimale est difficile à définir et doit être déterminée au cas par cas en tumorboard”, a souligné l’intervenante [1].
Les experts recommandent une radiothérapie adjuvante
Après la chirurgie, une radiothérapie adjuvante du lit tumoral et des voies de drainage lymphatique environnantes peut réduire le risque de récidive de la maladie. Mais la radiothérapie adjuvante n’est pas seulement importante pour prévenir la récidive, elle améliore aussi la survie globale (Overall Survival, OS), la “Disease-free survival” et prévient l’apparition de métastases à distance, a constaté le Dr Wysocki [1,3]. Une irradiation adjuvante du lit tumoral primaire doit être réalisée dans les 8 semaines suivant l’exérèse chirurgicale, avec une dose totale de 50-55 Gy pour une localisation tumorale au niveau de la tête et du cou, ou 60-66 Gy pour les marges microscopiques et macroscopiques positives. “Lorsque nous procédons à une nouvelle excision de la tumeur primaire, nous faisons également la biopsie du ganglion sentinelle en même temps si le staging était normal”, a rapporté l’intervenante [1]. En effet, environ un quart des patients atteints de MCC présentent déjà des métastases microscopiques des ganglions lymphatiques au moment de la tumeur primaire. Cependant, la décision est prise au cas par cas, en fonction de l’état général du patient, de sa capacité à être anesthésié et de la localisation. A l’hôpital cantonal de Lucerne, tous les cas de MCC sont discutés lors du tumorboard interdisciplinaire. La radiothérapie peut également être utilisée en complément de la chirurgie et du traitement systémique pour les tumeurs à cellules de Merkel métastatiques. Une recommandation basée sur un consensus indique qu’en cas de biopsie positive du ganglion sentinelle, une irradiation adjuvante doit être effectuée dans la région du ganglion ou combinée à une dissection complète du ganglion.
Avelumab, anticorps anti-PDL-1 – de meilleurs résultats que la chimiothérapie
Auparavant, avec les chimiothérapies, on n’avait qu’un OS médian de 9 mois en situation métastatique. Les anticorps anti-PDL-1 représentent un grand progrès à cet égard, a souligné le Dr Wysocki [1]. L’anticorps anti-PD-L1 avelumab (Bavencio®) est autorisé en Suisse depuis 2017 pour le MCC métastatique (mCC) [6]. L’étude de phase II JAVELIN Merkel 2000 a évalué l’avelumab chez des patients ayant déjà reçu au moins un traitement cytostatique préalable du MCC [7,8].
Chez les 88 patients étudiés sous avelumab en deuxième ligne, un taux de réponse objective de 33% a été obtenu après un suivi médian de 65 mois ; la durée médiane de la réponse a été de 40,5 mois [7]. La survie sans progression (PFS) médiane était de 2,7 mois et le taux de PFS à 24 mois était de 26%. L’OS médian était de 12,6 mois et le taux d’OS était de 31% à 42 mois. Ce sont de très bons résultats par rapport à la chimiothérapie, a résumé l’intervenante [2]. L’étude a ensuite été étendue aux patients en première ligne de traitement [9]. Sur 116 patients traités par avelumab en première ligne (durée médiane de suivi : 21,2 mois), 35 ont répondu sur une période de ≥6 mois, ce qui correspond à un taux de réponse durable (durable response rate, DRR) de 30,2%. Le taux de réponse global (overall response rate, ORR) était de 39,7%. La PFS médiane était de 4,1 mois et l’OS à 1 an était d’environ 60%, soit légèrement supérieure à celle de l’avelumab en première ligne, a expliqué la conférencière [1,2]. Les effets secondaires induits par le traitement sont survenus chez 81% des patients traités par avelumab, mais étaient généralement légers (fatigue, faiblesse, démangeaisons). Des effets indésirables graves (le plus souvent de grade 3 ou 4) ont été documentés chez 14,7% des participants à l’étude.
Dans l’ensemble, le bilan de l’avelumab en tant qu’option thérapeutique est extrêmement positif. “Nous pouvons vraiment offrir aux patients une bonne thérapie systémique”, a résumé le Dr Wysocki [1]. La posologie recommandée est de 10 mg/kg toutes les deux semaines. On traite jusqu’à ce qu’il y ait une progression ou des effets secondaires graves. “Malheureusement, il n’existe pas encore d’autorisation de mise sur le marché pour le traitement adjuvant ou néoadjuvant”, a-t-elle déclaré [1].
Congrès : Swiss Derma Day
Littérature :
- «Update Merkel cell carcinoma», Dr. med. Anja Wysocki, Swiss Derma Day 12.01.2023
- Becker JC, et al.: S2k-Leitlinie – Merkelzellkarzinom – Update 2022. J Dtsch Dermatol Ges 2023; 21(3): 305–317.
- Gauci ML, et al.: European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO) and the European Organization for Research and Treatment of Cancer (EORTC). Diagnosis and treatment of Merkel cell carcinoma: European consensus-based interdisciplinary guideline – Update 2022. Eur J Cancer 2022; 171: 203–231.
- NCCN Clinical Practice Guidelines in Oncology: Merkel Cell Carcinoma, Version 1.2021 — February 18, 2021, https://merkelcell.org/wp-content/uploads/2021/02/NCCN-2021.pdf, (dernière consultation 21.03.2023)
- Carrasquillo OY, et al.: Mohs Micrographic Surgery Versus Wide Local Excision in the Treatment of Merkel Cell Carcinoma: A Systematic Review. Dermatol Surg 2022; 48(2): 176–180.
- Information sur les médicaments, www.swissmedicinfo.ch,(dernière consultation 21.03.2023)
- D’Angelo SP, et al.: Avelumab in patients with previously treated metastatic Merkel cell carcinoma (JAVELIN Merkel 200): updated overall survival data after >5 years of follow-up. ESMO Open. 2021; 6(6): 10029.
- Kaufman HL, et al.: Updated efficacy of avelumab in patients with previously treated metastatic Merkel cell carcinoma after ≥ 1 year of follow-up: JAVELIN Merkel 200, a phase 2 clinical trial. J Immunother Cancer 2018; 6(1): 7.
- D’Angelo SP, et al.: First-line avelumab in a cohort of 116 patients with metastatic Merkel cell carcinoma (JAVELIN Merkel 200): primary and biomarker analyses of a phase II study. J Immunother Cancer 2021; 9(7): e002646.
- Mokánszki A, et al.: Molecular Profiling of Merkel Cell Polyomavirus-Associated Merkel Cell Carcinoma and Cutaneous Melanoma. Diagnostics 2021, 11, 212. https://doi.org/10.3390/diagnostics11020212, www.mdpi.com/2075-4418/11/2/212, (dernière consultation 21.03.2023)
DERMATOLOGIE PRAXIS 2023; 33(2): 45–46
InFo ONKOLOGIE & HÄMATOLOGIE 2023; 11(2): 22–23