Des bouleversements dans le traitement de première ligne du cancer du poumon non à petites cellules muté par l’EGFR sont imminents. Avec l’étude FLAURA, l’osimertinib se présente pour la première fois avec assurance comme une option de traitement pour les patients naïfs de traitement.
Il ne se passe guère de conférence d’oncologie sans que des résultats importants ne soient obtenus dans le domaine du cancer du poumon non à petites cellules (NSCLC). Il n’est donc pas surprenant que les études sur le NSCLC aient également constitué une partie essentielle des présentations du congrès ESMO de cette année. Cette fois, il s’agissait du traitement de première ligne des patients avancés présentant des mutations de l’EGFR.
Brève rétrospective
En 2016, InFo ONKOLOGIE & HÄMATOLOGIE a, comme d’habitude, couvert la conférence européenne sur le cancer du poumon à Genève. A l’époque, deux late-breaking abstracts avaient démontré l’efficacité de l’osimertinib, un puissant inhibiteur sélectif de la tyrosine kinase (anti-EGFR) de troisième génération, dans la population susmentionnée. Il s’agissait de résultats d’études en partie regroupés des phases I et II. Les études concernées ont été nommées AURA P1, AURA extension et AURA 2. ils ont conclu à l’unanimité que l’osimertinib à la dose de 80 mg/d chez des patients atteints de NSCLC avancé et porteurs de la mutation T790M de l’EGFR, qui ont progressé sous un précédent traitement par EGFR-TKI, a permis d’obtenir un taux de réponse élevé sur une durée relativement longue, avec une survie sans progression encourageante et un profil d’effets indésirables contrôlable. Pourquoi est-ce important ? Maintenant, en cas de détection d’une mutation pilote de l’EGFR, ce qui correspond à environ 15% de tous les cas de NSCLC en Occident et à un bon tiers en Asie, il existe depuis longtemps des inhibiteurs spécifiques et ciblés de la tyrosine kinase (TKI) qui donnent de bons résultats. Dans la plupart des cas, la mutation T790M du gatekeeper est à l’origine de la résistance. L’osimertinib, en tant qu’inhibiteur de l’EGFR avec mutations sensibilisantes (EGFRm) et de la mutation de résistance T790M aux ITK, comble cette lacune et a donc été intégré avec reconnaissance au régime thérapeutique. En conséquence, l’osimertinib est également autorisé en Suisse en deuxième ligne depuis le milieu de l’année dernière.
Première ligne comme objectif
Cependant, il était déjà clair à l’époque que l’osimertinib allait également s’imposer en première ligne. Une autre présentation à l’ELCC 2016, avec des données positives sur 60 patients naïfs de traitement, laissait penser que c’était le cas. Sous osimertinib, la résistance est retardée. La tumeur doit manifestement chercher de nouveaux mécanismes de résistance en plus de la mutation EGFR-T790M. Que se passe-t-il donc si l’on bloque d’emblée cette “voie de secours” centrale à la tumeur ?
Une étude de phase III portant sur plus de 500 patients et comparant l’osimertinib à l’erlotinib et au gefitinib (“standard of care”) devrait apporter des éclaircissements définitifs. Les résultats étaient alors attendus dans environ un an et demi – ils ont été présentés à l’ESMO 2017. D’ores et déjà, la présentation a été convaincante. Il est probable que l’osimertinib sera bientôt disponible en première ligne.
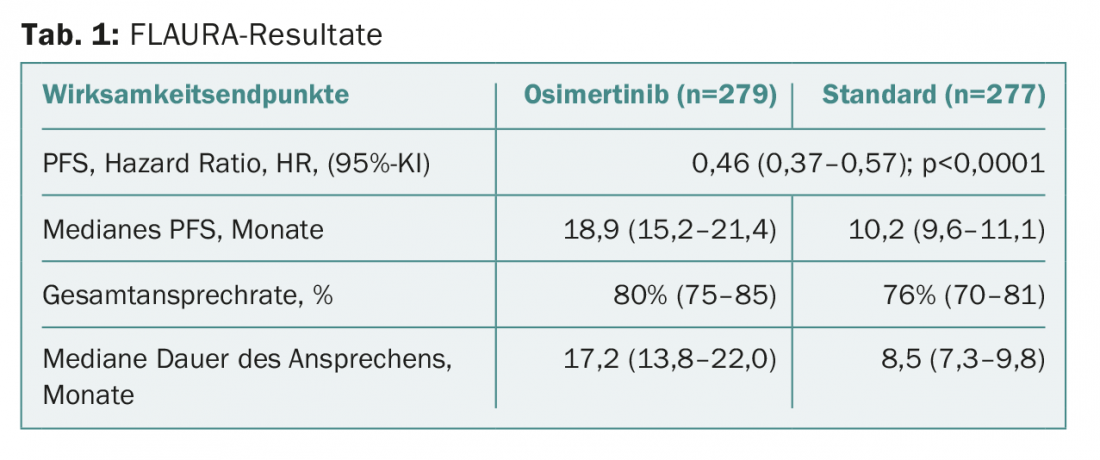
FLAURA – la success story continue
L’étude de phase III en question porte le nom évocateur de FLAURA. L’étude a porté sur 556 adultes d’Asie, d’Europe et d’Amérique du Nord atteints de NSCLC avancé avec des mutations activatrices de l’EGFR-TK, y compris la délétion de l’exon 19 et la mutation ponctuelle L858R dans l’exon 21. En première ligne, ils ont été randomisés pour recevoir le “standard of care”, qui est le gefitinib 250 mg/d ou erlotinib 150 mg/d, ou l’osimertinib 80 mg/d. Un crossover avec l’osimertinib était possible en cas de progression et de résistance au T790M. Les caractéristiques de base des patients, telles que le statut mutationnel, le sexe, les métastases du SNC et l’ethnie (asiatique, non asiatique), étaient réparties uniformément dans les bras.
Le critère d’évaluation principal, la survie sans progression, a été porté à 18,9 mois avec la substance testée, contre 10,2 mois avec le traitement standard. Cela correspond à une réduction du risque cliniquement et statistiquement significative de plus de la moitié. Les valeurs sont présentées dans le tableau 1 . Le bénéfice a été observé dans tous les sous-groupes prédéfinis (y compris les patients avec/sans métastases cérébrales au début de l’étude). Une analyse finale correspondante de la survie globale n’a pas encore été réalisée. L’analyse intermédiaire n’avait pas encore révélé de valeurs statistiquement significatives. A ce stade précoce, les données sont encore “immatures”. Il n’est donc pas encore possible de tirer des conclusions définitives à ce sujet. La durée de la réponse a été doublée sous osimertinib.
Parmi les événements indésirables les plus fréquents sous osimertinib, on retrouve, comme dans les études précédentes, la diarrhée (58%, dont 2% de grade 3 ou plus) ou encore la sécheresse cutanée (32%). Dans l’ensemble, les événements indésirables, quelle qu’en soit la cause, étaient aussi fréquents dans les deux bras. Les cas graves étaient plus fréquents sous traitement standard (ce qui était d’ailleurs également le cas pour le taux d’interruption du traitement correspondant : 13% contre 18%). Dans l’ensemble, l’osimertinib obtient donc de meilleurs résultats en termes de sécurité.
Tout le monde est-il d’accord ?
Les auteurs déduisent de ces données un profil risque/bénéfice supérieur pour l’osimertinib en première ligne. Le profil d’innocuité serait nettement meilleur malgré une durée de traitement globalement plus longue avec la substance testée (16,2 mois). Le fait que le bénéfice en termes de PFS avec/sans métastases cérébrales soit presque identique (HR 0,47 et 0,46) indique que l’osimertinib est actif à la fois dans le cerveau et au niveau systémique. Cela est particulièrement important pour les tumeurs mutées EGFR, car elles apparaissent souvent avec des métastases cérébrales. Les résultats concernant l’activité cérébrale sont étayés par le fait que 6% des patients du groupe osimertinib ont développé une progression du SNC, contre 15% dans le groupe standard. Il est en outre remarquable que les courbes de PFS divergent nettement très tôt et continuent à se distinguer clairement au cours de l’évolution. L’évolution de la survie globale semble également prometteuse. Il semble donc qu’il y ait un changement de paradigme.

L’écho parmi les professionnels et les visiteurs de la conférence a-t-il été tout aussi positif ? En majorité, oui. La pertinence pour la première ligne a été clairement attribuée à FLAURA. Des comparaisons ont été faites avec la situation des tumeurs avec mutation ALK et l’étude correspondante sur l’alectinib – récemment publiée dans le NEJM [1]. Là encore, il s’agissait de savoir si une utilisation en première ligne était supérieure à un “séquençage” des substances actives. Concrètement, cela signifie qu’avec le deuxième agent initial en première ligne, on obtient une PFS plus longue que celle qui serait obtenue avec un séquençage. Toutefois, si la situation est très claire pour ALK, elle est un peu plus complexe pour FLAURA. En effet, seule la moitié environ de la population de l’étude FLAURA aurait eu besoin et aurait bénéficié de l’osimertinib en deuxième ligne après un traitement de première ligne avec les agents établis (car elle aurait développé la résistance via T790M). Compte tenu du fait que l’étude inclut un grand nombre de patients qui n’auraient jamais développé une telle résistance, mais une autre, on ne s’attend pas à une PFS médiane de 19 mois. Des périodes aussi longues ne sont généralement obtenues qu’avec des patients qui se prêtent au séquençage de l’osimertinib (ce qui n’est pas le cas d’environ 50% de la population FLAURA d’un point de vue purement statistique). Pour tous les autres, il faut s’attendre à des périodes plus courtes, car ils ne peuvent souvent que se rabattre sur la chimiothérapie après un traitement de première ligne. Dans ce contexte, 19 mois de survie sans progression sont impressionnants et plaident effectivement pour une utilisation en première ligne dans cette population. En particulier, parce qu’il n’est jamais certain qu’il soit possible de passer à un traitement de deuxième ligne à base d’osimertinib ou à un autre traitement spécifique – étant donné qu’au début d’un traitement initial, on ne sait pas si les patients développeront des résistances telles que le T790M et bénéficieront donc des agents spécifiques -, les 19 mois de traitement à l’osimertinib pouvant être atteints d’emblée peuvent faciliter la décision d’utilisation en première ligne. Librement selon le principe : “the winner takes it all”.
Mais ce n’est pas si simple. Dans ce contexte, il est également important de poursuivre le développement de l’OS à FLAURA. Le dernier mot n’a pas encore été dit sur les tumeurs mutées par EGFR.
Source : European Society for Medical Oncology (ESMO) 2017 Congress, 8-12 septembre 2017, Madrid
Littérature :
- Peters S, et al : Alectinib versus crizotinib dans les cancers du poumon non à petites cellules ALK-positifs non résolus. N Engl J Med 2017 ; 377 : 829-838.
- Eggermont AM, et al : Prolonged survival in stage III melanoma with ipilimumab adjuvant therapy. NEJM 2016 ; 375 : 1845-1855.
- Weber J, et al : Adjuvant nivolumab versus ipilimumab dans le mélanome de stade III ou IV réséqué. NEJM 2017 septembre 10. DOI : 10.1056/NEJMoa1709030 [Epub ahead of Print].
- Long GV, et al : Adjuvant dabrafenib plus trametinib dans le mélanome stade III BRAF-muté. NEJM 2017 septembre 10. DOI : 10.1056/NEJMoa1708539 [Epub ahead of print].
InFo ONKOLOGIE 2017 ; 5(5) : 35-37











