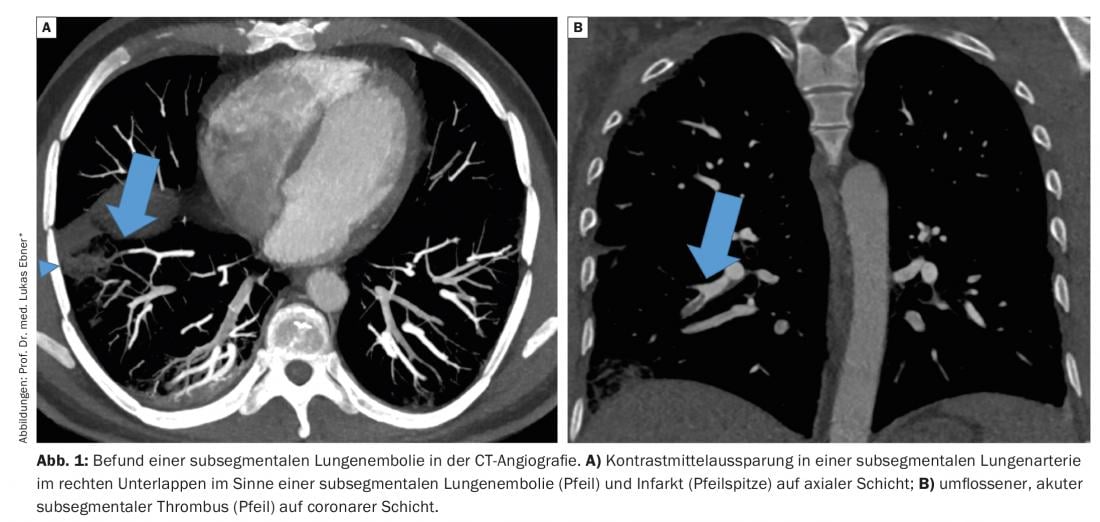
Les embolies pulmonaires (EP) sont regroupées avec les thromboses veineuses profondes sous le terme de thromboembolies veineuses. Alors qu’il y a 50 ans, le diagnostic n’était généralement posé qu’après la mort ou en présence de signes cliniques évidents tels qu’une dyspnée, des douleurs thoraciques ou un choc obstructif, en raison des possibilités limitées de diagnostic, le spectre de la LE a évolué au cours des dernières décennies.
Les embolies pulmonaires (EP) sont regroupées avec les thromboses veineuses profondes sous le terme de thromboembolies veineuses. Alors qu’il y a 50 ans, le diagnostic n’était généralement posé qu’après la mort ou en présence de signes cliniques évidents tels qu’une dyspnée, des douleurs thoraciques ou un choc obstructif, en raison des possibilités limitées de diagnostic, le spectre de la LE a évolué au cours des dernières décennies. Grâce à la disponibilité rapide de tests diagnostiques sensibles, il est possible de diagnostiquer des LE oligosymptomatiques en cas de symptômes non spécifiques ou de découvertes fortuites asymptomatiques, et de visualiser non seulement les embolies dans les parties centrales du système vasculaire pulmonaire, mais aussi les cavités de contraste dans les petites artères pulmonaires sous-segmentaires – appelées LE sous-segmentaires. (Fig. 1). Ces dernières années, l’importance clinique de la LE sous-segmentaire a été de plus en plus remise en question et, par conséquent, le paradigme courant selon lequel toutes les LE nécessitent un traitement anticoagulant a été remis en question. Nous examinons ci-dessous la pertinence clinique de la LE sous-segmentaire et résumons les preuves actuelles concernant le traitement.
Surdiagnostic des embolies pulmonaires non pertinentes sur le plan clinique ?
L’introduction de l’angiographie multidétecteur par tomodensitométrie (CTA) à la fin des années 1990 a révolutionné le diagnostic de la LE et a progressivement supplanté les autres méthodes de diagnostic. La résolution supérieure de la CTA multidétecteur par rapport à la scintigraphie de ventilation/perfusion ou à la CTA à détecteur unique permet de mieux visualiser les petits vaisseaux pulmonaires tels que les artères pulmonaires sous-segmentaires, ce qui augmente la sensibilité pour le diagnostic de LE. La disponibilité croissante des scanners et la forte augmentation des examens CTA multidétecteurs ont entraîné une augmentation significative des diagnostics de LE : aux États-Unis, l’incidence de la LE a augmenté de 80% au cours des 8 années suivant l’introduction de la CTA multidétecteurs. En revanche, la mortalité a légèrement diminué de 3% sur la même période, sans que la prévalence des facteurs de risque n’ait changé ou que le traitement de la LE n’ait connu d’amélioration significative. Cependant, les complications liées à l’anticoagulation, telles que les hémorragies gastro-intestinales et intracrâniennes ou les thrombocytopénies secondaires, ont également augmenté de 70%. La mortalité largement stable, associée à une augmentation significative des diagnostics de LE, indique un surdiagnostic des LE non pertinents sur le plan clinique. L’une des explications est l’augmentation du nombre de diagnostics de petites embolies, telles que les LE sous-segmentaires, grâce aux méthodes de diagnostic plus sensibles. Une revue systématique a montré que le pourcentage de LE sous-segmentaires avec CTA multi-détecteur a doublé par rapport à l’ancienne CTA à détecteur unique (9,4% contre 4,7%). Alors qu’avec les CTA multidétecteurs de 4 lignes, les sous-segments représentaient 7,1% de toutes les LE, avec les CTA multidétecteurs de 64 lignes, ils représentaient déjà 15%. Ces résultats renforcent l’hypothèse selon laquelle les progrès technologiques en matière d’imagerie sont responsables de l’augmentation du nombre de LE sous-segmentaires diagnostiqués et ont contribué à l’augmentation de l’incidence des LE observée. On peut s’attendre à ce que les LE sous-segmentaires deviennent encore plus fréquents avec la résolution toujours meilleure des nouveaux scanners.
Les défis du diagnostic de l’embolie pulmonaire sous-segmentaire
Le diagnostic correct d’une LE sous-segmentaire est difficile et la distinction entre une véritable LE sous-segmentaire et un artefact n’est pas toujours évidente. Cela a été illustré par une étude qui a examiné l’accord entre les radiologues pour diagnostiquer les LE en fonction de leur localisation. Contrairement à la concordance élevée entre les radiologues pour le diagnostic d’une LE proximale (kappa=0,83), elle était mauvaise pour les LE sous-segmentaires (kappa=0,23). Dans une autre étude, les LE sous-segmentaires diagnostiquées par CTA ont été comparées à un standard de référence composé de plusieurs modalités d’examen : la valeur prédictive positive de la CTA pour le diagnostic d’embolie dans les artères pulmonaires sous-segmentaires n’était que de 25%. Environ 10 à 15% des LE sous-segmentaires diagnostiquées sont interprétées comme faussement positives lors d’une seconde évaluation. Alors qu’une étude récemment publiée a même montré un taux de faux positifs de plus de 50%, 8% des résultats d’ACT supposés négatifs ont été privés d’une LE sous-segmentaire (faux négatifs). Ces conclusions soulignent l’importance d’une bonne qualité d’image pour interpréter correctement les résultats de l’ACT, car un contraste sous-optimal, des artefacts respiratoires, l’obésité ou des bouchons de mucus peuvent avoir un impact négatif sur la qualité de l’image et conduire ainsi à des résultats erronés et à un surdiagnostic des LE sous-segmentaires. Un diagnostic de LE faussement positif entraîne non seulement un traitement anticoagulant inutile, souvent à vie, avec les effets secondaires que l’on connaît, mais peut également avoir d’autres conséquences négatives, comme un stress émotionnel ou des examens de suivi inutiles.
Il existe des preuves que la sensibilité des D-dimères est plus faible pour les LE sous-segmentaires par rapport aux LE plus proximales. Dans une étude diagnostique, chez les patients présentant une faible probabilité clinique pré-test et des D-dimères <1000 µg/l, chez lesquels une LE a été confirmée, 10 sur 11 étaient en localisation sous-segmentaire. L’utilisation de l’algorithme YEARS pour le diagnostic de la LE, qui utilise un seuil de D-dimères plus élevé de 1000 µg/l pour effectuer un CTA en cas de faible probabilité clinique pré-test basée sur 3 variables, permet de diagnostiquer moins de LE sous-segmentaires qu’avec un algorithme basé sur le cut-off de D-dimères habituel de 500 µg/l. L’utilisation de seuils de D-dimères adaptés à l’âge permet également de réduire le diagnostic de LE sous-segmentaire.
La circulation pulmonaire, un filtre physiologique ?
Certains experts ont émis l’hypothèse que la circulation pulmonaire, en tant que filtre physiologique, a pour fonction d’empêcher les petits caillots d’atteindre la circulation artérielle. Selon cette hypothèse, de petits LE tels que ceux présents dans les artères pulmonaires sous-segmentaires pourraient également apparaître chez les personnes en bonne santé en raison de cette fonction de filtre physiologique. Dans une étude portant sur des sujets sains, 16% présentaient des défauts de perfusion à la scintigraphie pulmonaire. Des observations angiographiques plus anciennes sur l’évolution naturelle des LE montrent que même les embolies de grande taille peuvent être résorbées spontanément en quelques semaines par des processus fibrinolytiques endogènes.
Traitement anticoagulant : bénéfices et risques
En se basant sur les indications de surdiagnostic de LE, le risque de faux positifs et la pertinence clinique incertaine des LE sous-segmentaires, il n’est pas clair si toutes les LE – y compris les LE sous-segmentaires – nécessitent un traitement. Le traitement standard habituel de la thromboembolie veineuse est l’anticoagulation pendant au moins 3 mois. Alors que ce traitement est très efficace pour réduire le risque de récidive thromboembolique de 80 à 90%, il augmente également le risque de saignement. Le risque annuel d’hémorragie grave varie de 1 à 5 % selon les caractéristiques du patient. Les hémorragies graves sont associées à une mortalité d’environ 11%, et les hémorragies intracrâniennes en particulier, qui représentent environ 10% des hémorragies graves, entraînent une morbidité importante avec un handicap potentiel à vie. Les saignements légers surviennent chez près de la moitié des patients sous traitement anticoagulant et ne sont pas seulement une cause de stress et de réduction de la qualité de vie, mais représentent également une charge pour le système de santé en raison de l’augmentation des visites médicales, des interventions médicales et des coûts supplémentaires.
En raison de l’impact des complications hémorragiques, les bénéfices et les risques d’un traitement anticoagulant doivent toujours être soigneusement évalués, en particulier pour les thromboembolies dont la pertinence clinique n’est pas claire. En prenant l’exemple des thromboses veineuses profondes distales isolées, il a été démontré que tous les patients souffrant de petites thromboembolies veineuses ne nécessitent pas un traitement anticoagulant. Dans >90% des cas de thrombose veineuse distale isolée, il n’y a pas d’extension vers les sections veineuses plus proximales, comme dans le cas d’une thrombose veineuse proximale, ni d’autres complications en l’absence de traitement. Dans une étude randomisée contrôlée par placebo menée chez des patients à bas risque présentant des thromboses veineuses distales isolées symptomatiques, le traitement anticoagulant n’était pas supérieur au placebo pour prévenir les thromboembolies veineuses, mais il entraînait une augmentation significative du risque de saignement.
Ces dernières années, le rapport bénéfice/risque d’un traitement anticoagulant a également été de plus en plus remis en question chez les patients atteints de LE sous-segmentaire, car de petites études d’observation ont décrit des évolutions non compliquées chez des patients atteints de LE sous-segmentaire, même sans anticoagulation.
Évolution clinique des LE sous-segmentaires avec et sans anticoagulation
La question de savoir si le pronostic est différent pour les LE sous-segmentaires ou plus proximales est controversée dans la littérature. Les données des études prospectives ont montré un risque similaire de récidive thromboembolique, de mortalité et d’hémorragie chez les patients anticoagulés non sélectionnés, quelle que soit la localisation anatomique du LE. Même si ces études ne suggèrent pas de différences dans l’évolution clinique des patients traités pour une LE sous-segmentaire ou plus proximale, elles ne fournissent pas de réponse à la question de savoir si le pronostic est différent pour les LE sous-segmentaires avec ou sans traitement anticoagulant. De plus, ces études ne recherchaient pas systématiquement les thromboses veineuses profondes des jambes ; étant donné que les thromboses veineuses profondes non diagnostiquées peuvent augmenter le risque de récidive thromboembolique, elles ne fournissent pas de données robustes sur le pronostic des LE sous-segmentaires isolées (sans thrombose veineuse des jambes concomitante).
Dans de nombreux cas, les LE sous-segmentaires sont manquées par certaines procédures diagnostiques sans qu’il y ait de conséquences négatives (non traitées !). Dans une étude randomisée, les patients suspectés de LE ont été évalués soit par CTA multidétecteur, soit par CTA monodétecteur, soit par scintigraphie de ventilation/perfusion. Bien que l’ACT multidétecteur ait permis de diagnostiquer et donc de traiter davantage de LE par rapport aux deux autres modalités, aucune différence n’a été observée entre les 3 groupes en ce qui concerne le risque de récidive thromboembolique à 3 mois chez les patients non traités. Les LE supplémentaires diagnostiquées par CTA multidétecteur étaient donc cliniquement insignifiantes. Cette observation fournit des preuves indirectes que toutes les petites LE sous-segmentaires ne sont pas cliniquement pertinentes et ne nécessitent pas un traitement anticoagulant. Ainsi, dans ses directives publiées en 2018, l’American Society of Hematology préfère, dans certaines situations, la réalisation d’une scintigraphie planaire de ventilation/perfusion à la CTA pour le diagnostic du LE, car cette dernière n’est pas seulement associée à une exposition accrue aux radiations, mais entraîne également un plus grand nombre de diagnostics de LE sous-segmentaires dont la signification clinique n’est pas claire.
Plusieurs petites études d’observation, pour la plupart rétrospectives, ont comparé l’évolution clinique avec et sans anticoagulation chez des patients atteints de LE sous-segmentaire. Récemment, 14 de ces études ont été résumées dans une revue systématique et une méta-analyse. Chez 715 patients atteints de LE sous-segmentaire, les récidives thromboemboliques ainsi que la mortalité ne différaient pas significativement avec ou sans anticoagulation (tableau 1). Ces résultats suggèrent que les patients atteints de LE sous-segmentaire ont un pronostic similaire à ceux sous traitement, même sans traitement anticoagulant. Les études incluses présentent cependant des limites méthodologiques importantes (petite taille d’échantillon, design d’étude généralement rétrospectif), les populations d’étude incluses étaient très hétérogènes et les critères de décision du traitement généralement inconnus, ce qui rend les groupes de patients avec et sans anticoagulation difficilement comparables. Il n’existe actuellement aucune donnée issue d’études randomisées sur la sécurité d’une stratégie thérapeutique sans anticoagulation.
Le risque de saignement associé à l’anticoagulation mérite une attention particulière, compte tenu de la pertinence discutable de la LE sous-segmentaire. Le risque de saignement significatif chez les patients anticoagulés atteints de LE sous-segmentaire est très variable et varie de 1,7% à 34% en fonction des caractéristiques du patient et de la définition du saignement.

Prise en charge des patients atteints d’embolie pulmonaire sous-segmentaire : que disent les directives ?
Sur la base des preuves limitées actuellement disponibles, plusieurs sociétés savantes et groupes d’experts ont publié ces dernières années des recommandations sur le traitement des patients atteints de LE sous-segmentaire. Les directives de l’American College of Chest Physicians (ACCP) proposent un suivi clinique sans traitement anticoagulant chez certains patients à risque profond atteints de LE sous-segmentaire, si une thrombose veineuse profonde concomitante est exclue (recommandation faible avec un niveau de preuve faible). Si la sonographie de compression n’évalue que les veines proximales de la jambe pour la présence d’une thrombose veineuse profonde, une ou plusieurs sonographies d’évolution sont nécessaires pour exclure une thrombose qui s’étend vers la partie proximale. Chez les patients à haut risque (définis comme ceux qui n’ont pas de facteurs de risque réversibles, les patients immobiles ou hospitalisés ou ceux qui ont un cancer actif ou des réserves cardiopulmonaires insuffisantes), le traitement anticoagulant doit être privilégié. Il est conseillé de prendre en compte le risque de saignement dans la décision thérapeutique. De même, l’American College of Emergency Physicians recommande une stratégie thérapeutique individualisée basée sur le profil de risque du patient. L’European Society of Cardiology (ESC) recommande que le diagnostic de LE sous-segmentaire soit confirmé par un radiologue thoracique expérimenté. Pour les patients ambulatoires sans cancer et sans thrombose veineuse de jambe concomitante, une stratégie de surveillance clinique sans anticoagulation est recommandée s’il n’y a qu’une seule LE sous-segmentaire, alors qu’une anticoagulation est proposée pour tous les autres (y compris les patients avec plusieurs LE sous-segmentaires). Il n’existe aucune preuve de ces différentes recommandations de traitement en fonction du nombre de LE sous-segmentaires, et cette distinction n’est pas faite dans d’autres directives et recommandations d’experts.
Malgré ces recommandations, la plupart des patients atteints de LE sous-segmentaire isolée sont aujourd’hui anticoagulés et la durée du traitement ne diffère pas de celle des patients atteints de LE proximale localisée. L’une des raisons possibles est le nombre limité de preuves en faveur d’une stratégie thérapeutique sans anticoagulation – à ce jour, il n’existe pas de données issues d’études prospectives ou randomisées de qualité et de taille suffisante.
Perspectives
Une étude de gestion prospective internationale en cours examine une stratégie thérapeutique sans anticoagulation chez les patients à bas risque présentant une LE sous-segmentaire et chez lesquels une thrombose veineuse profonde proximale a été exclue par échographie de compression en série (ClinicalTrials.gov NCT01455818). En Suisse, l’étude SAFE-SSPE a récemment été lancée, une étude randomisée de non-infériorité dans laquelle les patients à bas risque présentant une LE sous-segmentaire isolée (c’est-à-dire sans thrombose veineuse profonde) sont randomisés pour recevoir un traitement anticoagulant ou un placebo -(ClinicalTrials.gov NCT04263038). Les deux groupes de traitement sont suivis cliniquement pendant 90 jours et comparés en termes de risque de récidive thromboembolique, de saignements, de mortalité ainsi que de qualité de vie et de critères économiques. L’étude permettra de savoir si les traitements anticoagulants inutiles peuvent être évités chez certains patients atteints de LE, réduisant ainsi le risque d’hémorragie. Si une stratégie thérapeutique sans anticoagulation s’avère sûre, l’étude pourrait marquer un tournant par rapport au paradigme courant du traitement anticoagulant pour tous les LE.
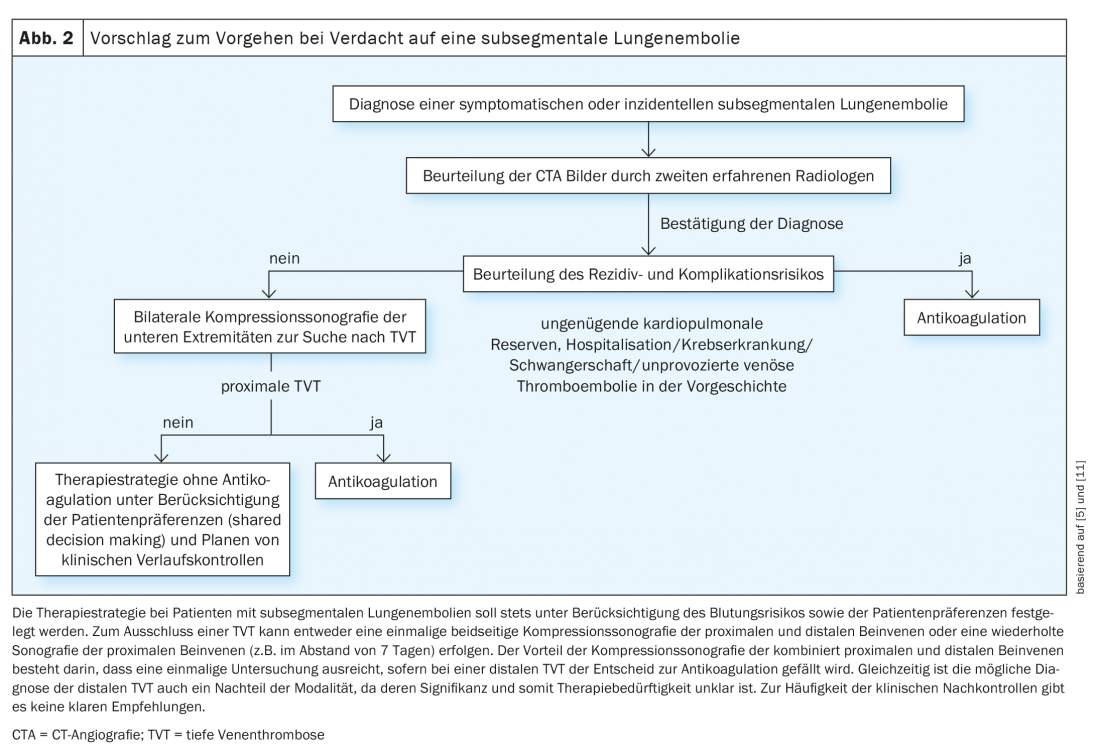
En attendant les résultats d’études robustes sur le traitement optimal des patients atteints de LE sous-segmentaire, il convient d’éviter le sur-diagnostic et le sur-traitement. Les examens CTA inutiles peuvent être évités en utilisant des algorithmes de diagnostic validés avec détermination de la probabilité clinique pré-test et des tests de D-dimères. Pour les tests de D-dimères hautement sensibles, des cut-off adaptés à l’âge, qui se sont avérés sûrs dans des études randomisées, peuvent contribuer encore davantage à la réduction des examens CT, ce qui entraîne à son tour une réduction de la prévalence des LE sous-segmentaires. Il en va de même pour l’algorithme YEARS mentionné ci-dessus, qui est plus facile à utiliser et peut donc également améliorer l’adhésion à la procédure diagnostique correcte en cas de suspicion de LE. Une autre façon de réduire le surdiagnostic est d’utiliser l’algorithme PERC basé sur 8 critères cliniques chez les patients dont la suspicion clinique de LE est faible. Si aucun des 8 critères n’est positif, il est possible de renoncer à un diagnostic supplémentaire dans cette population à bas risque sans passer à côté de LE importantes, comme l’a montré une étude randomisée récemment publiée. En raison des défis décrits ci-dessus pour le diagnostic des lésions sous-segmentaires, le diagnostic doit être confirmé par un second radiologue expérimenté avant toute décision thérapeutique – toutes les lésions sous-segmentaires suspectées ne sont pas réelles ! La difficulté diagnostique des LE sous-segmentaires a été récemment prise en compte avec la publication de critères radiologiques qui devraient être pris en compte lors de l’établissement du diagnostic par CTA. Selon l’American Society of Hemtology, la scintigraphie planaire de ventilation/perfusion devrait également être préférée à la CTA comme modalité diagnostique de choix chez les patients présentant une probabilité faible ou modérée de pré-test et une probabilité élevée de résultat concluant, notamment pour réduire le risque de diagnostic de LE sous-segmentaire, sous réserve de disponibilité et d’expertise locales. Si la LE sous-segmentaire est confirmée, une stratégie thérapeutique sans anticoagulation peut être évaluée chez des patients sélectionnés présentant un risque de récidive et de complications profondes, après avoir exclu une thrombose veineuse profonde, en tenant compte notamment des préférences des patients et du risque hémorragique. (Fig. 2). Cela implique la réalisation d’une échographie de compression des veines des jambes des deux côtés, bien que la stratégie optimale ne soit pas connue (échographie de compression unique de l’ensemble des veines proximales et distales des jambes vs échographie de compression en série des veines proximales des jambes uniquement).
En résumé, la signification clinique de la LE sous-segmentaire n’est pas claire et, en raison du faible niveau de preuve sur le traitement optimal, elle fait l’objet de controverses. Compte tenu de l’utilité incertaine du traitement anticoagulant chez les patients atteints de LE sous-segmentaire et présentant un faible risque de récidive et de complications, les résultats d’études prospectives et randomisées de haute qualité seront particulièrement importants pour éviter les complications hémorragiques potentiellement inutiles liées à l’anticoagulation et contribuer à améliorer la qualité du traitement.
Messages Take-Home
- Avec l’augmentation du nombre de scanners et les progrès techniques, l’incidence des embolies pulmonaires (EP) sous-segmentaires a augmenté au fil des ans ; elles représentent actuellement environ 15% de toutes les EP.
- La signification clinique des LE sous-segmentaires isolés n’est pas claire.
- La stratégie de traitement optimale des LE sous-segmentaires isolées (sans thrombose veineuse profonde concomitante) est controversée en raison du manque de données probantes.
- Les directives actuelles proposent une stratégie de traitement sans anticoagulation chez les patients atteints de LE sous-segmentaire, à condition qu’une thrombose veineuse profonde concomitante soit exclue et qu’il existe un risque profond de récidive et de complication.
Littérature :
- Wiener RS, Schwartz LM, Woloshin S : When a test is too good : how CT pulmonary angiograms find pulmonary emboli that do not need to be found. BMJ 2013 ; 347 : f3368.
- Wiener RS, Schwartz LM, Woloshin S : Time trends in pulmonary embolism in the United States : evidence of overdiagnosis. Archives of Internal Medicine 2011 ; 171(9) : 831-837.
- Carrier M, Righini M, Wells PS, et al : Subsegmental pulmonary embolism diagnosed by computed tomography : incidence and clinical implications. A systematic review and meta-analysis of the management outcome studies. Journal of Thrombosis and Haemostasis : JTH 2010 ; 8(8) : 1716-1722.
- van der Pol LM, Bistervels IM, van Mens TE, et al. : Lower prevalence of subsegmental pulmonary embolism after application of the YEARS diagnostic algorithm. British Journal of Haematology 2018 ; 183(4) : 629-635.
- Kearon C, Akl EA, Ornelas J, et al : Antithrombotic Therapy for VTE Disease : CHEST Guideline and Expert Panel Report. Chest 2016 ; 149(2) : 315-352.
- Carrier M, Righini M, Le Gal G : Embolie pulmonaire sous-segmentaire symptomatique : quelle est l’étape suivante ? Journal of Thrombosis and Haemostasis : JTH 2012 ; 10(8) : 1486-1490.
- Stoller N, Limacher A, Mean M, et al : Présentation clinique et résultats chez les patients âgés présentant un embolisme pulmonaire sous-segmentaire isolé symptomatique. Thrombosis Research 2019 ; 184 : 24-30.
- Lim W, Le Gal G, Bates SM, et al : American Society of Hematology 2018 guidelines for management of veinous thromboembolism : diagnosis of veinous thromboembolism. Blood Advances 2018 ; 2(22) : 3226-3256.
- Bariteau A, Stewart LK, Emmett TW, Kline JA : Systematic review and meta-analysis of outcomes of patients with subsegmental pulmonary embolism with and without anticoagulation treatment. Acad Emerg Med 2018.
- Baumgartner C, Klok FA, Carrier M, et al : Clinical Surveillance vs. Anticoagulation For low-risk patiEnts with isolated SubSegmental Pulmonary Embolism : protocol for a multicentre randomised placebo-controlled non-inferiority trial (SAFE-SSPE). BMJ Open 2020 ; 10(11) : e040151.
- Swan D, Hitchen S, Klok FA, Thachil J : The problem of under-diagnosis and over-diagnosis of pulmonary embolism. Thrombosis Research 2019 ; 177 : 122-129.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2021 ; 3(1) : 4-8