Lors du congrès ASCO de cette année, début juin à Chicago, de nouveaux résultats de l’étude de phase Ib combinant l’inhibition de PD1 et de CTLA4 ont été présentés. Ils sont extrêmement prometteurs. En situation adjuvante, l’ipilimumab seul a atteint le critère d’évaluation principal du survie sans récidive.
Les nouvelles données de l’étude-004, une étude de phase I qui a évalué la sécurité, l’activité antitumorale et la pharmacocinétique de la combinaison de l’inhibition de PD1 (nivolumab) et de CTLA4 (ipilimumab), donnent de l’espoir aux patients atteints de mélanome avancé. Ils ont été présentés au congrès ASCO de cette année par Mario Sznol, MD, Yale : “Deux autres études sont actuellement en cours pour tester cette combinaison dans des phases ultérieures. Nos résultats justifient en tout cas de tels efforts de recherche”.
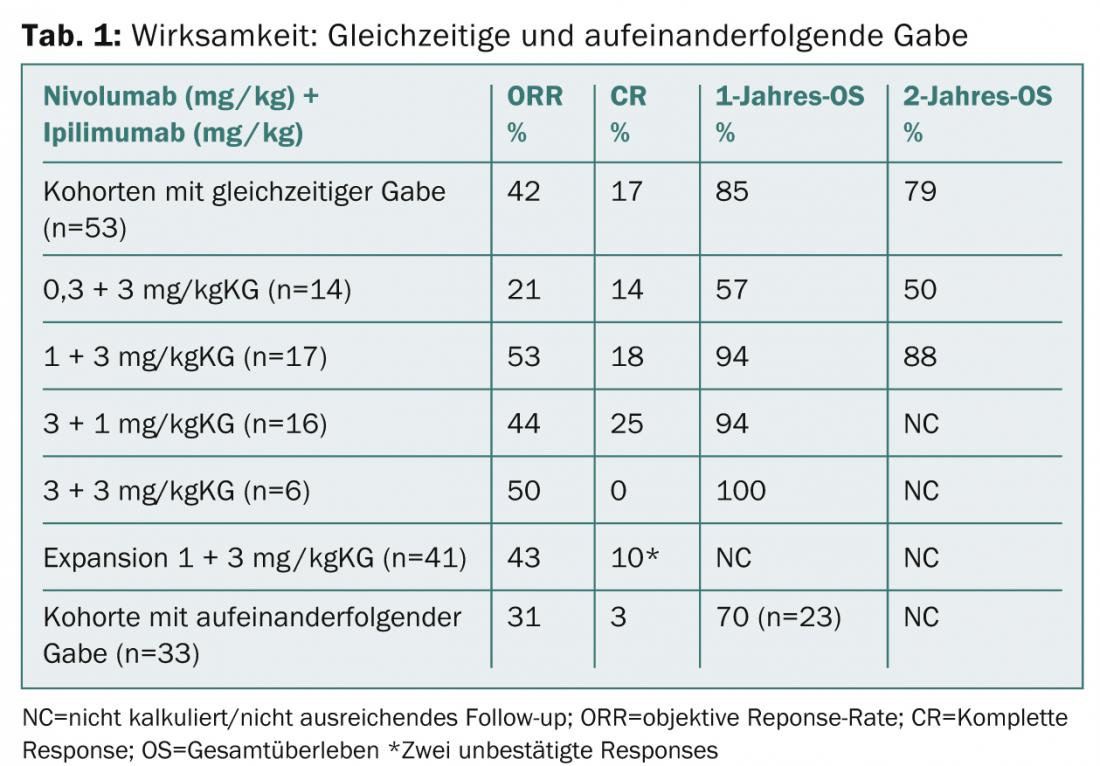
Les substances actives ont été administrées soit simultanément, soit successivement (n=127). Les patients pouvaient avoir pris jusqu’à trois thérapies systémiques avant de participer.
Le groupe recevant simultanément (nivolumab 1 mg/kgKG plus ipilimumab 3 mg/kgKG [n=17]) a obtenu un taux de survie globale à 1 an de 94, et un taux de survie globale à 2 ans de 88%. Dans la cohorte étendue, 41 patients ont reçu le régime susmentionné toutes les trois semaines pendant quatre doses, puis le nivolumab seul à la dose de 3 mg/kgKG toutes les deux semaines jusqu’à la progression. La recherche se poursuit également à ces doses dans les études de phase II et III en cours (CheckMate-069 et -067).
La réponse a été observée indépendamment du statut mutationnel de BRAF ou de la sécrétion de PD-L1.
Aucun nouveau problème de sécurité n’a été identifié dans le suivi étendu. Les effets indésirables de grade 3-4 liés au traitement sont survenus chez 62% des patients dans les cohortes avec administration concomitante. Les principaux résultats de la mise à jour de l’étude sont présentés dans le tableau 1.
Ipilimumab dans le cadre d’un traitement adjuvant
Une étude de phase III randomisée en double aveugle a également montré que l’ipilimumab à une dose de 10 mg/kgKG améliorait significativement la survie sans récidive (RFS, temps jusqu’à la récidive ou le décès) par rapport au placebo, même à un stade plus précoce du mélanome. Les participants étaient des patients atteints de mélanome (stade III) et présentant un risque élevé de récidive après une résection chirurgicale complète (régime adjuvant). Il s’agit désormais de la troisième étude de phase III dont les résultats sont positifs pour l’ipilimumab dans le traitement du mélanome.
“Bien que la probabilité de récidive soit très élevée au stade III, il existe très peu d’options thérapeutiques permettant de réduire le risque de métastases après une opération”, a déclaré le professeur Alexander Eggermont, Villejuif, qui a présenté les résultats à l’ASCO.
Dans l’étude, une réduction de 25% du risque de récidive ou de mortalité a été observée (HR=0,75 ; IC 95%=0,64-0,90 ; p=0,0013). Après trois ans, 46,5% des patients sous ipilimumab et 34,8% des patients sous placebo n’ont pas eu de récidive. Le RFS médian était de 26,1 resp. 17,1 mois.
Les effets secondaires étaient largement comparables à ceux de l’ipilimumab dans le traitement du mélanome avancé. Ils étaient généralement d’origine immunitaire et pouvaient être facilement traités dans le cadre des protocoles de prise en charge de cette substance active. Une incidence plus élevée d’endocrinopathies a été observée. 48,8% ont interrompu le traitement par ipilimumab en raison d’effets secondaires (vs 1,7% sous placebo). Cinq décès étaient liés au verum.
Selon le professeur Eggermont, ces résultats sont pertinents, d’une part, parce que l’ipilimumab est le premier inhibiteur de point de contrôle immunitaire à montrer une amélioration dans un tel cadre de traitement et, d’autre part, parce que le bénéfice a été observé dans tous les sous-groupes, y compris celui présentant le plus grand risque de récidive. On peut donc supposer que l’ipilimumab pourrait être largement utilisé à l’avenir sur différentes lignes de traitement et à différents stades de la maladie. D’autres études évaluant la molécule en situation adjuvante sont en cours. En attendant, l’ipilimumab est autorisé à la dose de 3 mg/kgKG pour le traitement du mélanome avancé (non résécable ou métastatique) chez les adultes ayant déjà reçu un traitement.
Source : 50
th
Annual Meeting of the American Society of Clinical Oncology (ASCO), 30 mai au 3 juin 2014, Chicago
InFo ONKOLOGIE & HÄMATOLOGIE 2014 ; 2(5) : 20-21
SPÉCIAL CONGRÈS 2014 ; 30-32











