La plupart des hémangiomes ne nécessitent pas de traitement en raison de leur potentiel de régression élevé. Jusqu’à une surface d’environ 2× 2 cm et une épaisseur d’environ 4 mm, on peut réaliser une cryothérapie électrique à –32 °C. Depuis quelques temps, le propranolol est considéré dans les directives comme le traitement de première intention des hémangiomes compliqués, lorsqu’un traitement est indiqué. Le taux de réponse est de 98%. Les effets indésirables d’un traitement par le propranolol sont temporaires, doses-dépendants et, dans la grande majorité des cas, anodins et réversibles. Connaître les diagnostics différentiels d’un hémangiome et instaurer un concept thérapeutique individuel différencié constituent le véritable défi pour pouvoir finalement obtenir, pour l’enfant concerné, un résultat thérapeutique optimisé et un haut niveau de satisfaction du patient. Le diagnostic et le traitement des anomalies vasculaires nécessitent une collaboration interdisciplinaire entre chirurgiens, pédiatres ou dermatologues spécialisés, ainsi que radiologues, angiologues et, le cas échéant, d’autres disciplines spécialisées.
En raison de leur important potentiel de régression, la plupart des hémangiomes ne nécessitent pas de traitement et il suffit de contrôler leur évolution. Mais dans le cas d’hémangiomes dont la localisation est critique sur le plan fonctionnel et esthétique, ainsi que dans le cas de ceux dont la taille progresse rapidement, il est crucial d’aller très tôt consulter un spécialiste et de débuter à temps un traitement. L’objectif du traitement est d’arrêter la croissance et, le cas échéant, d’instaurer une régression précoce et rapide.
Cryothérapie
Jusqu’à une surface d’environ 2× 2 cm et une épaisseur d’environ 4 mm, on peut réaliser une cryothérapie électrique à –32 °C. En fonction de la localisation et de l’âge du nourrisson, la durée d’une seule séance est d’environ 8 à 15 secondes. La procédure n’est pas douloureuse et peut être répétée. Aucune cicatrice n’est à craindre si la procédure est réalisée correctement. Après le traitement, on peut parfois observer l’apparition de petites vésicules ou croûtes qui peuvent être traitées localement par une pommade cicatrisante grasse. L’objectif du traitement est d’arrêter la croissance et, le cas échéant, d’induire une involution.

Traitement par le propranolol
Une découverte fortuite faite en 2008 dans un centre hospitalier universitaire en France a initié un changement dans le traitement des hémangiomes. L’hémangiome facial d’un nourrisson a été traité par des corticostéroïdes. Ce traitement a entraîné une cardiomyopathie hypertrophique obstructive qui a nécessité un traitement par le propranolol, un bêtabloquant non sélectif. Très peu de temps après, on a constaté une nette régression de l’hémangiome. Par la suite, le propranolol a progressivement remplacé les médicaments utilisés jusqu’à présent et qui provoquaient des effets indésirables, parfois irréversibles et importants.
Les méthodes utilisées par le passé, telles que la corticothérapie, le traitement par laser interstitiel, les interventions chirurgicales et l’utilisation d’agents chimiothérapeutiques ont de plus en plus perdu en importance et ne sont plus utilisées que dans des cas particuliers.
Depuis quelques temps, le propranolol est considéré dans les directives comme le traitement de première intention des hémangiomes compliqués, lorsqu’un traitement est préconisé. Début 2014, le propranolol a obtenu l’autorisation de mise sur le marché des autorités de contrôle des médicaments américaines et européennes, et peu après aussi de Swissmedic, en tant que préparation magistrale et produit de marque d’une solution à base de propranolol pour le traitement des hémangiomes compliqués du nourrisson.
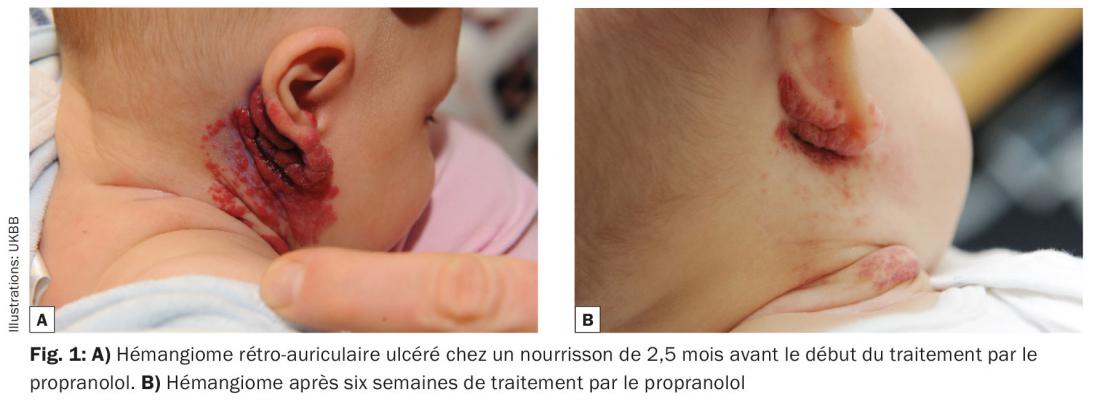
Le taux de réponse est de 98%. Une régression de plus de 75% se produit dans 81% des cas en l’espace de 7,9 mois (fig. 1 et 2).
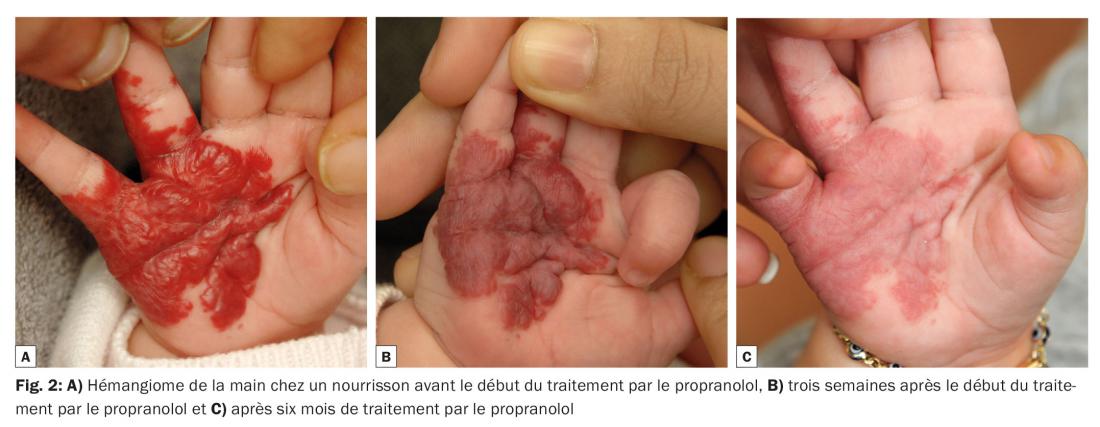
Les effets indésirables incluent une sensation de mains et de pieds froids, des troubles du sommeil, une agitation nocturne, des diarrhées et des symptômes pulmonaires. Dans moins de 1% des cas, on observe des bradycardies, des hypoglycémies ou des hypotensions. Les études n’ont pas mis en évidence de troubles du développement psychomoteur. Les effets indésirables d’un traitement par le propranolol sont temporaires, doses-dépendants et, dans la grande majorité des cas, anodins et réversibles.
Une anamnèse complète et les antécédents familiaux de troubles cardiovasculaires congénitaux doivent être établis avant le début du traitement. En plus de l’examen clinique, qui sera plus particulièrement axé sur l’auscultation cardiaque, un ECG doit être réalisé. En cas d’anomalies dans l’anamnèse ou à l’examen clinique, il faut au préalable réaliser, le cas échéant, d’autres examens. La dose de propranolol est progressivement augmentée à 2 mg/kg de poids corporel/jour, répartis en deux ou trois prises séparées. Pendant la titration, il faut surveiller la fréquence cardiaque, la pression artérielle et la glycémie. Lors des examens de suivi ultérieurs, il faut se renseigner sur d’éventuels effets indésirables, contrôler la pression artérielle et la fréquence cardiaque et ajuster la dose en fonction du poids actuel.
La durée du traitement est généralement d’environ six à neuf mois. Dans les rares cas où l’hémangiome réapparaît après la fin du traitement, on peut sans problème réintroduire le propranolol, et ce, en règle générale, pour une période de deux à trois mois. L’arrêt du traitement ne nécessite pas de diminution progressive de la dose.
Traitement par des bêtabloquants topiques
Depuis quelques années, outre le traitement bêtabloquant systémique, on peut également procéder à une application topique. Mais dans les directives relatives au traitement de l’hémangiome, on fait encore preuve de grandes réticences vis-à-vis de cette recommandation. Ceci s’explique par le fait, qu’à ce jour, il n’existe qu’une seule étude contrôlée relative à l’application topique de bêtabloquants pour le traitement de l’hémangiome infantile.
Dans le cadre de cette étude, par rapport à un placebo, on a observé une diminution significative de la taille à partir de la semaine 20 et une différence de couleur significative à partir de la semaine 24 sous gel de timolol 0,5%. Aucune différence n’a été observée quant à la fréquence cardiaque et la pression artérielle. L’effet sur le volume, la croissance et l’aspect est apparu nettement plus tard et plus lentement que lors d’un traitement par propranolol administré par voie orale.
Par ailleurs, on ne dispose pas de données pharmacologiques suffisantes relatives à la profondeur de pénétration, la résorption et l’effet systémique. On ne connaît pas la biodisponibilité du timolol lors d’une absorption par la peau intacte. Il faut partir d’une absorption accrue, et ce surtout en cas d’ulcérations et en cas d’hémangiomes situés à proximité de muqueuses. Toutefois, un effet indésirable de type trouble du sommeil n’a, à ce jour, été décrit dans la littérature que chez un seul patient lors de l’application topique d’un bêtabloquant dans le cadre du traitement d’un hémangiome.
Résidus
On peut, dans certains cas isolés, observer des résidus gênants après la phase de régression. Dans de tels cas, on peut procéder à une résection chirurgicale ou à un traitement laser à colorant pulsé. Il est recommandé d’éliminer les résidus avant l’entrée à l’école ou à l’adolescence parce que, d’une part, une grande partie de la régression a déjà eu lieu et, d’autre part, les enfants peuvent participer à la décision de procéder à une intervention, et l’approuver.
Le diagnostic différentiel est un défi
Les hémangiomes, avec d’autres pathologies, font partie du complexe des anomalies vasculaires (fig. 3).
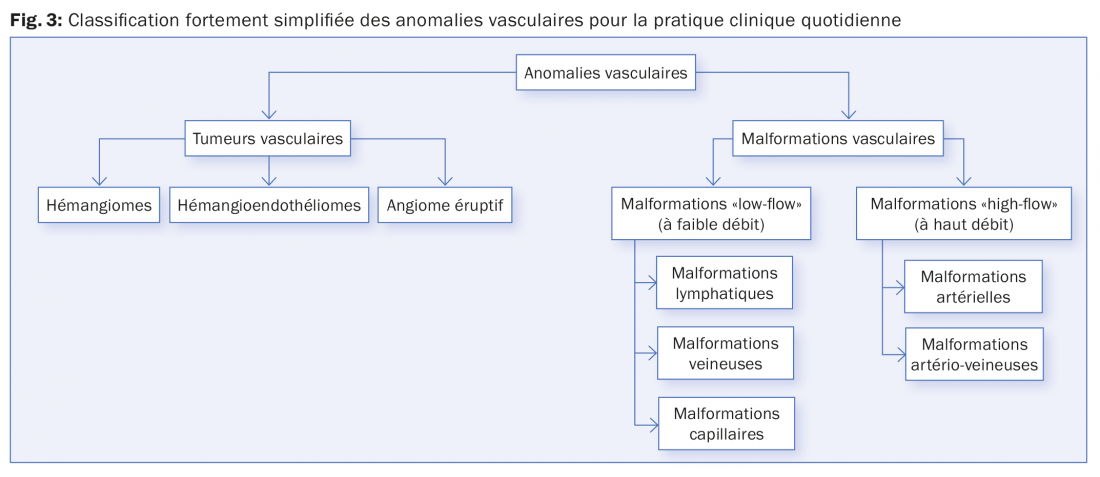
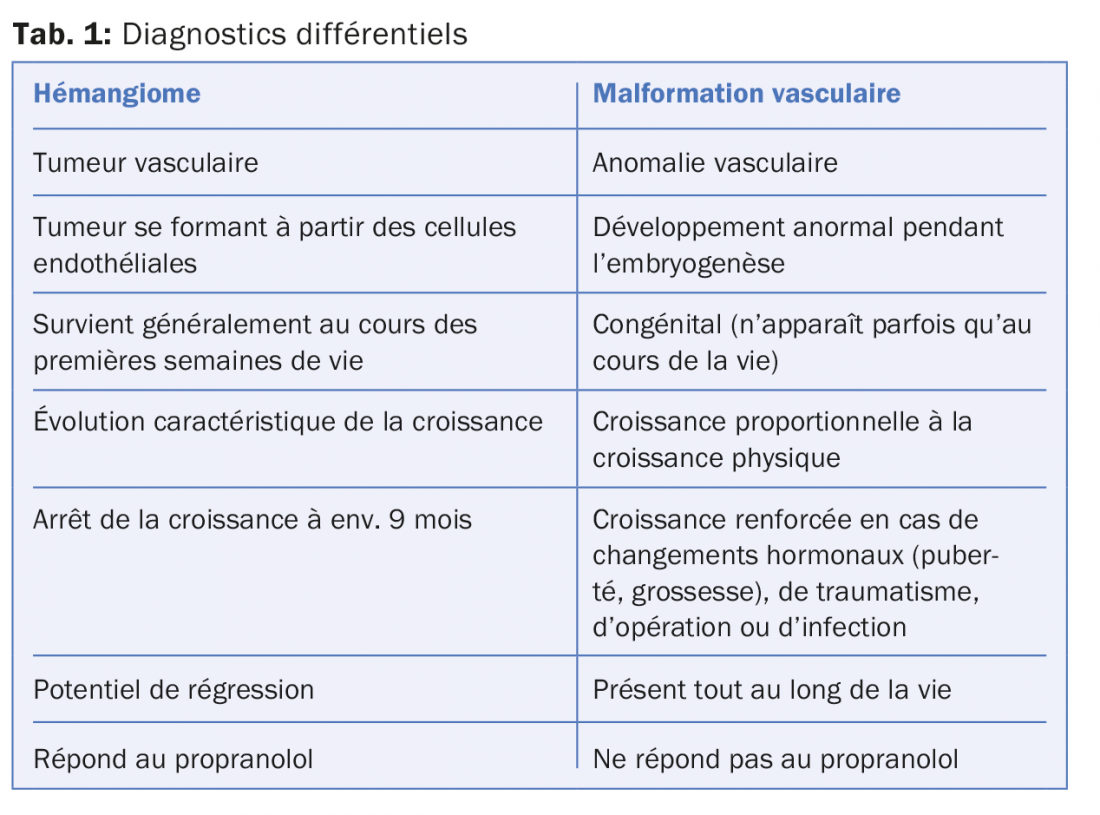
Il n’est pas toujours facile de les distinguer d’autres tumeurs vasculaires et de malformations vasculaires. Une confusion ou un manque de connaissances peuvent avoir des conséquences fatales pour les enfants concernés. Une anamnèse ciblée, l’évolution et la clinique peuvent s’avérer utiles et contributifs (tab. 1). La différenciation des malformations vasculaires entre elles constitue un défi supplémentaire. Dans ce cas aussi, une anamnèse détaillée est absolument nécessaire. En règle générale, un diagnostic clair peut être posé grâce au recours à des examens diagnostiques complémentaires tels que le doppler et/ou une angiographie par résonance magnétique en temps réel.
Tumeurs vasculaires
Hémangioendothéliome kaposiforme: l’hémangioendothéliome est une tumeur vasculaire qui apparaît généralement au cours de la première année de vie. Il se développe lentement et de manière infiltrante, et il est rugueux au toucher. Il peut se compliquer d’un syndrome de Kasabach-Merritt (coagulopathie de consommation intravasculaire disséminée et thrombopénie). Les possibilités thérapeutiques diffèrent en fonction de la localisation et de la taille. On entreprend essentiellement une résection chirurgicale ou un traitement par des agents chimiothérapeutiques. On peut aussi tenter un traitement par le propranolol.
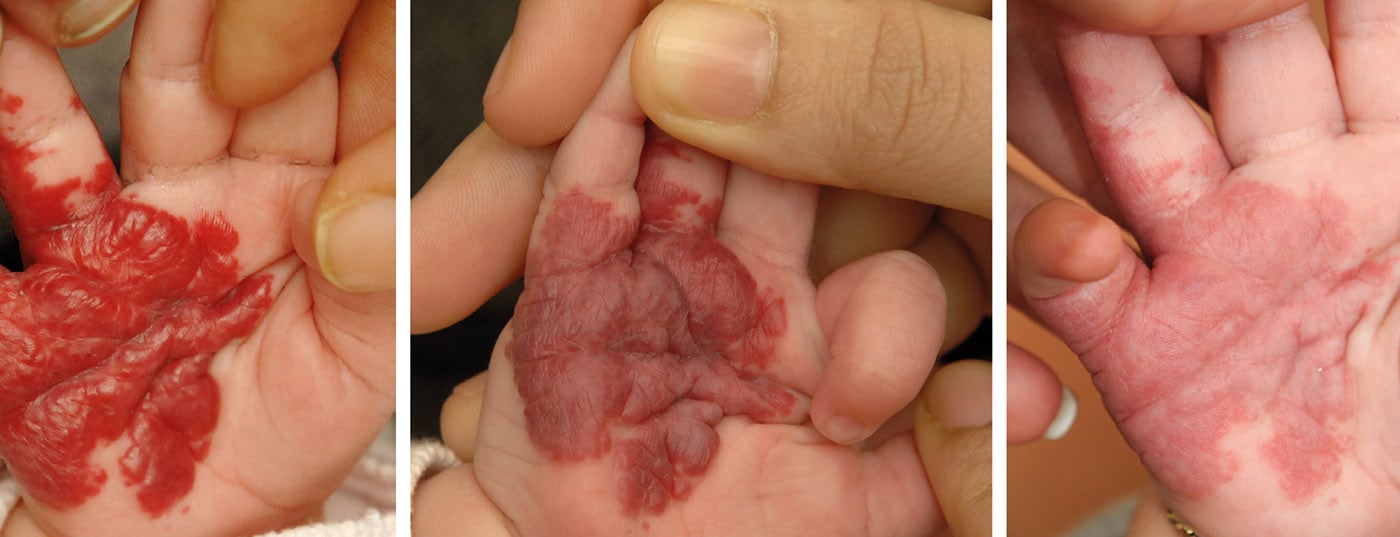
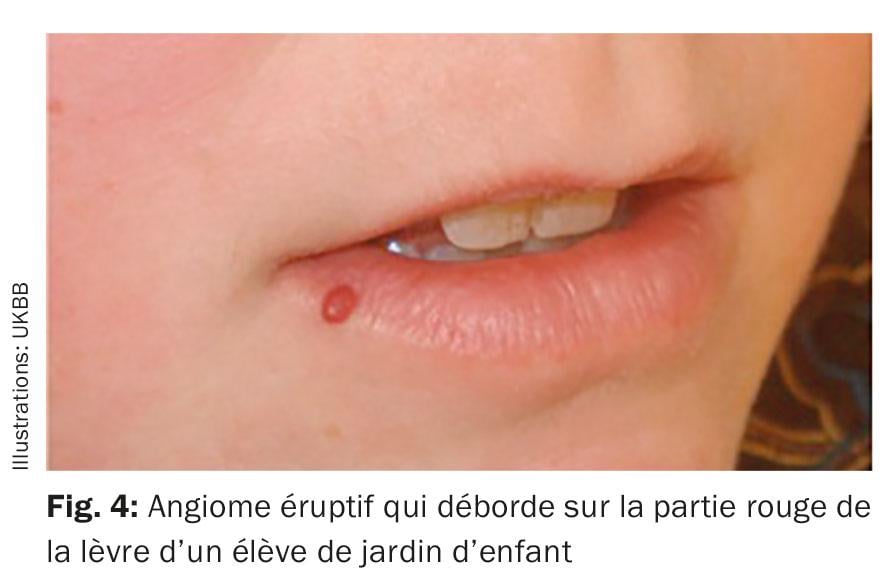
Botriomycome: les botriomycomes (également appelés granulome pyogénique) se développent chez les enfants en bas âge en particulier après un traumatisme mineur. Ils se présentent sous la forme d’une masse pédiculée, sphérique et angiomateuse (fig. 4). Des saignements récidivants et une évolution de la taille se produisent, c’est pourquoi l’excision chirurgicale de l’angiome, sous anesthésie de courte durée, est le traitement de choix.
Malformations vasculaires
Les malformations vasculaires sont des anomalies vasculaires congénitales qui n’apparaissent en partie qu’au fil des années, p. ex. à l’occasion d’une croissance accrue dans le cadre de phases de stimulation hormonale telles que la puberté, la grossesse, ainsi que du fait d’infections, de traumatismes et d’interventions chirurgicales. Sinon, elles se développent proportionnellement à la croissance physique. Sur le plan clinique/diagnostique, elles se distinguent par la vitesse du débit sanguin en malformations à bas débit, ou «low-flow» (veineuses, capillaires et lymphatiques) et en malformations à haut débit, ou «high-flow» (artérielles, artério-veineuses). Leur apparition est généralement sporadique et unifocale, puis dans moins de 1% des cas leur localisation est multifocale.
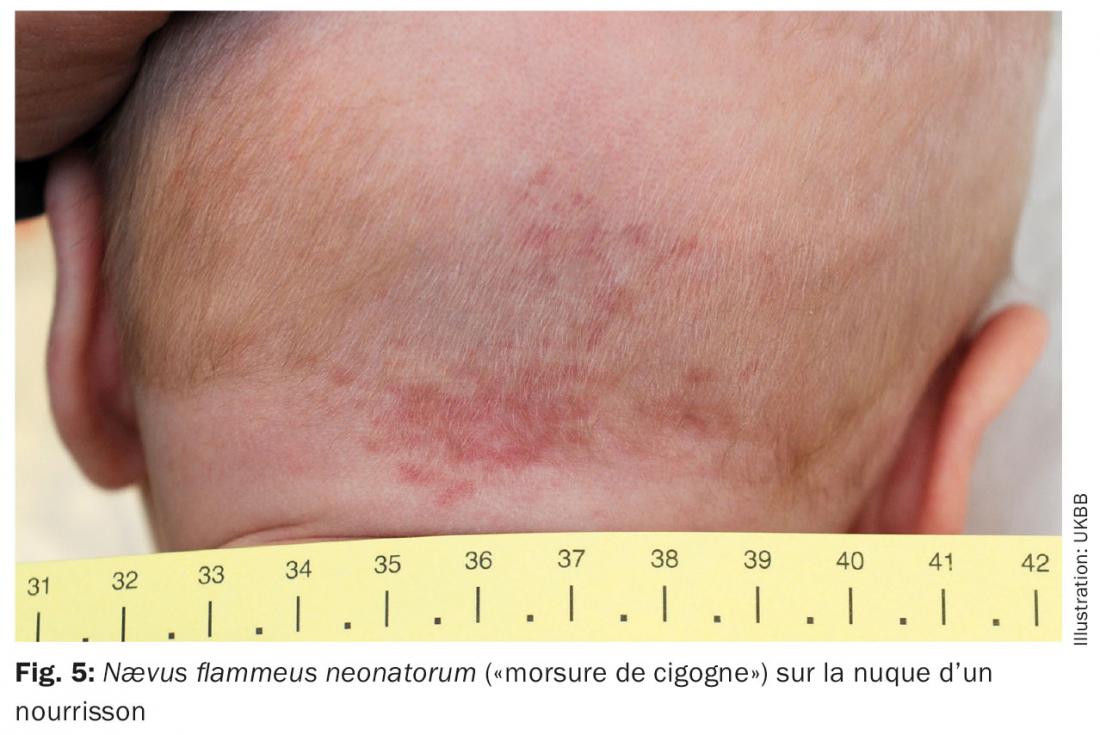
Malformation capillaire: chez les nourrissons, on observe souvent une coloration rougeâtre au niveau de la nuque ou des paupières supérieures ainsi qu’au niveau du front (fig. 5). Quand il s’agit d’un nævus flammeus neonatorum, qui régresse totalement au cours des premières années de vie, il est couramment qualifié de «morsure de cigogne» ou de «baiser de l’ange» dans le langage populaire. Il y a également la «tache de vin» classique, le nævus flammeus, qui devient plus foncé avec les années à cause de la dilatation des capillaires. Il peut être associé à des affections syndromiques et apparaître en même temps que d’autres anomalies vasculaires. Par exemple dans le cas du syndrome de Sturge-Weber avec malformation capillaire dans le territoire de la première branche du nerf trijumeau ou dans le cas du syndrome de Klippel-Trenaunay associant une malformation capillaire, lymphatique et veineuse d’un membre, combinée à une hypo- ou hypertrophie du membre atteint. En présence d’une malformation artério-veineuse, on parle alors d’un syndrome de Parks-Weber.
Lors de l’apparition d’un seul nævus flammeus, on peut, pour des raisons esthétiques, entreprendre un traitement laser à colorant pulsé.
Malformation lymphatique: les malformations lymphatiques se présentent sous la forme d’une tuméfaction molle. La résection chirurgicale constitue le traitement de choix. Lorsque la taille ou l’esthétique ne permettent pas cette intervention, on peut entreprendre une sclérose avec de l’OK-432, un agent sclérosant atténué constitué de bactéries Streptococcus pyogenes. Les récidives sont malheureusement fréquentes. L’administration de sildénafil constitue une nouvelle approche thérapeutique. Mais malheureusement, le succès n’est pas aussi radical que pour le propranolol dans le traitement des hémangiomes.
Malformation artérielle et artério-veineuse: ce type de malformation vasculaire est en premier lieu présent au niveau intracérébral. En dehors de cette localisation, on peut parfois percevoir une pulsation. Les complications sont fréquentes et plus graves. Des douleurs (aussi la nuit), des ischémies locales, des hémorragies spontanées en jet et, en cas de shunt important, une insuffisance cardiaque, peuvent apparaître. Contrairement aux hémangiomes, elle présente une croissance infiltrante comparable à celle d’une tumeur maligne. Sur le plan thérapeutique, on peut procéder à une résection et/ou une embolisation par l’artère fémorale.

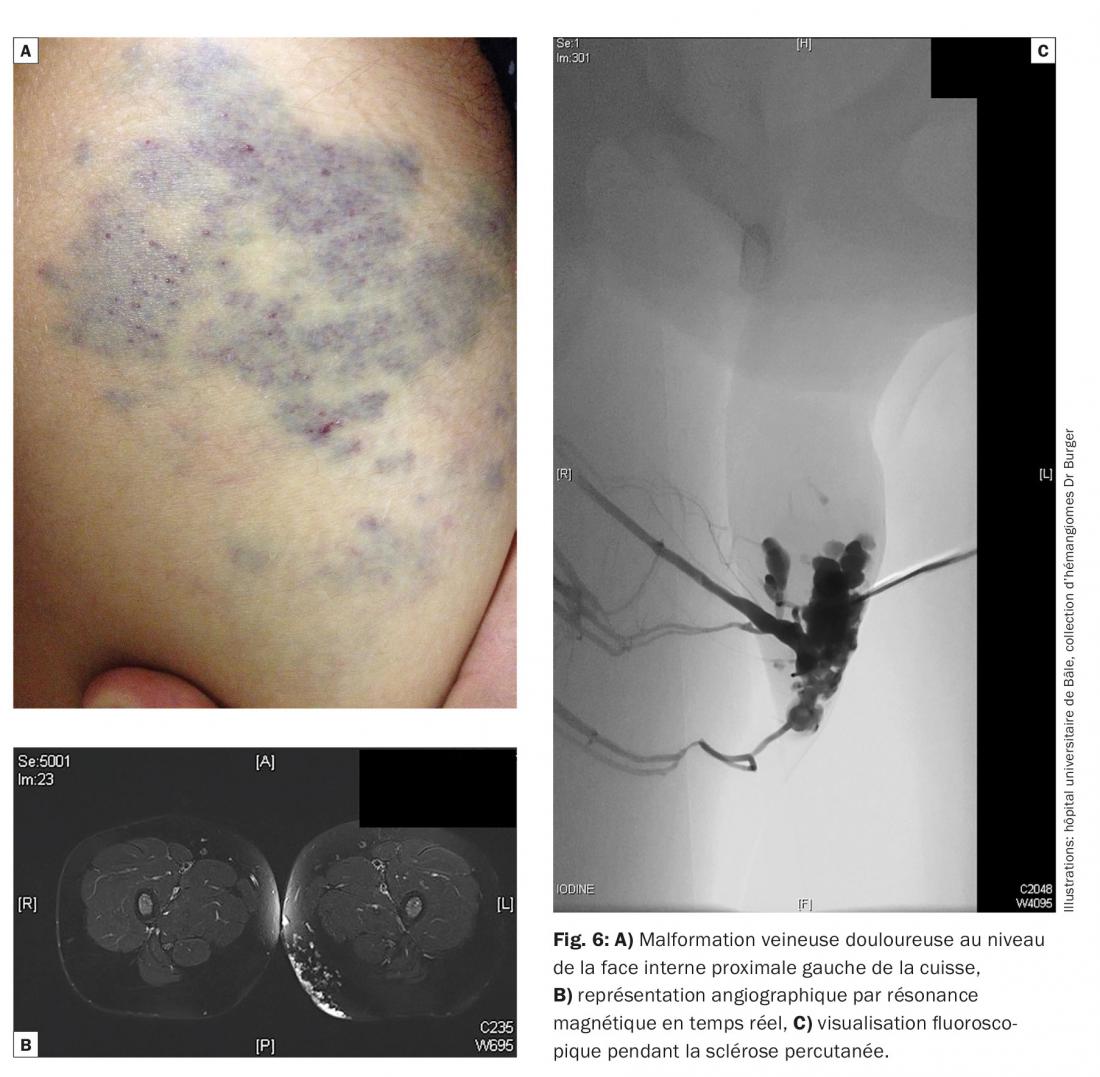
Malformation veineuse: sur le plan clinique, les malformations veineuses se présentent sous la forme d’une masse molle, bleutée et brillante, compressible à la palpation. Elles sont caractérisées par une augmentation de cette masse à l’effort, lorsque l’on laisse pendre la partie du corps concernée et en cas de douches/bains chauds. L’intensité des douleurs augmente au cours de la journée et diminue pendant la nuit. Elles peuvent se compliquer de thrombophlébites douloureuses. Les malformations veineuses, qui représentent environ les deux tiers des malformations, sont le type de malformations le plus fréquent. Sur le plan symptomatique, on peut instaurer un traitement par des AINS et de la contention (bas de contention de classe II). Des injections s.c. d’une héparine de bas poids moléculaire (100 anti-Xa UI/kg de PC/jr) pendant environ 20 jours peuvent s’avérer utiles. Une résection chirurgicale complète peut être envisagée en tant que traitement causal. Si la résection chirurgicale complète n’est pas possible, il faut procéder à une sclérose percutanée avec de la mousse d’Aetoxisclérol ou un gel sclérosant. Ce traitement peut nécessiter plusieurs séances (fig. 6).
Littérature:
- Hämangiome im Säuglings-und Kleinkindesalter. Leitlinie der Deutschen Gesellschaft für Kinderchirurgie, der Deutschen Gesellschaft für Kinder- und Jugendmedizin, der Deutschen Dermatologischen Gesellschaft, der Arbeitsgemeinschaft Pädiatrische Dermatologie und der Deutschen Gesellschaft für Mund-, Kiefer- und Gesichtschirurgie. AWMF-Leitlinienregister Nr. 006/100, Stand: 02/2015.
- Schupp CJ, et al.: Propranolol therapy in 55 infants with infantile hemangioma: dosage, duration, adverse effects, and outcome. Pediatr Dermatol 2011; 28(6): 640–644.
- Léauté-Labrèze C, et al.: Propranolol for severe haemangiomas of infancy. N Engl J Med 2008; 358 (24): 2649–2651.
- Marqueling AL, et al.: Propranolol and infantile hemangiomas four years later: a systematic review. Pediatr Dermatol 2013; 30(2): 182–191.
- Hogeling M, et al.: A randomized controlled trial of propranolol for infantile hemangiomas. Pediatrics 2011; 128(2): 259–266.
- Leaure-Labreze C, et al.: Infantile hemangiomas: the revolution of beta-blockers. Rev Prat 2014; 64(10): 1421–1428.
- Chan H, et al.: RCT of timolol maleate gel for superficial infantile hemangiomas in 5- to 24-week-olds. Pediatrics 2013; 131(6): 1739–1747.