Lors de l’AAD de cette année, des experts ont présenté des exposés sur les preuves actuelles concernant le traitement et la prévention. Des approches thérapeutiques prometteuses ont été présentées et l’importance de la protection solaire a été renforcée.
Le carcinome épidermoïde est le deuxième cancer blanc de la peau le plus fréquent après le carcinome basocellulaire. En Europe, l’incidence annuelle est de 30 cas pour 100’000 personnes, avec une augmentation de 50 à 200% au cours des 30 dernières années [1,2]. La kératose actinique (lésions visibles) et les mutations oncogéniques (précurseurs invisibles) constituent des altérations précancéreuses fréquentes [3]. Dans le cas d’une peau chroniquement exposée au soleil, il existe un risque accru de développer un carcinome épidermoïde [4]. La kératose actinique et le carcinome épidermoïde sont caractérisés par une prolifération atypique de cellules malpighiennes invasives, qui peuvent potentiellement métastaser [5]. La prédisposition génétique joue un rôle crucial, les rayons UV pouvant entraîner une mutation du gène TP53 et un affaiblissement de l’immunité antitumorale. Le gène suppresseur de tumeur TP53 code pour la protéine p53 qui, en tant que régulateur du cycle cellulaire, empêche la transformation des cellules tumorales. C’est l’un des principaux gènes impliqués dans le blocage du développement de tumeurs malignes [6].
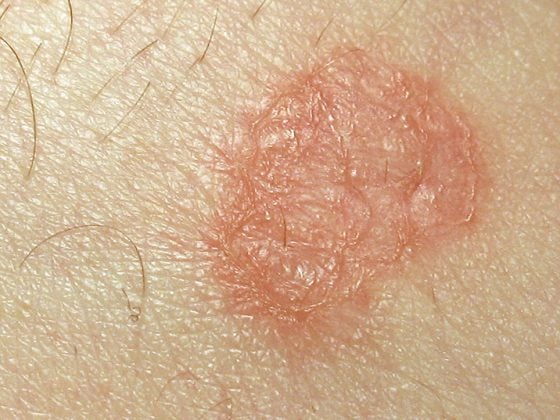
AKASI : Score pour l’évaluation quantitative des surfaces
L’indice de superficie et de sévérité de la kératose actinique (AKASI) est un instrument de mesure standardisé introduit en 2017. (Fig.1). Il s’agit d’un score pour l’évaluation quantitative de la surface de la kératose actinique de la tête et du visage, qui a été dérivé du schéma PASI (Psoriasis Area Severity Index Psoriasis Area Severity Index) utilisé pour le psoriasis et qui est structuré de manière similaire (division de la tête en quatre régions ; évaluation de la sévérité à partir de de trois items) [7]. L’AKASI peut être utilisé pour la stratification des risques, la personnalisation du traitement, le suivi et l’évaluation du traitement.

Études thérapeutiques : niveau de preuve
Le professeur Sean Christensen, MD/PhD, Yale School of Medicine, a déclaré lors de la réunion annuelle 2019 de l’AAD que la thérapie exclusivement ciblée sur les lésions n’était pas efficace pour les mutations précancéreuses invisibles (clones TP53) chez les patients à haut risque [3].
Les lignes directrices de l’International League of Dermatological Societies (ILDS) recommandent fortement les thérapies ciblées suivantes en cas de kératoses actiniques multiples et de “cancérogenèse de terrain” : 0,5% de 5 FU, 3,75% d’imiquimod et 0,015/0%/0,05% de mébutate d’ingénol, ainsi que l’ALA-/MAL-PDT [8]. Une recommandation faible a été faite pour la cryothérapie, la préparation combinée de diclofénac et d’acide hyaluronique ; 5% de 5 FU ; 0,5% de 5 FU+10% d’acide salicylique ; 2,5% et 5% d’imiquimod, ainsi que pour le traitement par Er:YAG et laser CO2 [8].
Une étude randomisée publiée en 2019, portant sur 624 patients présentant au moins 5 lésions sur la tête ou le cou (grade 1 d’Olsen), a comparé quatre méthodes thérapeutiques. Le critère d’évaluation principal était la cicatrisation d’au moins 75% des lésions après 12 mois. Les quatre procédures sont présentées ci-dessous par ordre décroissant du pourcentage de patients ayant atteint le critère d’évaluation principal [9] : Fluorouracile : 74,7% (IC à 95% ; 66,8-81,0%) ; imiquimod : 53,9% (IC à 95% ; 45,4-61,6%) ; thérapie photodynamique : 37,7% (IC à 95% ; 30,0-45,3%) ; mébutate d’ingénol : 28,9% (IC à 95% ; 21,8-36,3%).
Selon les données publiées en 2018, les effets positifs de la thérapie topique ciblée sur le terrain ont été confirmés : 954 patients à risque moyen ont été randomisés dans le bras de traitement avec la crème 5-FU 5% deux fois par jour contre un placebo. La période de traitement était de 2 à 4 semaines (visage et oreilles). 1 Le carcinome épidermoïde a été réduit de 75% à la 1ère année après la ligne de base (1% des patients dans le groupe 5-FU vs 4% dans le groupe témoin ; p<0,01) [11].
Une étude de cohorte dans le monde réel publiée en 2018 a comparé l’efficacité du fluorouracile appliqué localement à celle de l’imiquimod appliqué localement chez des personnes atteintes de kératose actinique. Le fluorouracile s’est révélé supérieur à l’imiquimod en termes de réduction de l’incidence de la kératose actinique deux ans après la ligne de base [10].
Actuellement, les rétinoïdes externes tels que l’adapalène ou le tazarotène ainsi que la colchicine topique sont encore utilisés hors étiquette. Il a été démontré que la colchicine topique permettait de réduire la “skin field cancerization” [12].
Nouvelles approches de traitement
Cunningham et al. ont étudié l’efficacité du calcipotriol sur un échantillon de 132 patients à faible risque atteints de kératose actinique du visage (traitement 2 fois par jour pendant 4 jours) [13]. Les sujets ont été randomisés pour recevoir le traitement 5-FU+calcipotriol ou le traitement 5-FU+placebo. 8 semaines après la ligne de base, 88% de réduction de la kératose actinique ont été observés dans le groupe 5-FU+calcipotriol, contre 26% dans le groupe 5-FU+substance porteuse. [13]. Le calcipotriol est un dérivé topique de la vitamine D utilisé comme traitement immunomodulateur du psoriasis. Les comparaisons avec la thérapie de terrain standard ne sont pas encore disponibles à ce stade.
Actuellement, deux études de phase III randomisées et contrôlées (KX01-AK-003, KX01-AK-004) sont intéressantes [14]: selon les études de phase II correspondantes, l’inhibiteur topique des kinases SRC KX2-391 (pommade à 1% contenant un nouvel inhibiteur dual SRC/tubuline comme substance active) est efficace pour réduire la kératose actinique. Des résultats antérieurs suggèrent que les cascades de signalisation des kinases SRC sont dérégulées dans la kératose actinique et le carcinome épidermoïde. Les kinases SRC sont une famille de tyrosines kinases cytoplasmiques de 60 kD (protéines tyrosines kinases contenant les domaines SH2 et SH-3).
Facteur de risque : l’exposition au soleil
Le fait que les rayons UV et la lumière du soleil constituent le plus grand facteur de risque de tumeurs cutanées non mélanocytaires a été prouvé empiriquement [15]. Le professeur Sean Christensen, MD/PhD, a indiqué lors de la réunion annuelle de l’AAD de cette année que la protection solaire pouvait réduire le risque de carcinome épidermoïde d’environ 40% [3]. Selon les recommandations de l’AAD, les critères suivants doivent être pris en compte pour un produit de protection solaire : Filtres UVA et UVB, résistance à l’eau, et au moins un facteur de protection 30 (SPF) (bloque 97% des rayons UVB du soleil) [16]. L’OMS rappelle également que la protection solaire doit être utilisée lors d’activités en plein air, même par temps nuageux, car 80% des rayons UV nocifs peuvent pénétrer la peau dans ces conditions.
[17].
Source : Réunion annuelle 2019 de l’AAD, Washington (États-Unis)
Littérature :
- Lomas A, Leonardi-Bee J, Bath-Hextall F : Br J Dermatol 2012 ; 166 : 1069-1080.
- Stratigos A, et al : Eur J Cancer 2015 Sep ; 51(14) : 1989-2007.
- Christensen S : Diapositives AAD F045 – Field Cancer and Multiple SCC : Molecular Insights and Clinical Management. Sean Christensen, MD, PhD, professeur adjoint de chirurgie dermatologique, Yale School of Medicine. Saturday, 2019 March 2, www.aad.org/scientificsessions/am2019/SessionDetails.aspx?id=12358
- Apalla Z, et al : Dermatol Ther 2017 ; 7 : 5-19.
- Didona D, et al. : Biomedicines 2018 ; 6(1) : 6. doi : 10.3390/biomedicines6010006
- Ehealthtreats.com : Carcinome épidermoïde du cancer de la peau. https://ger.ehealthtreats.com/papilljarnyj-rak-kozhi
- Le DermaForum est là : Interview. Kératose actinique : de nouvelles connaissances. Interview du professeur Uwe Reinhold, centre dermatologique de Bonn. www.derma-forum.com/aktuell/s-reinhold-1217/
- Werner RN, Stockfleth E, Connolly SM, et al : J Eur Acad Dermatol Venereol 2015 ; 29(11) : 2069-2079.
- Jansen MHE, et al : Essai randomisé de quatre approches de traitement de la kératose actinique. N Engl J Med 2019 ; 380 : 935-946.
- Neugebauer R, et al : J Amer Acad Dermatol 2018 ; 78(4) : 710-716.
- Weinstock MA, et al : Chimioprévention des carcinomes basocellulaires et épidermoïdes avec une seule cure de fluorouracile, 5%, crème : un essai clinique randomisé. JAMA Dermatol 2018 ; 154(2) : 167-174.
- Miola AC, et al : Br J Dermatol 2018 ; 179(5) : 1081-1087. doi : 10.1111/bjd.16824. Epub 2018 Sep 25.
- Cunningham TJ, et al : J Clin Invest 2017 ; 127(1):106-116.
- Division Athenex Pharmaceutical : www.athenex.com/oncology-innovation/src-kinase-inhibitors/
- Calzavara-Pinton P, Ortel B, Venturini M : G Ital Dermatol Venereol 2015 ; 150 : 369-378.
- AAD (American Adacemy of Dermatology) : FAQ sur les écrans solaires, www.aad.org/media/stats/prevention-and-care/sunscreen-faqs
- OMS (Organisation mondiale de la santé) : Indice solaire UV mondial, www.who.int/uv/publications/en/UVIGuide.pdf
DERMATOLOGIE PRATIQUE 2019 ; 29(3) : 42-43