Les choses bougent à nouveau dans le domaine de la prise en charge de l’urticaire. La classification et les recommandations de traitement ont été mises à jour et de nouvelles connaissances ont été acquises dans la recherche des causes, ce qui pourrait permettre à l’avenir un traitement individuel et ciblé de l’urticaire.
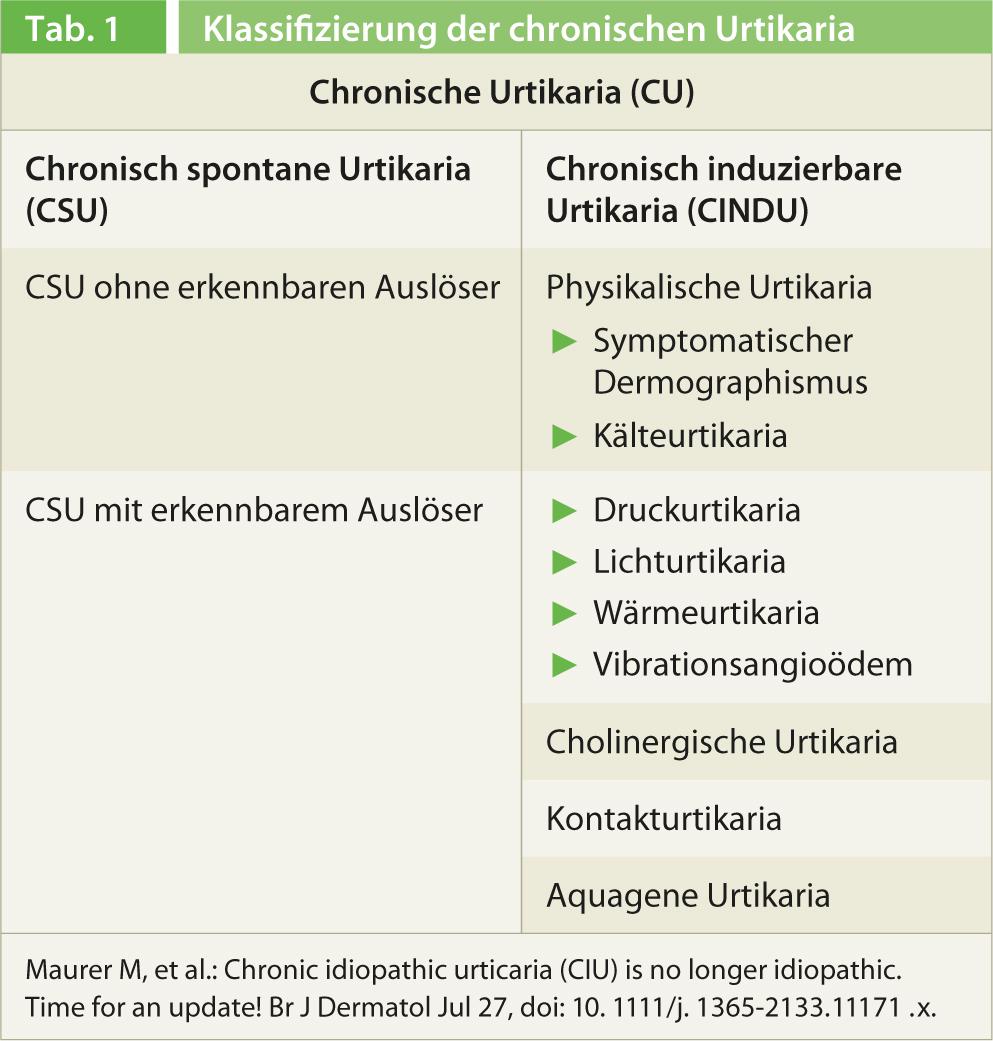
Clive Grattan, St John’s Institute of Dermatology, Norfolk and Norwich University Hospital, UK, a présenté une mise à jour intéressante sur la prise en charge de l’urticaire lors de l’assemblée annuelle des sociétés suisses d’allergologie et d’immunologie (SSAI) et de pneumologie (SSP) à Berne. Il a expliqué que dans le cadre de la “Conférence de consensus sur l’urticaire 2012” de Berlin, la maladie a reçu une nouvelle classification plus simple et des recommandations de traitement plus claires. Les recommandations se basent certes sur les anciennes directives de 2009 [1] et, selon la durée de la maladie, une distinction est faite comme auparavant entre une urticaire aiguë et une urticaire chronique (durée </>6 semaines), mais pour cette dernière, on ne différencie désormais plus que les formes spontanées et les formes inductibles (tableau 1). Le terme d’urticaire idiopathique ne figure plus dans la nouvelle classification. Dans le cas de l’urticaire chronique spontanée, c’est-à-dire sans déclencheur identifiable tel que le froid ou l’effort physique, on distingue un sous-groupe avec des déclencheurs détectables (par exemple un auto-anticorps libérant de l’histamine dans le sérum) et un sous-groupe sans ces déclencheurs. Si une cause spécifique peut être identifiée, elle doit être mentionnée dans le diagnostic, c’est-à-dire l’urticaire chronique spontanée avec détection d’auto-anticorps.
L’abandon du terme d’urticaire chronique idiopathique au profit de celui d’urticaire chronique spontanée avec indication de la cause permet une meilleure clarification de la maladie sous-jacente et, par conséquent, un traitement plus efficace.
Repenser le traitement de l’urticaire
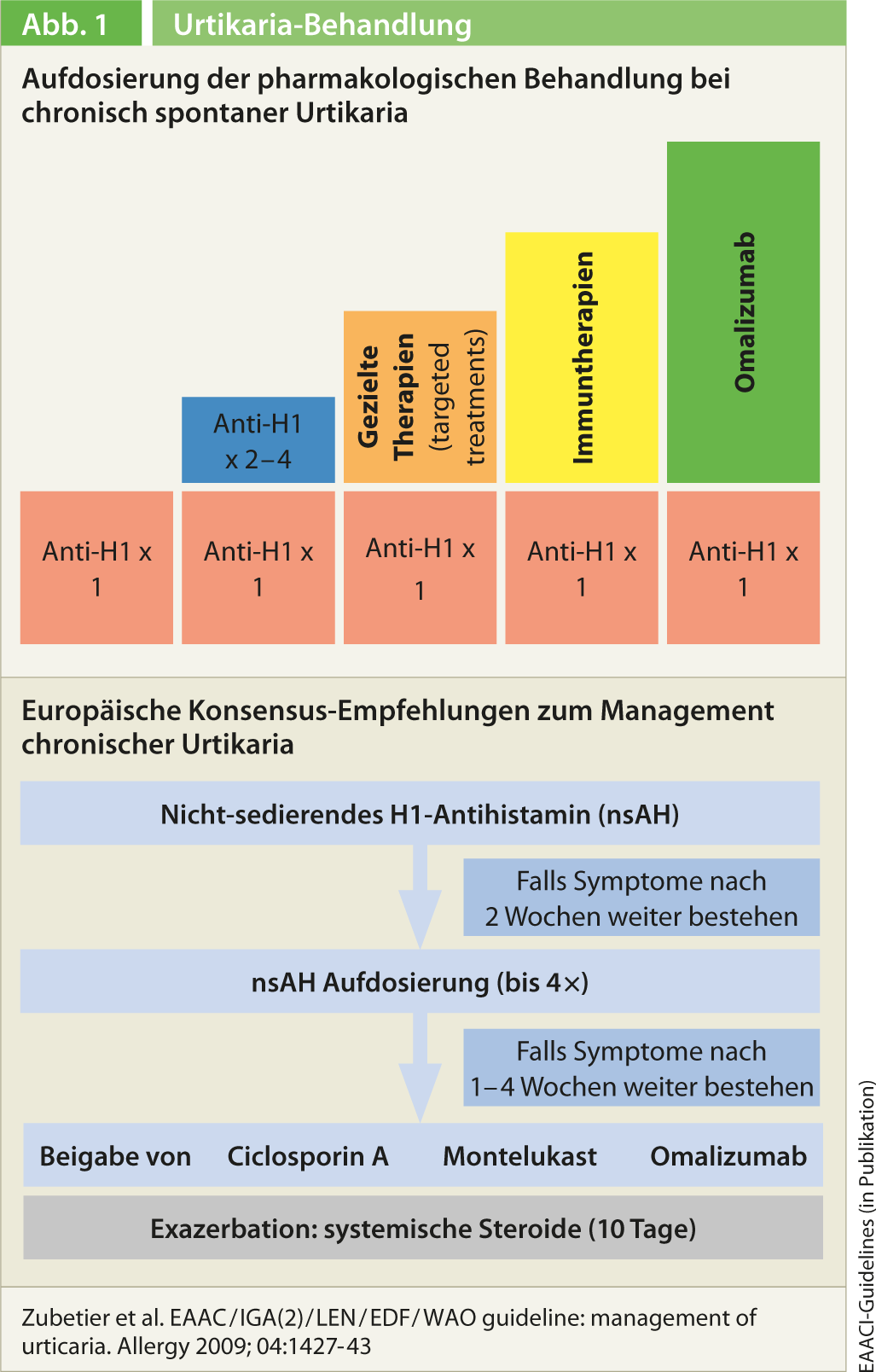
Dans le cadre de la Berliner Urticaria Consensus Conference de l’automne dernier, les recommandations de traitement de 2009 ont également été révisées et simplifiées [2]. Le traitement de première ligne se fait comme auparavant avec un antihistaminique H1 non sédatif de deuxième génération. Si la posologie standard ne donne pas les résultats escomptés, il ne faut pas changer d’antihistaminique, mais augmenter la dose jusqu’à un maximum de quatre fois (fig. 1). Comme l’a expliqué le professeur Grattan, il existe aujourd’hui suffisamment de données en faveur de cette stratégie de traitement. Chez les patients qui ne répondent pas non plus à ce traitement, l’association avec un traitement de seconde ligne est indiquée. Le professeur Grattan a d’abord mentionné ici une combinaison avec des antihistaminiques H2. Les corticostéroïdes ne sont recommandés qu’en dernier recours et uniquement sous forme de traitements de choc d’une durée maximale de deux semaines. Au préalable, il convient d’essayer les traitements combinés à la ciclosporine, aux antagonistes des leucotriènes et à l’omalizumab, un anticorps anti-IgE (le montelukast est notamment recommandé comme traitement d’appoint). Il s’agit d’applications hors étiquette qui nécessitent une prise en charge par la caisse d’assurance maladie, tout comme, à proprement parler, le traitement à haute dose par des antihistaminiques H1. En ce qui concerne la dapsone, il n’est pas possible d’émettre une recommandation. Globalement, le même algorithme de traitement est proposé chez les enfants, pendant la grossesse et l’allaitement.
Nouvelles options thérapeutiques
En ce qui concerne les options thérapeutiques, le professeur Grattan a évoqué les deux nouvelles approches thérapeutiques, à savoir la bilastine et l’omalizumab. La bilastine, un antihistaminique H1 de première ligne, montre, selon le Pr.
Grattan, avec une bonne tolérance, des résultats de traitement prometteurs. Il a présenté une étude qui a évalué l’effet de la bilastine à des doses de 20, 40 et 80*mg sur l’urticaire au froid par rapport à un placebo [3]. Il s’agissait de mesurer la réduction de la température seuil critique à laquelle apparaissaient les quintes et l’érythème. Le traitement par bilastine (20, 40 et 80 mg) a permis de réduire significativement cette température à moins de 4 °C par rapport au placebo. La réduction de la température était plus faible dans le groupe recevant 20 mg de bilastine que dans le groupe recevant 80 mg, de même que dans le groupe recevant 40 mg par rapport au groupe recevant 80 mg, ce qui illustre une fois de plus l’utilité d’une augmentation de la dose conformément aux nouvelles lignes directrices. Il est également intéressant de noter, selon le professeur Grattan, que les médiateurs des mastocytes, l’histamine, l’IL-6 et l’IL-8, mais pas le TNF-α, étaient nettement plus bas sous bilastine 80 mg, une à trois heures après l’induction par le froid. Ces données suggèrent que l’effet plus important de la bilastine à la dose la plus élevée pourrait être dû à un effet anti-inflammatoire supplémentaire.
Le professeur Grattan a également évoqué une étude sur la sédation, un effet secondaire fréquent des antihistaminiques H1. Il a été démontré chez le rat que la bilastine ne traverse pas la barrière hémato-encéphalique [4]. Le professeur Grattan a expliqué que c’est probablement la raison pour laquelle la bilastine n’a pas d’effet sédatif et a montré des valeurs comparables à celles du placebo dans d’autres études. Ces données ont été confirmées dans une étude clinique sur l’aptitude à conduire sous bilastine, qui a également démontré la bonne tolérance [5].
Pour les patients qui ne répondent pas à un traitement antihistaminique, même en combinaison avec un traitement de deuxième ligne, des traitements immunomodulateurs sont disponibles en troisième ligne. C’est souvent le cas chez les patients atteints d’urticaire chronique spontanée avec détection d’auto-anticorps. Dans ce contexte, le professeur Grattan a présenté les résultats d’une étude sur l’omalizumab. L’omalizumab est un anticorps qui se lie aux anticorps IgE solubles dans le sang et l’interstitium avant qu’ils ne se lient à leurs récepteurs sur les mastocytes. Il s’agit d’un traitement mensuel par voie sous-cutanée qui est utilisé avec succès depuis plusieurs années pour traiter l’asthme allergique sévère. Dans l’étude de phase III ASTERIA II, l’omalizumab s’est révélé efficace dans le traitement de l’urticaire chronique spontanée, notamment en soulageant de manière significative les démangeaisons [6]. Le score sur l’échelle de sévérité des lésions cutanées, qui compte 21 points, a été réduit de 5,9 points sous 75 mg d’omalizumab, de 8,1 points sous 150 mg et de 9,8 points sous 300 mg. Ceci par rapport au placebo, qui a obtenu une réduction de 5,1 points.
Thérapie ciblée – l’avenir de la gestion de l’urticaire
L’importance du sous-typage de l’urticaire chronique spontanée pour le résultat d’un traitement est également illustrée par les données présentées par le Dr Oliver Hausmann, allergologie et immunologie clinique, Hôpital de l’Île, Berne et ADR-AC GmbH, Berne. La thérapie ciblée est ici le mot d’ordre. Il présente le “basophil activation test” (BAT), qui permet de mieux cerner le pathomécanisme de l’urticaire au niveau individuel. En outre, le test pourrait ainsi également permettre un traitement plus différencié et une déclaration sur le pronostic.
Conclusion
De nouvelles connaissances déjà inscrites dans les guidelines et de nouvelles substances améliorent le résultat des patients en cas d’urticaire. L’évolution vers une thérapie ciblée est en bonne voie grâce à l’amélioration des diagnostics et, espérons-le, apportera les succès correspondants, comme dans d’autres indications médicales.
Bibliographie chez l’éditeur
Sonia Fröhlich
Source : Assemblée annuelle des Sociétés Suisses d’Allergologie et d’Immunologie (SSAI) et de Pneumologie (SSP), 17-19 avril 2013, Berne.











