La pathogenèse de l’hidradénite suppurée (HS) n’est pas encore totalement élucidée, on suppose qu’il existe un ensemble d’interactions multifactorielles. Les principaux facteurs de risque et comorbidités sont le tabagisme, l’obésité et le syndrome métabolique. En général, une approche de traitement multimodale est recommandée. Outre les mesures non médicamenteuses et les préparations topiques, des thérapies systémiques, des interventions chirurgicales et d’autres modalités thérapeutiques sont utilisées en fonction du degré de gravité. En ce qui concerne les produits biologiques, outre l’adalimumab, le sécukinumab sera disponible en Suisse à partir de 2023.
L’hidradénite suppurée (HS), également appelée “acné inversée”, est une maladie cutanée mutilante chronique et récurrente de l’appareil pilosébacé terminal, caractérisée par des lésions inflammatoires nodulaires douloureuses accompagnées d’abcès et de fistules dans les zones du corps portant les glandes apocrines (figure 1) [1,39,49]. Les sites de prédilection sont les régions axillaires, inguinales et périanales [1]. Les données sur la prévalence de l’HS varient, on estime aujourd’hui qu’elle est d’environ 1% en Europe centrale [14]. L’HS se manifeste généralement pour la première fois après la puberté et atteint un pic d’âge vers 20-25 ans. Le sex-ratio femmes : hommes est estimé entre 1:2 et 1:5 selon les études [2,3].
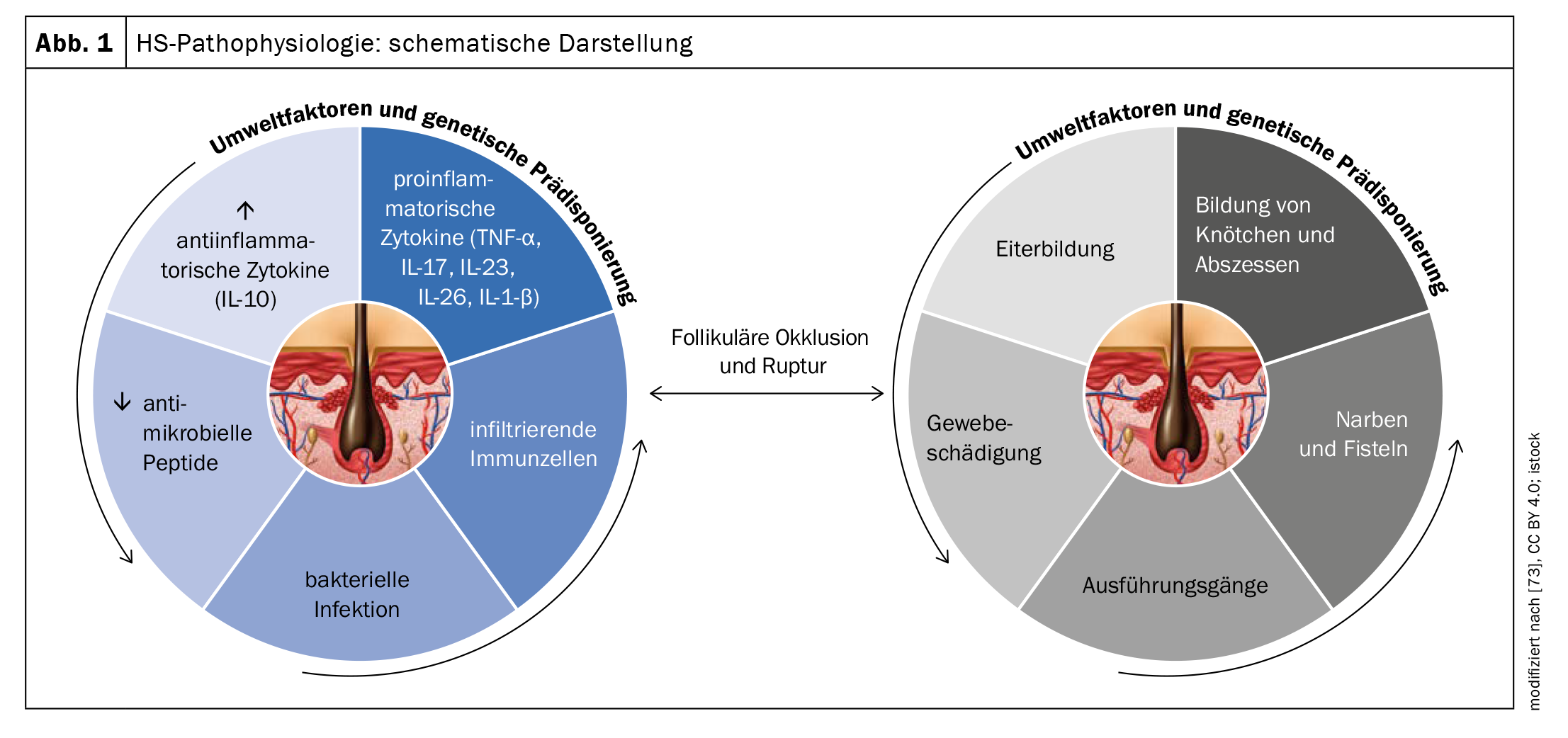
La pathogenèse exacte de l’HS n’est pas encore totalement élucidée, mais on pense qu’une combinaison de facteurs génétiques, hormonaux et environnementaux contribue à son développement (figure 1). La présence d’antécédents familiaux positifs chez 35 à 40% des patients suggère une implication génétique. Du point de vue du mécanisme pathologique, les analyses de biopsies indiquent que l’HS est initiée en raison d’une occlusion du follicule pileux terminal en réponse à une hyperkératinisation qui conduit à la formation de nodules/kystes et finalement à la rupture de l’épithélium folliculaire [4–8]. Il en résulte une inflammation chronique avec formation de sinus et de fistules et une cicatrisation dermique étendue.
Caractéristiques cliniques et établissement du diagnostic
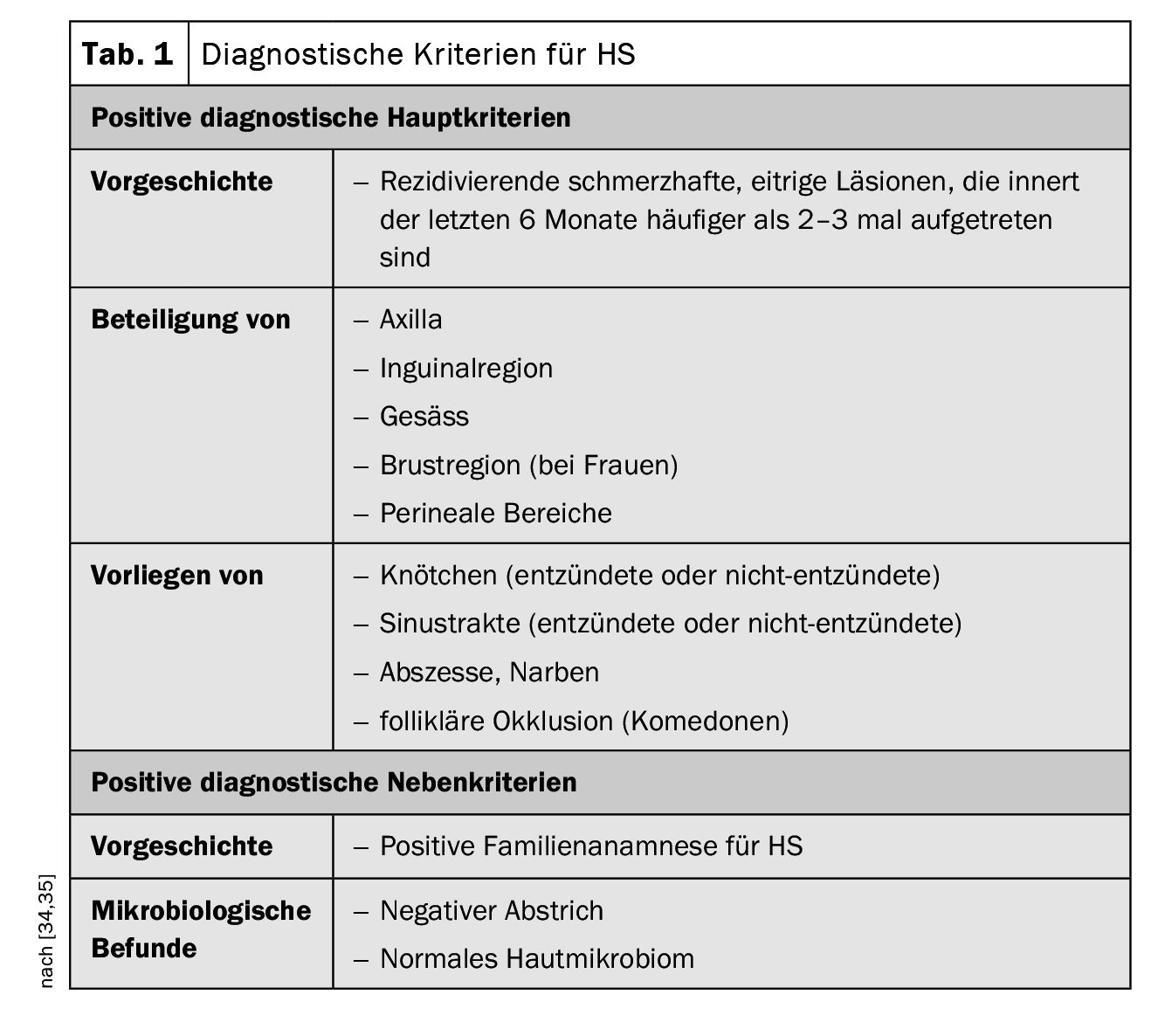
L’aspect clinique de l’HS se caractérise par des inflammations récurrentes qui sont apparues plus de deux ou trois fois au cours des six mois précédents sous la forme de nodules, de fistules et/ou de cicatrices, en particulier dans les régions des plis corporels [34,45]. Souvent, aux premiers stades, la maladie est confondue avec des abcès ordinaires ou une folliculite. Dans une étude prospective, le temps de latence moyen avant que l’HS ne soit considéré comme un diagnostic correct était de 7,2 à 8,7 ans [35]. Si l’HS n’est pas diagnostiquée à temps et traitée de manière adéquate, le processus inflammatoire peut progresser, entraînant à terme une destruction des tissus. [47]. Mais les symptômes peuvent également avoir de lourdes conséquences sur le plan psychosocial. Les infections bactériennes, la formation de fistules et les contractures peuvent entraîner des restrictions de mobilité et sont très pénibles pour les patients, comme le montrent les études empiriques sur la qualité de vie (encadré) [9]. L’examen clinique est essentiel dans l’évaluation diagnostique de l’HS. Les biopsies cutanées ne sont généralement pas nécessaires, mais peuvent être utiles pour exclure un diagnostic différentiel avec une cause bactérienne à Gram positif (par ex. furoncle ou escarboucle) [34]. Les trois principales caractéristiques cliniques de l’HS sont [1,16]:
- Localisation anatomique typique (axillaires, aine, fesses, poitrine, périanal, périgénital),
- Lésions typiques : nodules profonds et douloureux ; abcès ; fistules drainantes ; cicatrices),
- Évolution récidivante ou chronique
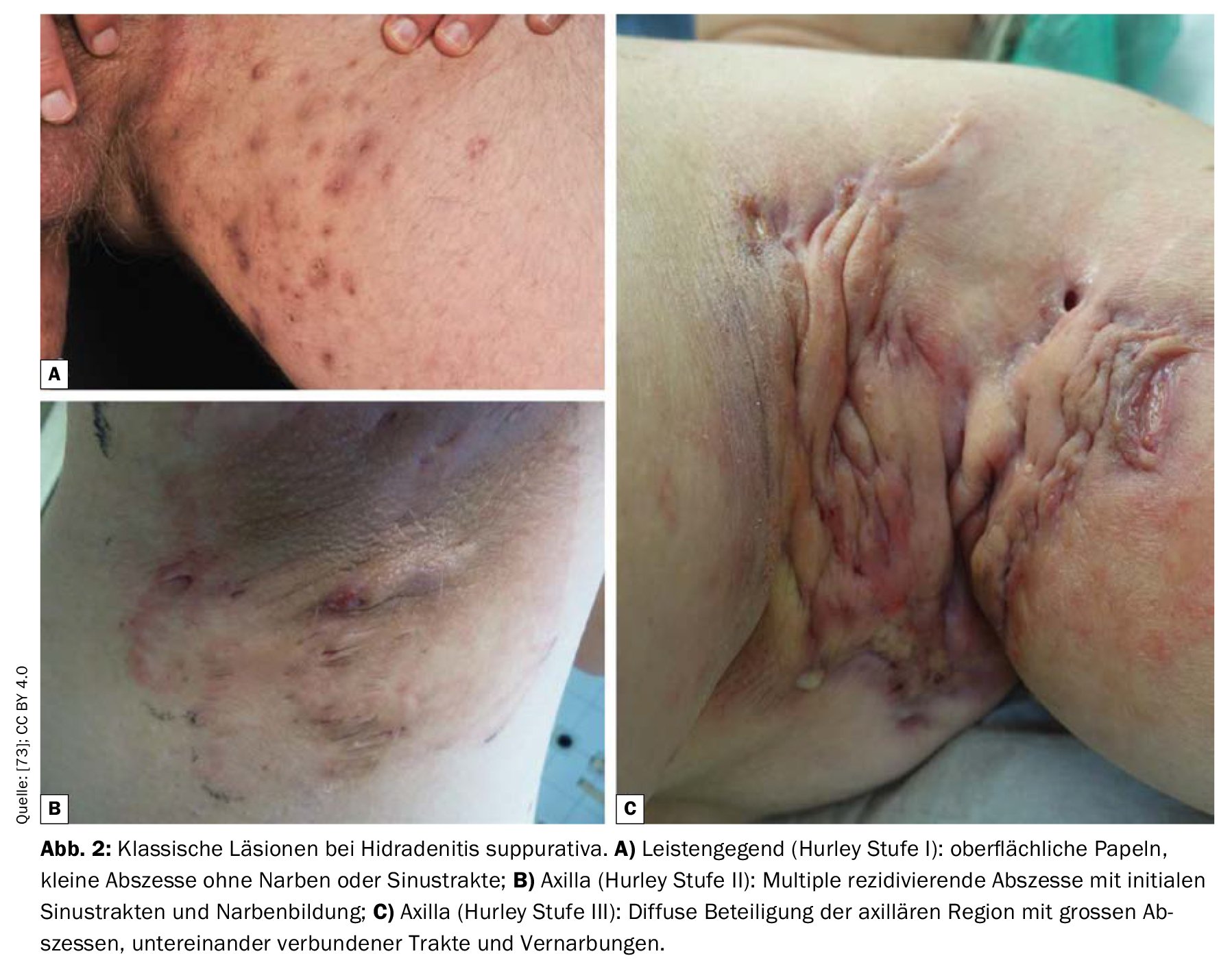
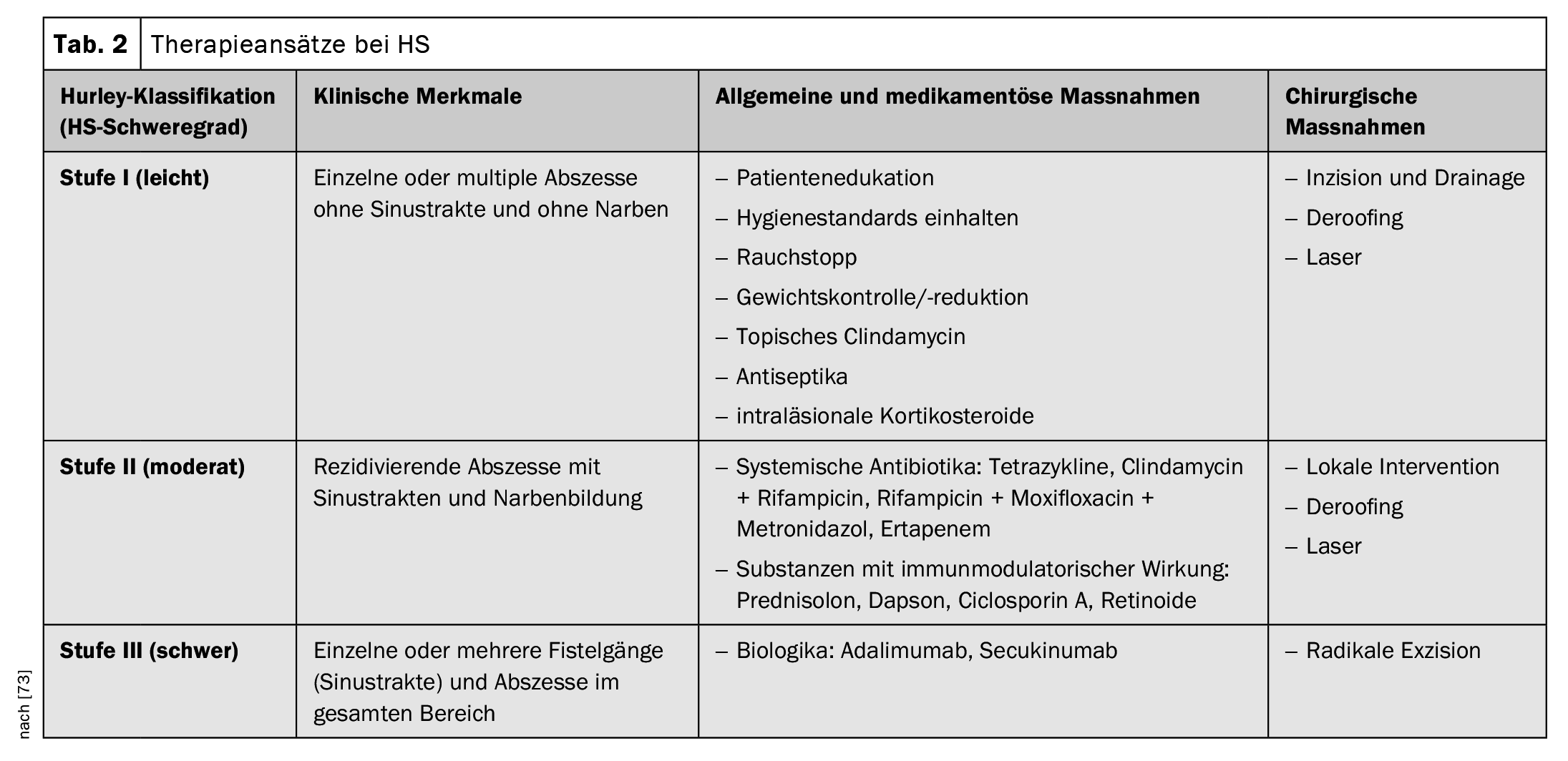
Les critères diagnostiques postulés dans les recommandations pratiques suisses publiées en 2017 sont résumés dans le tableau 1; ils sont basés sur les trois caractéristiques principales mentionnées [16,34,35]. Il n’existe actuellement pas de consensus international sur les scores à utiliser dans les HS, mais les plus courants sont les stades de Hurley et le score de Sartorius [17,34,35]. Selon la classification de Hurley, on distingue les trois degrés de gravité suivants en fonction de l’expression clinique [17,46]:
Niveau I : Abcès douloureux isolés, uniques ou multiples, pas de cordons cicatriciels ;
Stade II : abcès douloureux récurrents avec formation de cordons et cicatrices, uniques ou multiples, mais non étendus ;
Niveau III : infiltrations diffuses, en forme de plaques, inflammatoires et douloureuses, ou multiples cordons et abcès interconnectés. Il existe un risque de contractures articulaires suite à la limitation des mouvements due à la douleur.
La HS de niveau I est la plus fréquente (65%), suivie de la HS de niveau II (31%) et de la HS de niveau III (4%) [17]. Le score de Sartorius consiste à enregistrer le nombre de nodules inflammatoires, d’abcès, de fistules et de zones affectées et à leur attribuer des points. Un autre système de classification est l’International Hidradenitis Suppurativa Severity Score System (IHS4). Toutes les lésions enflammées sont évaluées et additionnées, un nodule enflammé comptant pour une fois, un abcès comptant pour deux fois et une fistule drainante comptant pour quatre fois. La somme permet d’établir une classification en trois niveaux de gravité (léger, modéré, sévère) [50].
| Une charge de morbidité élevée Les données empiriques montrent que la qualité de vie, opérationnalisée à l’aide de la Indice de qualité de vie en dermatologie (DLQI), est considérablement affecté chez les patients, le degré d’exposition variant en fonction de la sévérité des symptômes : Le DLQI moyen était de 5,77 pour le niveau I de Hurley, de 13,1 pour le niveau II et de 20,4 pour le niveau III. Ce sont des valeurs élevées si l’on considère que pour un psoriasis modéré à sévère, le DLQI est en moyenne de 12-13 [10,11]. La douleur a été considérée comme la plus gênante par 85% des patients atteints d’HS, suivie par le gonflement/l’inflammation et la sensibilité [12]. Les abcès purulents, les mauvaises odeurs et les taches sur les vêtements peuvent entraîner une stigmatisation sociale . |
Facteurs de risque et comorbidités associés à l’HS
La gravité et l’évolution de l’HS sont corrélées à l’indice de masse corporelle (IMC) et, selon plusieurs études, les patients atteints d’HS sont plus nombreux que la moyenne à fumer (70 à 90%). Revuz et al. ont trouvé un rapport de cotes (Odds Ratio , OR) de 4,42 pour les patients obèses (IMC >30) et de 12,55 pour le tabagisme par rapport aux contrôles sains [2]. Une autre étude de Miller et al. a trouvé un OR de 6,38 pour l’obésité [20]. Le risque pour les patients HS de développer un diabète sucré de type 2 (OR=5,74) ou un syndrome métabolique (OR=3,89) est nettement plus élevé [20]. Globalement, la prévalence des facteurs de risque cardiovasculaire est nettement plus élevée chez les personnes atteintes d’HS par rapport aux personnes en bonne santé .
En ce qui concerne la progression de l’HS, dans une étude rétrospective portant sur 846 personnes, les cinq facteurs suivants étaient associés à un risque accru de progression du stade I à II ou III de Hurley : le sexe masculin, la durée de la maladie, l’IMC, le nombre d’années de tabagisme et le site de la lésion [22]. Parmi les autres facteurs déclencheurs de l’HS, on peut citer les irritations mécaniques et certaines maladies comorbides (par ex. le syndrome des ovaires polykystiques et la dépression) [23–26]. Certaines études font état de taux de comorbidité accrus entre l’HS et d’autres maladies inflammatoires. Outre le syndrome des ovaires polykystiques, c’est également le cas des maladies inflammatoires de l’intestin et du pyoderma gangraenosum .
Etiopathogénie multifactorielle et dérégulation du système immunitaire
La prédisposition génétique, les facteurs liés au mode de vie (en particulier le tabagisme et l’obésité), les composants hormonaux et les processus immunologiques dysfonctionnels sont impliqués à la fois dans l’apparition et le maintien de la maladie [51,65]. Plus récemment, l’hypothèse a été postulée que l’interaction de facteurs endogènes et exogènes provoque une activation du système immunitaire inné [49]. Il s’ensuit une inflammation périfolliculaire, ainsi qu’une hyperkératose et une hyperplasie de l’épithélium folliculaire, en particulier au niveau de l’infundibulum, ce qui conduit à une fermeture du follicule [52]. La dilatation et la rupture du follicule pileux induisent une réaction immunitaire inflammatoire intense, associée au recrutement de neutrophiles, de macrophages, de lymphocytes B, de cellules Th1 et Th17 dans la peau, ce qui entraîne la formation de nodules inflammatoires ou d’abcès [51].
Les voies de signalisation pro-inflammatoires contribuent de manière significative au développement de l’HS. La production accrue d’un grand nombre de cytokines pro-inflammatoires, telles que l’interleukine (IL)-1, l’IL-6, l’IL-10, l’IL-12, l’IL-17, l’IL-23, l’IL-32, l’IL-36 et le TNF-α), a été mise en évidence dans la peau lésionnelle des patients atteints d’HS, indiquant un dérèglement immunologique [51,53–56]. Certaines voies semblent revêtir une importance particulière dans la pathogenèse de l’HS [53]. Plusieurs études ont montré que la sécrétion d’IL-23 et d’IL-12 entraîne une réponse immunitaire à prédominance Th17 et une hyperplasie kératinocytaire [56,58]. L’IL-23 induit des cellules T auxiliaires productrices d’IL-17 qui infiltrent le derme dans les lésions d’HS [59]. On sait que la famille IL-17 est impliquée dans la pathogenèse de plusieurs maladies auto-immunes. L’IL-17 joue également un rôle essentiel dans la défense de l’hôte contre les bactéries extracellulaires et les champignons, et il a été démontré que cela augmente l’expression des peptides/armines antimicrobiens de la peau [58]. Le blocage de l’IL-17 semble donc être une approche thérapeutique valable pour l’HS également [58].
Au fur et à mesure de la progression de l’hidradénite suppurée, on observe dans les tissus des taux élevés de TNF, d’IL-1β, d’IL-17, de caspase 1 et d’IL-10, ce qui entraîne le recrutement de neutrophiles, de mastocytes et de monocytes qui se différencient en macrophages et en cellules dendritiques [59–61,65]. Des données récentes indiquent également qu’un mécanisme auto-inflammatoire est impliqué dans l’HS : la peau HS présente par exemple une formation accrue de réseaux extracellulaires de neutrophiles (NET) [65]. Les réactions immunitaires aux neutrophiles et aux antigènes apparentés à la NET ont été associées à une augmentation de la dysrégulation immunitaire et de l’inflammation [62].
La cicatrisation des tissus précédemment enflammés peut entraîner des restrictions de mouvement à long terme [58–60]. Le développement de la cicatrisation et des sinus est associé au facteur de croissance transformant (TGF)-β et à la molécule d’adhésion ICAM-1 [58]. La surinfection bactérienne des lésions établies peut contribuer à entretenir l’inflammation chronique [61]. Les principales espèces bactériennes isolées dans les lésions d’HS comprennent les cocci à Gram positif, y compris les espèces de Staphylococcus aureus et de streptocoques, les staphylocoques à coagulase négative, Proteus mirabilis et les bactéries anaérobies mixtes [61]. Des échantillons microbiologiques prélevés dans des ganglions lymphatiques de drainage chez des patients HS ayant subi une excision chirurgicale ont révélé la présence de Staphylococcus epidermidis et de Corynebacterium spp. ainsi que de bactéries atypiques telles que Proteus mirabilis, Escherichia coli, Enterobacter aerogens et Enterococcus faecalis [64].
Traitement multimodal – les anti-IL-17A-Ak comme nouvelle stratégie thérapeutique
Les recommandations suisses de traitement publiées en 2017 se réfèrent à différentes modalités de la maladie ou à différents points de départ pour le traitement, les options thérapeutiques recommandées étant à chaque fois adaptées à la gravité de l’HS (tableau 2) [34,35]. En ce qui concerne les options de traitement médicamenteux, l’approbation par Swissmedic cette année du sécukinumab, un inhibiteur de l’IL-17-A, représente un élargissement important de l’éventail des traitements.
Pharmacothérapie : l’algorithme de traitement recommandé est basé d’une part sur le degré de gravité selon Hurley (I-III) et d’autre part sur les caractéristiques spécifiques de la maladie.
- Préparations topiques : pour éviter les surinfections bactériennes et réduire l’inflammation et la macération, il est recommandé d’utiliser des désinfectants topiques (par ex. triclosan, bituminosulfonate d’ammonium) ou des antibiotiques topiques (par ex. solution de clindamycine) [30,34,35]. Les nodules enflammés peuvent être traités avec des stéroïdes intralésionnels [34,35].
- Les antibiotiques systémiques : Si les agents topiques ne suffisent pas, des antibiotiques systémiques sont généralement administrés. La doxycycline (50-200 mg par jour, pendant 3-6 mois) ou la rifampicine en combinaison avec la clindamycine (300 mg chacune deux fois par jour, pendant jusqu’à trois mois) sont proposées, le gluconate de zinc (3× 30 mg, par jour) peut être ajouté en combinaison [31,34,35].
- Traitements systémiques conventionnels et biologiques : en cas d’HS active modérée à sévère ayant insuffisamment répondu à une antibiothérapie systémique, le sécukinumab ou l’adalimumab peuvent être prescrits à la dose recommandée [72]. L’acitrétine systémique (0,2-0,5 mg/kg par jour), la dapsone (50-150 mg par jour), la metformine, la ciclosporine A ou les stéroïdes systémiques peuvent également être utilisés [34,35]. L’efficacité est généralement évaluée dans les essais cliniques sur la base du score de réponse clinique de l’hidradénite suppurée (HiSCR) [48]. HiSCR est défini comme ≥50% de réduction des lésions inflammatoires (somme des abcès et des nodules inflammatoires) et aucune augmentation du nombre d’abcès et de fistules sécrétantes par rapport à la situation initiale [48].
- Analgésiques : la douleur peut provenir des nodules et des abcès enflammés, mais les cicatrices, les chéloïdes, les ulcérations ouvertes, les lymphœdèmes, les fissures anales ou l’arthrite peuvent également provoquer des douleurs. Outre les préparations topiques (par ex. la lidocaïne et les agents anti-inflammatoires), la littérature spécialisée mentionne les agents anti-inflammatoires systémiques non stéroïdiens, les anticonvulsivants atypiques (par ex. la gabapentine ou la prégabaline), ainsi que les inhibiteurs de la recapture de la sérotonine/noradrénaline [70,71]. En cas de dépression comorbide, la duloxétine a fait ses preuves [71].
Mesures chirurgicales et excision au laser : l’excision locale de lésions individuelles n’est recommandée que dans les cas localisés et bien circonscrits de Hurley I et II [1]. Dans tous les autres cas, uneexcision large au scalpel ouau laser CO2 de la peau, y compris des parties du tissu adipeux de toute la zone affectée, doit être envisagée [1]. Le plan de traitement chirurgical précis doit être défini individuellement et en concertation avec le patient, tout comme le traitement conventionnel. Des mesures de physiothérapie sont indiquées jusqu’à la guérison complète de la plaie.
Facteurs liés au mode de vie : pour promouvoir la qualité de vie des patients atteints d’HS, l’éducation des patients devrait mettre en évidence les liens entre les facteurs liés au mode de vie et l’HS. On pense que la nicotine induit une hyperplasie épidermique et une obstruction folliculaire [67]. En outre, les patients atteints d’HS présentent déjà un risque cardiovasculaire élevé, qui est encore aggravé par le tabagisme [68]. Outre le tabagisme, l’obésité est également associée à la gravité de la maladie. Il existe un consensus général sur le fait que l’arrêt du tabac et la perte de poids sont des mesures importantes pour lutter contre l’exacerbation de la maladie [2,66]. Les lignes directrices internationales indiquent explicitement que la perte de poids peut avoir un effet positif sur la gravité de la maladie chez les personnes obèses atteintes d’HS et que les patients doivent être conseillés dans ce sens [68]. En outre, il est recommandé de porter des vêtements amples pour éviter les contraintes mécaniques [68].
Soutien psychosocial : l’HS a un impact négatif sur la qualité de vie et peut conduire à des troubles dépressifs et à la désintégration sociale. Il est empiriquement prouvé que les patients souffrant d’HS vivent un niveau élevé de détresse et il est conseillé d’inclure non seulement les symptômes physiques, mais aussi les dimensions psychologiques de la maladie dans la gestion de la maladie [68,69]. Dans une étude publiée en 2019, dans laquelle 110 patients HS (âge moyen 38±12 ans ; 61 femmes, 49 hommes) ont été inclus, des corrélations significatives ont été trouvées entre le Skindex-29 et le score de Sartorius (symptômes : p=0,024 ; émotions : p=0,019 ; statut fonctionnel : p=0,002) [69]. De plus, l’EVA pour la douleur était significativement corrélée avec le DLQI (p=0,000) et l’IMC était associé au score de Sartorius (p=0,038) [69].
Messages Take-Home
- L’hidradénite suppurée (HS) est une maladie inflammatoire chronique de la peau qui se caractérise par des nodules récurrents, des abcès et la formation de fistules et de cicatrices dans les régions du corps où se trouvent des glandes apocrines (aisselle, aine, région périanale et périnéale). Dans environ 40% des cas, les antécédents familiaux sont positifs. Les femmes sont plus souvent touchées que les hommes.
- Les principaux facteurs de risque et comorbidités sont le tabagisme, l’obésité et le syndrome métabolique. Mais les spondyloarthropathies et les maladies inflammatoires chroniques de l’intestin (MICI) sont également surreprésentées dans cette population de patients.
- La pathogenèse n’est pas encore totalement élucidée, on suppose qu’il existe un ensemble d’interactions multifactorielles. Entre autres, une forte expression de cytokines pro-inflammatoires a été mise en évidence dans les lésions cutanées des patients atteints d’HS. Il s’agit d’un point de départ pour les options thérapeutiques systémiques plus récentes telles que les produits biologiques.
- En général, une approche multimodale du traitement est préconisée. Outre les facteurs liés au mode de vie et les préparations topiques, des thérapies systémiques, des interventions chirurgicales et d’autres méthodes sont utilisées en fonction de la gravité. En ce qui concerne les produits biologiques, outre l’adalimumab, le sécukinumab sera disponible en Suisse à partir de 2023. La gestion de la douleur et la prise en compte des aspects psychosociaux sont des mesures d’accompagnement importantes.
Littérature :
- Zouboulis CC, et al : S1 guideline for the treatment of hidradenitis suppurativa/acne inversa (number ICD-10 L73.2) (en français). JDDG 2012;10(suppl 5) : S1-S31.
- Revuz JE, et al : Prevalence and factors associated with hidradenitis suppurativa : results from two case-control studies. JAAD 2008;59 : 596-601.
- Jemec GB, Heidenheim M, Nielsen NH : The prevalence of hidradenitis suppurativa and its potential precursor lesions. JAAD 1996;35 : 191-194.
- Woodruff CM, Charlie AM, Leslie KS : Hidradénite suppurée : un guide pour le médecin praticien. Mayo Clin Proc 2015 ; 90 : 1679-1693.
- Hunger RE, et al : Le Toll-like receptor 2 est fortement exprimé dans les lésions de l’acné inversa et colocalise avec le récepteur de la lectine de type C. BJD 2008 ; 158 : 691-697.
- Jemec GB, Hansen U : Histologie de l’hidradénite suppurée. JAAD 1996 ; 34 : 994-999.
- Schlapbach C, et al. : Expression de la voie IL-23/Th17 dans les lésions d’hidradénite suppurée. JAAD 2011 ; 65 : 790-798.
- von Laffert M, et al. : Hidradénite suppurée (acné inversa) : événements inflammatoires précoces au niveau des follicules terminaux et de l’épiderme interfolliculaire. Exp Dermatol 2010;19 : 533-537.
- Margesson LJ, Danby FW : Hidradénite suppurée. Meilleures pratiques et recherche. Clin Obstet Gynaecol 2014 ; 28 : 1013-1027.
- Alavi A : Hidradénite suppurée : démystifier une maladie chronique et débilitante. JAAD 2015 ; 73(5 suppl 1) : S1-S2.
- Revicki D, et al. : Impact du traitement par adalimumab sur la qualité de vie liée à la santé et d’autres résultats rapportés par les patients : résultats d’un essai contrôlé randomisé de 16 semaines chez des patients atteints de psoriasis en plaques modéré à sévère. BJD 2008;158 : 549-557.
- Kimball A, et al. : Patients’ experiences with hidradenitis suppurativa : a qualitatif study of symptoms and impacts. JAAD 2013 ; 68 : AB57.
- Kimball AB, et al : Adalimumab pour le traitement de l’hidradénite suppurée modérée à sévère : un essai randomisé parallèle. Ann Intern Med 2012;157 : 846-855.
- Jemec GB : Pratique clinique. Hidradénite suppurée. NEJM 2012;366 : 158-164.
- Saunte DM, et al : Le retard de diagnostic dans l’hidradénite suppurée est un problème global. BJD 2015;173 : 1546-1549.
- Zouboulis CC, et al : Hidradénite suppurée/acné inversée : critères pour le diagnostic, l’évaluation de la sévérité, la classification et l’évaluation de la maladie. Dermatology 2015;231 : 184-190.
- Revuz J : Hidradénite suppurée. JEADV 2009 ; 23 : 985-998.
- Sartorius K, et al : Objective scoring of hidradenitis suppurativa reflecting the role of tobacco smoking and obesity. BJD 2009 ; 161 : 831-839.
- Sartorius K, et al : Suggestions pour des variables de résultats uniformes lors de la déclaration des effets du traitement dans l’hidradénite suppurée. BJD 2003 ; 149 : 211-213.
- Miller IM, et al : Association of metabolic syndrome and hidradenitis suppurativa. JAMA Dermatol 2014;150 : 1273-1280.
- Tzellos T, et al : Cardiovascular disease risk factors in patients with hidradenitis suppurativa : a systematic review and meta-analysis of observational studies. BJD 2015 ; 173 : 1142-1155.
- Schrader AM, et al : Hidradénite suppurée : une étude rétrospective de 846 patients néerlandais pour identifier les facteurs associés à la sévérité de la maladie. JAAD 2014 ; 71 : 460-467.
- Boer J, Nazary M, Riis PT : The role of mechanical stress in hidradenitis suppurativa. Dermatol Clin 2016 ; 34 : 37-43.
- Nazary M, et al : Pathogenesis and pharmacotherapy of hidradenitis suppurativa. Eur J Pharmacol 2011 ; 672 : 1-8.
- van der Zee HH, et al : The association between hidradenitis suppurativa and Crohn’s disease : in search of the missing pathogenic link. J Invest Dermatol 2016;136 : 1747-1748.
- Shavit E, et al : Psychiatric comorbidities in 3,207 patients with hidradenitis suppurativa. JEADV 2015;29 : 371-376.
- van der Zee HH, et al. : Hidradénite suppurée et maladie inflammatoire de l’intestin : sont-elles associées ? Résultats d’une étude pilote. BJD 2010 ; 162 : 195-197.
- Hsiao JL, et al : Hidradénite suppurée et pyoderma gangrenosum concomitant : une série de cas et une revue de la littérature. Arch Dermatol 2010 ; 146 : 1265-1270.
- Kraft JN, Searles GE : Hidradénite suppurée chez 64 patientes : étude rétrospective comparant les antibiotiques oraux et le traitement antiandrogénique. J Cutan Med Surg 2007 ; 11 : 125-131.
- Jemec GB, Wendelboe P : Clindamycine topique versus tétracycline systémique dans le traitement de l’hidradénite suppurative. JAAD 1998 ; 39 : 971-974.
- Gener G, et al : Combination therapy with clindamycin and rifampicin for hidradenitis suppurativa : a series of 116 consecutive patients. Dermatology 2009;219 : 148-154.
- Kimball AB, et al : Two phase 3 trials of adalimumab for hidradenitis suppurativa. NEJM 2016;375 : 422-434.
- Boer J, Nazary M : Résultats à long terme du traitement par acitrétine pour l’hidradénite suppurée. L’acné inversa est-elle aussi un misnome ? BJD 2011 ; 164 : 170-175.
- Hunger RE, et al. : Recommandations pratiques suisses pour le traitement de l’hidradénite suppurée (acné inversa). Kompass Dermatol 2019 ; 7 (1) : 8-13.
- Hunger RE, et al. : Recommandations de pratique suisse pour la prise en charge de l’hidradénite suppurative/acné inversée. Dermatology, 2017, 233 (2-3).
- van der Zee HH, et al : Adalimumab (anti-TNF-α) treatment of hidradenitis suppurativa ameliorates skin inflammation : an in situ and ex vivo study. BJD 2012 ; 166 : 298-305.
- Wolk K, et al : La carence en IL-22 contribue à une maladie inflammatoire chronique : mécanismes pathogéniques dans l’acné inversa. J Immunol 2011, 186 : 1228-1239.
- Högenauer C, et al. : Gestion interdisciplinaire des maladies immuno-médicamenteuses – une perspective autrichienne. Journal des maladies gastro-entérologiques et hépatologiques 2019 ; 17 : 108-124.
- Fimmel S, Zouboulis CC : Comorbidités de l’hidradénite suppurée (acné inversa). Dermatoendocrinol 2010 ; 2(1) : 9-16.
- Sabat R, et al : Prévalence accrue du syndrome métabolique chez les patients atteints d’acné inversa. PloS One 2012 ; 7(2):e31810.
- Gold DA, et al. : The prevalence of metabolic syndrome in patients with hidradenitis suppurativa. JAAD 2014 ; 70(4) : 699-703.
- Deckers IE, et al : Inflammatory bowel disease is associated with hidradenitis suppurativa : results from a multicenter cross-sectional study. JAAD 2017 ; 76(1) : 49-53.
- Shlyankevich J, et al : L’hidradénite suppurée est une maladie systémique avec un fardeau de comorbidité substantiel : une analyse de cas-contrôle vérifiée par la charte. JAAD 2014 ; 71(6) : 1144-1150.
- Richette P, et al : Hidradénite suppurée associée à la spondyloarthrite – résultats d’une étude prospective nationale multicentrique. J Rheumatol 2014 ; 41(3) : 490-494.
- Esmann S, Jemec GB : Impact psychosocial de l’hidradénite suppurée : une étude qualitative. Acta Derm Venereol 2011 ; 91 : 328-332.
- Hurley HJ : Axillary hyperhidrosis, apocrine bromhidrosis, hidradenitis suppurativa and family benign pemphigus : surgical approach. In : Roenigk RK, Roenigk HH, Jr, eds. Chirurgie dermatologique : principes et pratique. 2nd ed. New York : Marcel Dekker 1996 : 623-645.
- Kokolakis G, et al : Delayed Diagnosis of Hidradenitis Suppurativa and Its Effect on Patients and Healthcare System. Dermatologie 2020 ; 236(5) : 421-430.
- Kimball AB, et al. : Assessing the validity, responsiveness and meaningfulness of the Hidradenitis Suppurativa Clinical Response (HiSCR) as the clinical endpoint for hidradenitis suppurativa treatment. Br J Dermatol 2014 ; 171(6) : 1434-1442.
- Kurzen H, et al : Qu’est-ce qui cause l’hidradénite suppurée ? Exp Dermatol 2008 ; 17(5) : 455-456 ; discussion 457-472.
- Zouboulis CC, et al ; European Hidradenitis Suppurativa Foundation Investigator Group. Développement et validation de l’International Hidradenitis Suppurativa Severity Score System (IHS4), un nouveau système de notation dynamique pour évaluer la sévérité de l’HS. Br J Dermatol 2017 ; 177(5) : 1401-1409.
- Vossen A, van der Zee HH, Prens EP : Hidradénite suppurative : une revue systématique intégrant les voies inflammatoires dans un modèle pathogénique cohérent. Front Immunol 2018 ; 9 : 2965.
- Von Laffert M, et al. : Hidradénite suppurée/acné inversée : hyperplasie épithéliale bilocalisée avec des séquelles très différentes. BJD 2011 ; 164 : 367-371.
- Schuch A, Absmaier-Kijak M, Volz T: Acne inversa/Hidradenitis suppurativa – Von der Pathogenese zur Therapie. Akt Dermatol 2019 ; 45 : 277-287.
- Melnik BC, et al. : T helper 17 cell/regulatory T-cell imbalance in hidradenitis suppurativa/acne inversa : The link to hair follicle dissection obesity smoking and autoimmune comorbidities. BJD 2018 ; 179 : 260-272.
- Van der Zee HH, et al : Elevated levels of tumour necrosis factor (TNF)-α interleukin (IL)-1β and IL-10 in hidradenitis suppurativa skin : A rationale for targeting TNF-α and IL-1β. BJD 2011 ; 164 : 1292-1298.
- Zouboulis CC, et al : Qu’est-ce qui cause l’hidradénite suppurée – 15 ans après. Exp Dermatol 2020 ; 29 : 1154-1170.
- Sabat R, et al : Hidradénite suppurée. Nat Rev Dis Prim 2020 ; 6 : 18.
- Thomi R, et al : Association of Hidradenitis Suppurativa with T Helper 1/T Helper 17 Phenotypes : A Semantic Map Analysis. JAMA Dermatol 2018 ; 154 : 592.
- Wieland CW, et al : Marqueur myéloïde S100A8/A9 et marqueur lymphocytaire, récepteur soluble de l’interleukine 2 : biomarqueurs de l’activité de la maladie de l’hidradénite suppurative ? Br J Dermatol 2013 ; 168 : 1252-1258.
- 60 Saunte DML, Jemec GBE : Hidradénite Suppurative : Avancées dans le diagnostic et le traitement. JAMA 2017 ; 318 : 2019-2032.
- Gierek M, et al. : Hidradénite suppurée : étude bactériologique dans le cadre d’un traitement chirurgical. Postep. Dermatol Alergol 2022 ; 39 : 1101-1105.
- Jastrząb B, et al. : The Prevalence of Periodontitis and Assessment of Oral Micro-Biota in Patients with Hidradenitis Suppurativa : A Descriptive Cross-Sectional Study. J Clin Med 2022 ; 11 : 7065.
- Ganzetti G, et al : Periodontal Disease : An Oral Manifestation of Psoriasis or an Occasional Finding ? Drug Dev. Res. 2014, 75, pp46-S49.
- 64 Vaienti S, et al : Lymph Node Involvement in Axillary Hidradenitis Suppurativa : A Clinical, Ultrasonographic and Bacteriological Study Conducted during Radical Surgery. J Clin Med 2021 ; 10 : 1433.
- 65. Molinelli E, et al : New Insight into the Molecular Pathomechanism and Immunomodulatory Treatments of Hidradenitis Suppurativa. Int J Mol Sci 2023 ; 24(9) : 8428. www.mdpi.com/1422-0067/24/9/8428,(dernière consultation 16.10.2023)
- Brajac I, et al : Smjernice za Dijagnostiku i Liječenje Gnojnog Hidradnitisa (Hidradenitis Suppurativa) Liječ Vjesn 2017 ; 139 : 247-253.
- Hana A, et al : Signification fonctionnelle de l’acétylcholine non-neuronale dans l’épithélium cutané. Life Sci 2007 ; 80 : 2214-2220.
- Ingram JR, et al. : British Association of Dermatologists guidelines for the management of hidradenitis suppurativa (acne inversa) 2018. British Journal of Dermatology 2019 ; 180 (5) : 1009-1017.
- Frings VG, et al. Évaluation de la charge psychologique des patients atteints d’hidradénite suppurée. Eur J Dermatol 2019 ; 29 : 294-301.
- Ballard K, Shuman VL : Hidradénite suppurative. [Updated 2023 Apr 17]. Dans : StatPearls [Internet]. Treasure Island (FL) : StatPearls Publishing ; 2023 janv.
- Fernandez JM, et al : Pain management modalities for hidradenitis suppurativa : a patient survey. J Dermatolog Treat 2022 ; 33(3) : 1742-1745.
- Swissmedic : Information sur les médicaments, www.swissmedicinfo.ch,(dernière consultation 16.10.2023)
- Scala E, et al : Hidradénite suppurée : où nous en sommes et où nous allons. Cells 2021, 10, 2094. www.mdpi.com/2073-4409/10/8/2094#,(dernière consultation 16.10.2023).
Photo de couverture : Dr. Thomas Brinkmeyer, wikimedia. Stade Hurley II
DERMATOLOGIE PRATIQUE 2023 ; 33(5) : 6-11