Les patients présentant des douleurs thoraciques nécessitent une évaluation d’urgence d’un syndrome coronarien aigu (SCA). Les piliers diagnostiques du SCA sont la présentation clinique, l’ECG 12 dérivations et les troponines cardiaques. Les algorithmes 0/1 h recommandés comme classe IA sont basés sur des dosages de troponine très sensibles et permettent un “rule-out” sûr et un “rule-in” précis de l’infarctus aigu du myocarde chez >70% des patients concernés.
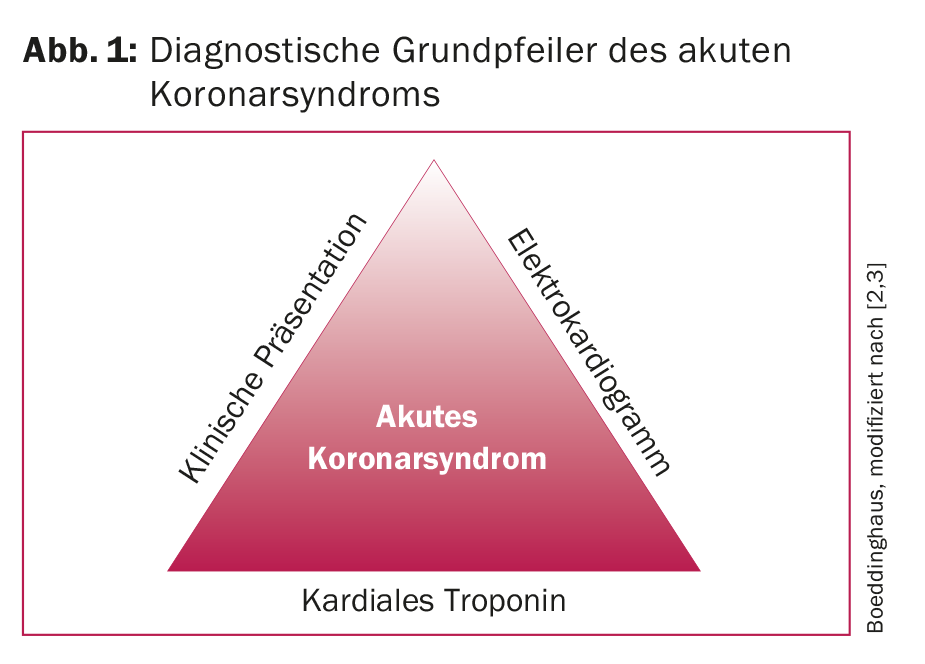
Les maladies du système cardiovasculaire, comme le syndrome coronarien aigu (SCA), restent la première cause de mortalité dans le monde. Environ dix pour cent de toutes les consultations dans les services d’urgence sont le fait de patients souffrant de douleurs thoraciques [1]. Une identification rapide et adéquate des patients souffrant d’un infarctus aigu du myocarde (IAM) est essentielle pour la mise en place immédiate d’un traitement adéquat et fondé sur des données probantes. L’exclusion rapide et sûre d’un IAM (appelée “rule-out”) et l’inclusion rapide et précise (appelée “rule-in”) restent des défis cruciaux pour le clinicien. La présentation clinique, l’électrocardiogramme (ECG) et les troponines cardiaques constituent les trois piliers du diagnostic (Fig. 1) [2,3]. Alors que l’ECG est l’outil de diagnostic de choix pour détecter un infarctus du myocarde avec sus-décalage du segment ST (STEMI), la troponine cardiaque joue un rôle crucial dans le diagnostic d’un infarctus du myocarde sans sus-décalage du segment ST (NSTEMI). Dans cet article, nous souhaitons vous donner un aperçu de l’évaluation optimale des douleurs thoraciques d’origine cardiaque. L’accent est mis sur la détection précoce de l’IMA, qui, parmi les diagnostics différentiels associés aux douleurs thoraciques, entraîne la morbidité et la mortalité les plus élevées et nécessite un traitement immédiat.
La présentation clinique
La symptomatologie des patients souffrant de douleurs thoraciques peut être divisée en douleurs typiques et atypiques de l’angine de poitrine (AP). De manière générale, il convient de souligner que le concept de douleurs thoraciques typiques, atypiques et non cardiaques n’est pas fondé sur des preuves et qu’un tiers des patients atteints d’IAM ne présentent pas de douleurs thoraciques typiques, et même la moitié chez les patients âgés [4]. Les trois critères suivants doivent être remplis pour une symptomatologie AP typique :
- Sensation de pression ou d’oppression rétrosternale
- Déclenché par un stress physique ou psychologique
- Diminution des symptômes grâce au repos physique
Une symptomatologie végétative concomitante, comme la dyspnée, les nausées et les vomissements, est très souvent associée aux troubles typiques de l’AP. En cas de troubles AP atypiques, seuls deux des critères ci-dessus sont remplis. Si un seul ou aucun critère n’est rempli, on parle de douleur thoracique non cardiaque.
On parle d’AP stable lorsque les épisodes douloureux sont toujours identiques et que la douleur s’atténue au repos ou qu’une amélioration est observée après la prise de médicaments réduisant la précharge et la postcharge.
Il s’agit d’une AP instable si les troubles sont nouveaux, s’il y a une augmentation de l’intensité ou de la durée des troubles, si les troubles réapparaissent même au repos ou dans les deux semaines suivant un AMI. En cas d’AP instable, les taux de troponine sont généralement dans la norme (ou légèrement élevés) par rapport à un NSTEMI et ne présentent pas de dynamique significative. En cas de suspicion d’AP instable, une évaluation doit être effectuée sans perte de temps dans un hôpital afin d’inclure ou d’exclure le plus rapidement possible un AMI.
L’électrocardiogramme
L’électrocardiogramme (ECG) joue un rôle crucial dans le diagnostic d’un IAM et permet de différencier un STEMI d’un NSTEMI. En outre, il permet de tirer des conclusions sur la localisation de la zone d’infarctus et du vaisseau coronaire concerné. Les modifications classiques de l’ECG indiquant un STEMI sont des élévations du segment ST dans deux dérivations adjacentes (I+AVL, II+III+aVF, V1-V6), mesurées au point J, avec une amplitude >0,1 mV. Pour les dérivations V2 et V3, l’amplitude doit être de 0,15 mV pour les femmes >, de 0,25 mV pour les hommes de moins de 40 ans >et de 0,20 mV pour les hommes de plus de 40 ans >. Des dérivations postérieures supplémentaires, telles que V7, V8, V9, ou des dérivations orientées vers la droite (V3R, V4R) peuvent être utiles pour établir un diagnostic dans certains cas (descente de ST au-dessus de la paroi antérieure). Les modifications de l’ECG en cas de NSTEMI ou d’AP instable sont nombreuses, bien que l’ECG puisse être complètement normal. Typiquement, on observe des baisses de ST ou des négativations d’ondes T. Les pointes Q sont plutôt le signe d’un infarctus plus ancien, qui a expiré.
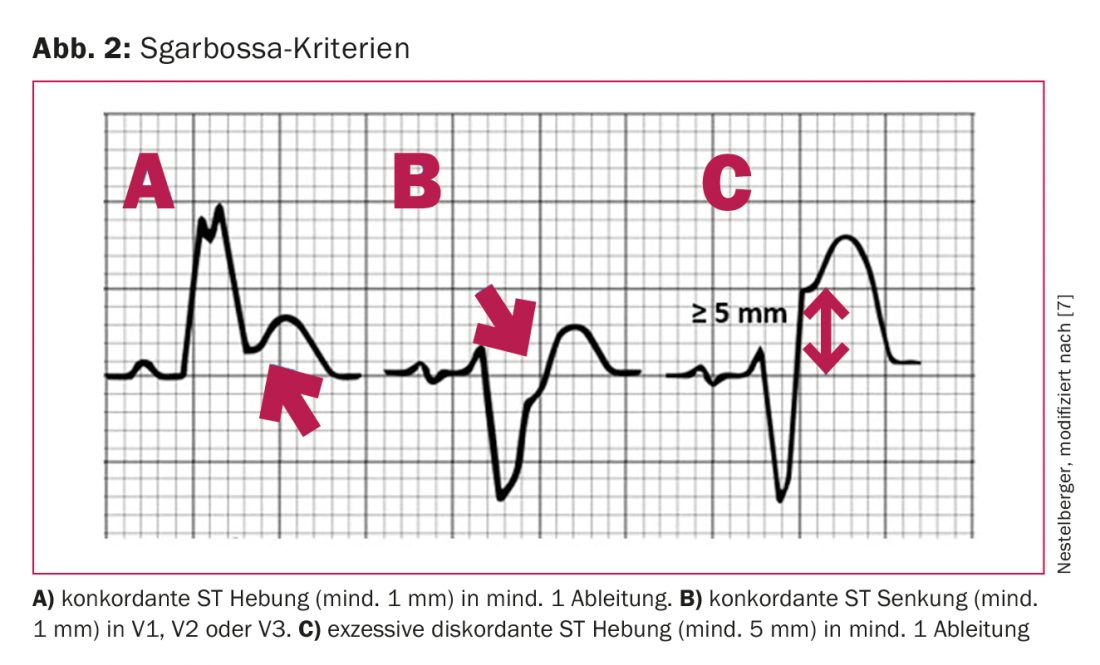
Les patients souffrant de douleurs thoraciques et d’un bloc de branche gauche (BBG) représentent un défi particulier [5] : Les directives actuelles de l’American College of Cardiology recommandent que les patients présentant un nouveau ou probable nouveau LSB soient traités de la même manière qu’un STEMI (équivalent d’un STEMI). Cependant, des études récentes ont montré que la majorité des patients souffrant de douleurs thoraciques et de LSB n’ont pas d’IMA. En outre, aucune différence n’a été trouvée entre un BPL préexistant et un BPL nouveau ou susceptible de l’être en termes de prévalence de l’IMA, sachant que l’évaluation des ECG préexistants est très souvent impossible, en particulier dans les situations d’urgence. Un LSB est donc plutôt l’expression d’une chronicité dans différentes cardiopathies (ischémiques, valvulaires ou hypertensives). Ce n’est que récemment qu’il a été démontré que des critères ECG spécifiques (appelés critères de Sgarbossa ou de Sgarbossa modifiés, ou encore critères de Smith) présentent une spécificité très élevée (94-100%) pour un IAM en cas de LSB (fig. 2) [6]. Par conséquent, ces critères ECG spécifiques doivent être pris en compte lors de l’évaluation de l’ECG des BPCO et un traitement et des investigations supplémentaires par coronarographie immédiate ne doivent être effectués qu’en présence de l’un de ces critères.
La troponine cardiaque
La troponine cardiaque est un complexe protéique composé de trois sous-unités : la troponine C (qui se lie au calcium), la troponine T (qui se lie à la tropomyosine) et la troponine I (sous-unité inhibitrice). La troponine cardiaque T et la troponine cardiaque I sont spécifiques au cœur et servent depuis des décennies de biomarqueurs cardiaques de la nécrose myocardique, qui survient notamment dans le cadre d’un IAM.
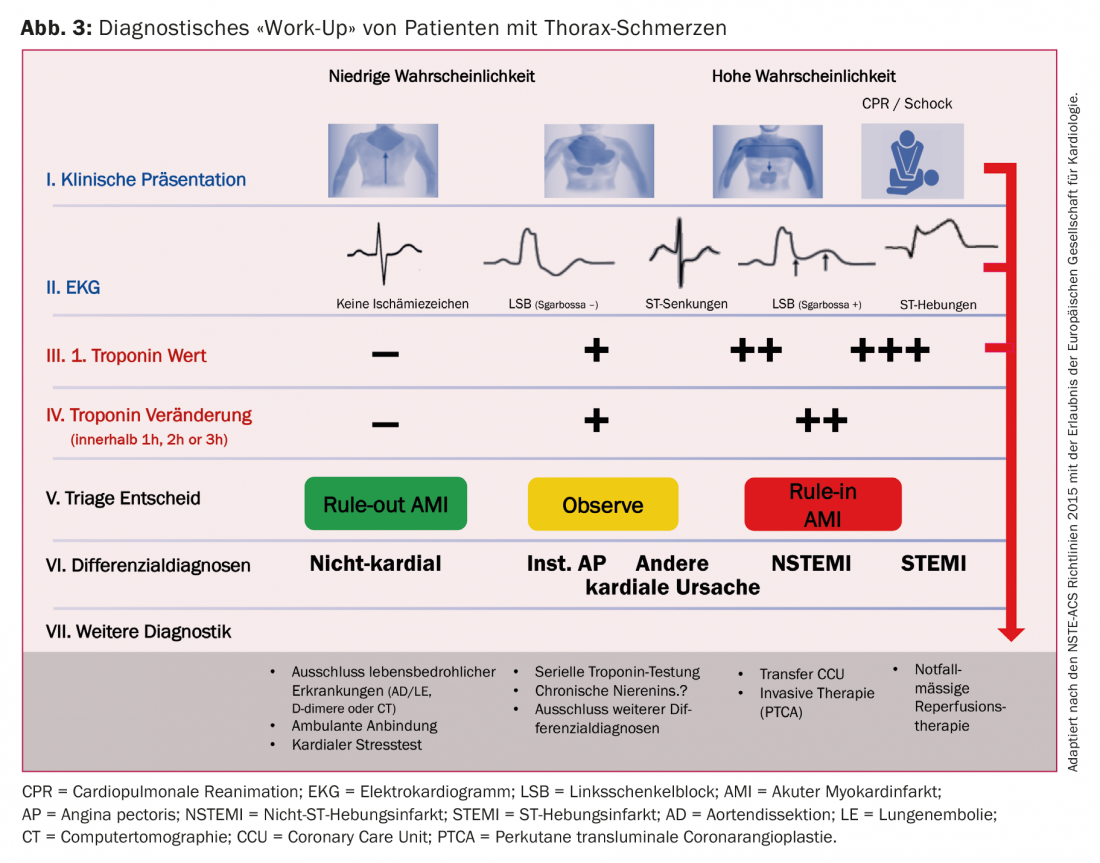
Ces dernières années ont vu le développement de dosages de troponine hautement sensibles (hs-cTn) [8,9]. Grâce à la sensibilité accrue, il est désormais possible de détecter des taux de troponine, même dans la plage des normes très basses, dans plus de 50% d’une population en bonne santé. L’intervalle “troponine aveugle” des dosages est ainsi réduit et la précision diagnostique des dosages hs-cTn est nettement supérieure à celle des dosages des anciennes générations. Le développement et l’utilisation clinique des dosages hs-cTn ont considérablement modifié l’interprétation clinique de la troponine. Les termes “troponine positive” ou “troponine négative” ne correspondent plus à l’état actuel des connaissances médicales. Il est bien connu et amplement démontré que la troponine doit être utilisée comme marqueur quantitatif. En d’autres termes, plus la troponine mesurable est élevée, plus les dommages myocardiques et la libération correspondante de troponines cardiaques dans la circulation périphérique sont importants et plus le risque d’événements cardiovasculaires futurs et de mortalité au cours de l’évolution est élevé. Le “work-up” diagnostique des patients souffrant de douleurs thoraciques est illustré dans la figure 3.
Algorithmes d’inclusion ou d’exclusion de l’infarctus aigu du myocarde
Grâce à l’utilisation des dosages hs-cTn, de nombreux algorithmes de “rule-out” ou “rule-in” de l’AMI ont été développés ces dernières années [10–14]. Certaines de ces stratégies se basent uniquement sur les valeurs de troponine, d’autres intègrent les informations de l’ECG et/ou les scores de risque clinique. Deux de ces nouveaux algorithmes, l’algorithme 0/1 h et l’algorithme 0/3 h, ont été inclus dans les directives de la Société européenne de cardiologie en tant que recommandation de classe IA. Deux algorithmes 0/1 h ont été développés pour les deux tests hs-cTn établis et disponibles en clinique (hs-cTnT Elecsys et hs-cTnI Architect) et ont été validés jusqu’à présent uniquement pour une utilisation dans les services d’urgence. (Fig. 4A et 4B). Leur utilisation dans le domaine ambulatoire, par exemple dans les cabinets de médecins généralistes, n’est pas encore possible à l’heure actuelle, car aucun dosage hs-cTn n’est disponible dans le domaine ambulatoire, mais uniquement les dosages point-of-care, nettement moins sensibles.
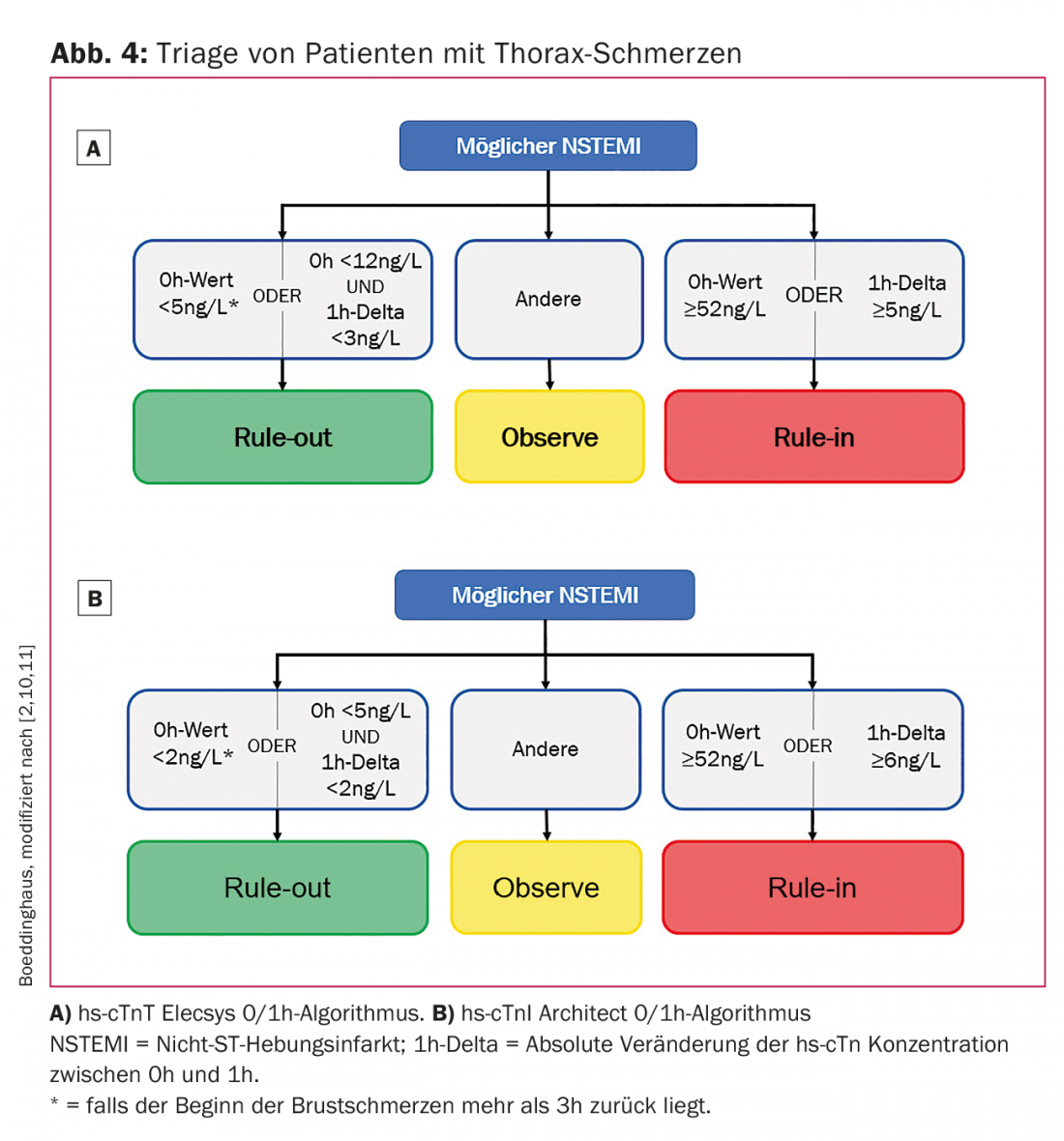
Les algorithmes utilisent des concentrations absolues de hs-cTn à la présentation et après 1 h et 3 h après la présentation. Les variations absolues (appelées delta) entre la première et la deuxième mesure de la troponine sont également utilisées. Les algorithmes 0/1 h classent les patients comme “rule-out” s’ils présentent de faibles concentrations de hs-cTn lors de la présentation et si la variation absolue est inférieure à une certaine valeur dans la première heure. Un “rule-out” direct sur la base d’un taux de troponine très bas est possible si, au moment de la prise de sang, le début de la douleur remonte à au moins 3 heures. Les algorithmes 0/1 h montrent une grande sécurité pour le “rule-out” avec une sensibilité résultante et une valeur prédictive négative de >99% [10,11]. Pour le “rule-in”, les patients ont besoin soit de valeurs hs-cTn très élevées lors de leur présentation aux urgences, soit d’un changement significatif des concentrations hs-cTn. Quatre aspects doivent être pris en compte dans l’application clinique de ces algorithmes basés sur la troponine. Premièrement, tous les algorithmes doivent toujours être utilisés en combinaison avec l’ensemble des informations cliniques et la probabilité individuelle pré-test d’un IAM. Deuxièmement, les algorithmes dont il est question doivent être considérés comme des stratégies de triage et non comme des stratégies de diagnostic, car ils ne permettent pas de poser un diagnostic d’IMA, mais de classer les patients en trois groupes. Ensuite, d’autres diagnostics peuvent être nécessaires, comme une angiographie coronaire, des tests d’effort ou une échocardiographie jusqu’à ce que le diagnostic soit posé (Fig. 3). Troisièmement, tous les algorithmes ne doivent être utilisés qu’après avoir exclu un STEMI à l’ECG, car les patients atteints d’un STEMI doivent être mis sous traitement de reperfusion en urgence. Quatrièmement, les algorithmes doivent être intégrés dans les procédures standard locales des services d’urgence afin de garantir une application aussi fluide que possible.
Résumé
Le diagnostic rapide et sûr d’un SCA chez les patients qui se présentent avec des douleurs thoraciques reste un défi majeur. Une évaluation d’urgence dans un hôpital, idéalement avec un laboratoire de cathétérisme disponible, est obligatoire. Le développement des dosages hs-cTn et des algorithmes 0/1 h correspondants est certainement la plus grande réalisation de ces dernières années dans le domaine du diagnostic précoce du SCA. La distinction entre l’IMA et l’AP instable par l’utilisation du dosage hs-cTn est très pertinente, car l’AP instable est une maladie beaucoup plus bénigne que l’IMA, qui ne nécessite généralement pas de surveillance du rythme ni de coronarographie d’urgence. En utilisant les algorithmes récemment développés, il est possible de classer environ 70% de tous les patients comme “rule-out” ou “rule-in” dans un délai très court [10,11]. Cela a pour conséquence que les patients atteints d’un SCA peuvent être orientés encore plus rapidement vers un traitement basé sur des preuves. D’autre part, la majorité des patients peuvent rentrer chez eux avec un niveau de sécurité très élevé et bénéficier d’un suivi ambulatoire si nécessaire. Cela a pour conséquence de réduire considérablement la durée de séjour aux urgences et de diminuer le stress des patients, de leurs proches, mais aussi du personnel médical. De même, un diagnostic plus rapide de l’ACS permet d’éviter l’encombrement des services d’urgence et, au final, de réduire durablement les coûts de santé.
Messages Take-Home
- Les maladies du système cardiovasculaire, comme le syndrome coronarien aigu, restent la première cause de mortalité dans le monde.
- Les patients présentant des douleurs thoraciques nécessitent l’évaluation en urgence d’un syndrome coronarien aigu.
- Les piliers diagnostiques du syndrome coronarien aigu sont les suivants
- la présentation clinique, l’électrocardiogramme à 12 dérivations et les troponines cardiaques. Toutes les informations devraient toujours être prises en compte dans l’établissement du diagnostic.
- L’introduction clinique de dosages de troponine hautement sensibles a constitué une étape importante dans le diagnostic précoce de l’infarctus aigu du myocarde et a permis de développer des algorithmes basés sur la troponine.
- Les algorithmes 0/1 h recommandés par les directives actuelles comme classe IA permettent un “rule-out” sûr et un “rule-in” précis de l’infarctus aigu du myocarde chez plus de 70% des patients concernés.
Littérature :
- Pitts SR, et al : National Hospital Ambulatory Medical Care Survey : 2006 emergency department summary. Natl Health Stat Report 2008 ; (7) : 1-38.
- Roffi M, et al : 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation : Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J 2016 ; 37(3) : 267-315.3.
- Thygesen K, et al : Troisième définition universelle de l’infarctus du myocarde. Eur Heart J 2012 ; 33(20) : 2551-2567.
- Canto JG, et al. : Prévalence, caractéristiques cliniques et mortalité chez les patients atteints d’infarctus du myocarde présentés sans douleur thoracique. JAMA 2000 ; 283(24) : 3223-3229.
- Neeland IJ, Kontos MC, De Lemos JA : Evolving considerations in the management of patients with left bundle branch block and suspected myocardial infarction. J Am Coll Cardiol 2012 ; 60(2) : 96-105.
- Nestelberger T, et al : Diagnostic de l’infarctus aigu du myocarde chez les patients présentant un bloc de branche du faisceau gauche dans trois études observationnelles internationales prospectives, sous revue.
- Sgarbossa EB, et al. : Diagnostic électrocardiographique de l’infarctus aigu du myocarde évolutif en présence d’un bloc de la branche gauche du faisceau. GUSTO-1 (Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries) Investigators. N Engl J Med 1996 ; 334(8) : 481-487.
- Reichlin T, et al : Diagnostic précoce de l’infarctus du myocarde avec des tests sensibles de troponine cardiaque. N Engl J Med 2009 ; 361(9) : 858-867.
- Keller T, et al : Sensitive troponin I assay in early diagnosis of acute myocardial infarction. N Engl J Med 2009 ; 361(9) : 868-877.
- Reichlin T, et al. : One-hour rule-out and rule-in of acute myocardial infarction using high-sensitivity cardiac troponin T. Arch Intern Med 2012 ; 172(16) : 1211-1218.
- Rubini Gimenez M, et al. : One-hour Rule-in and Rule-out of Acute Myocardial Infarction Using High-sensitivity Cardiac Troponin I. Am J Med 2015 ; 128(8) : 861-870.e4.
- Reichlin T, et al. : Two-hour Algorithm for Triage Toward Rule-out and Rule-in of Acute Myocardial Infarction Using High-sensitivity Cardiac Troponin T. Am J Med 2015 ; 128(4) : 369-379.e4.
- Boeddinghaus J, et al. : Two-Hour Algorithm for Triage toward Rule-Out and Rule-In of Acute Myocardial Infarction by Use of High-Sensitivity Cardiac Troponin I. Clin Chem 2016 ; 62(3) : 494-504.
- Boeddinghaus J, et al. : Direct Comparison of Four Very Early Rule-Out Strategies for Acute Myocardial Infarction Using High-Sensitivity Cardiac Troponin I. Circulation 2017 ; 135(17) : 1597-1611.
CARDIOVASC 2017 ; 16(4) : 8-12