En cas de dissection aortique aiguë, la paroi aortique se déchire d’abord de l’intérieur, ce qui provoque une séparation des couches de la paroi. Il en résulte un lumen supplémentaire. Que faire ?
En cas de dissection aortique aiguë, il se produit tout d’abord une déchirure de la paroi aortique depuis l’intérieur et une séparation des couches de la paroi (intima-média d’adventice) qui en résulte et qui crée une lumière supplémentaire (que nous appelons fausse lumière) en plus de la lumière vasculaire initiale (que nous appelons vraie lumière). Le corrélat clinique est une douleur thoracique aiguë, souvent migrante. La classification classique donne la définition de dissection de type A à une dissection impliquant l’aorte ascendante, la définition de dissection de type Non-A-non-B à une dissection impliquant l’aorte descendante et la définition de dissection de type B à une dissection impliquant l’aorte ascendante [1].
La localisation de la déchirure primaire (entrée) détermine l’évolution clinique de la dissection aortique aiguë. Le principe essentiel de la maladie sous-jacente est qu’une fois l’entrée primaire créée, la propagation dans la paroi aortique se fait avec et contre le flux sanguin, entraînant l’extension de la dissection [2].
La localisation de l’entrée primaire peut souvent être attribuée à un segment aortique. Cependant, c’est son extension finale le long et à contre-courant du flux sanguin qui conditionne l’évolution clinique, notre définition de la maladie (type A, type non-A-non-B ou type B) et la prise en charge thérapeutique invasive immédiate ou différée qui en découle, en plus du traitement médicamenteux qui consiste le plus souvent dans un premier temps à réduire la pression artérielle [3,4].
Propagation contre le flux sanguin
Une dissection aiguë avec une entrée primaire dans l’aorte ascendante, indépendamment de la propagation et de l’extension, est toujours appelée dissection de type A et la réparation chirurgicale aiguë est le gold standard, car la propagation rétrograde dans la racine aortique entraîne une insuffisance valvulaire aortique aiguë de haut grade par prolapsus de la commissure et la transsudation à travers la paroi aortique entraîne une tamponnade péricardique. Dans ce cas, la rupture aortique est un processus métachrone qui peut être immédiat, différé ou, dans certains cas, ne pas se produire du tout [5].
Une entrée primaire dans l’aorte descendante est appelée dissection de type B, mais là encore, la localisation de l’entrée primaire et son étendue font la différence essentielle pour le traitement, ou si une dissection aiguë de type B a déjà entraîné des complications, ou si des complications sont à prévoir, ou s’il est probable que la dissection sera sans complication. Nous considérons comme “compliquée” la survenue d’une perfusion d’organe par obstruction dynamique ou statique à travers la membrane de dissection des branches latérales ou terminales de l’aorte (moelle épinière, estomac/intestin, rein et extrémités) ; mais aussi des symptômes douloureux persistants (la douleur est un très bon biomarqueur au cours des premiers jours) et une différence de pression artérielle entre les membres supérieurs et inférieurs (dans le sens d’une pseudocoarctation causée par la membrane de dissection) sont considérés comme des évolutions “compliquées”. Toute forme d’épanchement pleural hémorragique et, de manière compréhensible, toute forme de rupture couverte ou non couverte sont également considérées comme “compliquées”. Si tous les symptômes mentionnés précédemment ne sont pas présents, nous parlons d’une dissection de type B “non compliquée” si le diamètre total de l’aorte disséquée ne dépasse pas 40 mm.
Nous considérons comme “potentiellement compliquées” les dissections qui répondent à des critères morphologiques qui précèdent souvent les complications mentionnées précédemment, Les plus importants sont la localisation de l’entrée primaire à l’intérieur de l’arc aortique (car en cas de propagation rétrograde, aucune barrière anatomique ne peut arrêter la progression du processus dans l’arc aortique et dans l’aorte ascendante, ce qui est souvent empêché à l’extérieur de l’arc par les vaisseaux de la tête et du cou) et une courte distance entre l’entrée primaire et l’artère sous-clavière gauche (les distances inférieures à 2 cm sont considérées comme courtes). [2,6,7].
Propagation le long du flux sanguin
Pendant de nombreuses années, nous nous sommes concentrés presque exclusivement sur la propagation le long du flux sanguin, ce qui est intuitivement correct, car une entrée primaire située directement au niveau de l’artère sous-clavière gauche ne montre son effet que dans les segments aortiques en aval, principalement au niveau des vaisseaux viscéraux et rénaux, par le collapsus de la vraie lumière avec malperfusion des organes terminaux concernés. [3,8].
Mécanismes de perfusion d’organes
La cause principale est une compression statique ou dynamique de la vraie lumière. La présence ou l’absence de malperfusion dépend fortement de la localisation de l’orifice primaire et de la dynamique de la membrane de dissection au cours du cycle cardiaque, la localisation de l’orifice primaire dans les segments angulés de l’aorte (comme l’arc aortique et l’aorte descendante proximale) étant davantage corrélée à la présence de malperfusion. [2–5].
Mécanismes de formation d’anévrisme
La raison principale de la formation d’anévrisme est la différence de pression sanguine entre la vraie et la fausse lumière et l’angle sous lequel le flux sanguin rencontre la paroi aortique. Ces facteurs sont à leur tour déterminés par la localisation de l’entrée primaire, ainsi que par le nombre et la taille des communications entre les luminaires (autrefois appelées entrées multiples et réentrées). Un autre facteur essentiel est la taille de la communication la plus distale entre les lumières, ou comme déchirure la plus distale (réentrée), car – si la réentrée est petite ou absente – la pression artérielle moyenne dans la fausse lumière peut être beaucoup plus élevée que dans la vraie lumière, ce qui entraîne une augmentation de la résistance périphérique [9,10].
Stratégie thérapeutique active
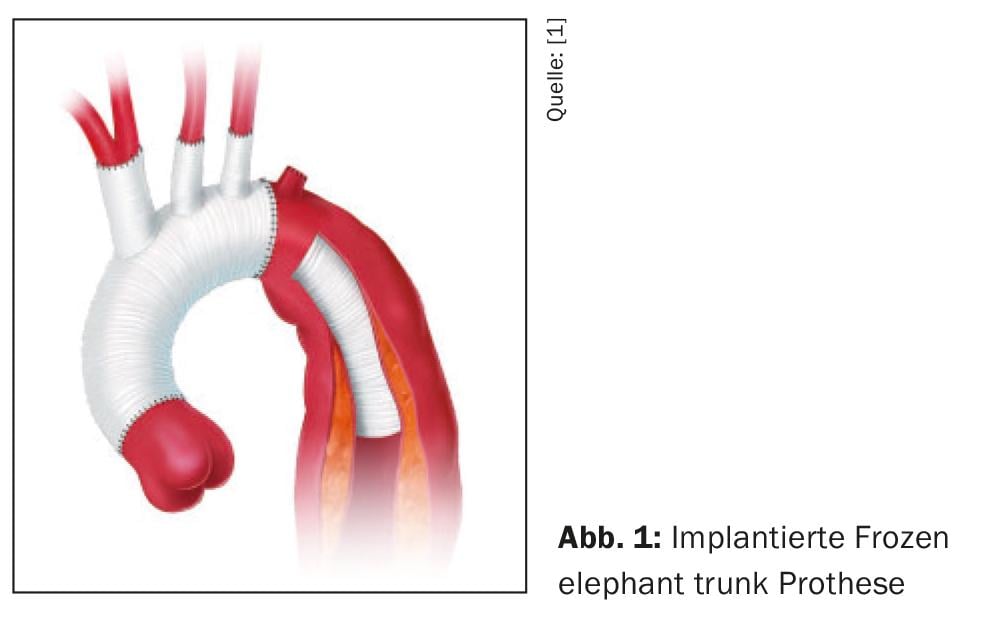
Le principe de base de toute stratégie thérapeutique active est toujours la fermeture de l’orifice primaire, soit par résection et remplacement vasculaire dans le cadre d’une chirurgie ouverte, soit par exclusion de l’orifice primaire du flux sanguin par la mise en place d’une endoprothèse, soit dans le cadre d’une réparation endovasculaire aortique thoracique (TEVAR), soit dans le cadre d’une chirurgie ouverte par la technique dite du Frozen Elephant Trunk (FET). (Fig. 1). L’approximation du cylindre intima-média et de l’adventice ainsi obtenue entraîne une décompression de la vraie lumière et le rétablissement simultané des diamètres transversaux réguliers des segments aortiques en aval, ce qui stabilise la membrane de dissection En général, cela suffit pour la situation aiguë, Cependant, le nombre et la taille des communications entre les lumières ont également une influence, de sorte qu’il est toujours nécessaire de procéder à une extension de l’endoprothèse, car les communications importantes entre les lumières peuvent continuer à provoquer des syndromes de malperfusion persistants malgré la fermeture réussie de l’orifice primaire. C’est pourquoi il est parfois nécessaire de placer des stents non couverts (ouverts) sur les branches des vaisseaux viscéraux et rénaux.
Sortie des grosses branches latérales de la vraie et/ou de la fausse lumière
Au cours de l’événement aigu, toutes les branches continuent dans un premier temps à partir de la vraie lumière, les cylindres intima/média des grosses branches latérales passent d’abord comme des tuyaux à travers la fausse lumière nouvellement créée vers l’organe terminal correspondant. Comme ces cylindres intima/media sont très fragiles, ils se déchirent souvent tôt ou tard à l’intérieur de la fausse lumière, ce qui entraîne alors morphologiquement la circonstance de la sortie de la fausse lumière. Il est essentiel de se rendre compte qu’il s’agit d’un effet secondaire et que la communication qui en résulte entre les luminaires a toujours la taille du diamètre de départ de la branche latérale. C’est pourquoi, dans la plupart des cas, le flux sanguin via cette communication entre la vraie et la fausse lumière est suffisant pour la perfusion de l’organe final, et la fermeture de l’entrée primaire avec l’arrêt de la perfusion dans la fausse lumière n’a pas d’effet négatif sur la perfusion de l’organe final concerné, que l’on ait utilisé la chirurgie ouverte, le TEVAR ou la technique FET. [12].
Résumé de la physiopathologie
Il faut toujours garder à l’esprit que les définitions actuelles (type A, type non-A-non-B, dissection de type B) ne sont que des approximations pour décrire le même processus physiopathologique dans lequel le début (entrée primaire) et la fin respective (le long et à l’opposé du flux sanguin) de la dissection font la différence fondamentale dans l’évolution clinique et la nécessité d’une stratégie de traitement active.
Quelle est la meilleure stratégie de traitement de la dissection de type B non compliquée ?
Pendant de nombreuses années, la dissection aiguë de type B a été interprétée dans son évolution clinique comme la dissection aortique “inoffensive” (surtout en comparaison avec la dissection de type A qui évolue souvent de manière dramatique), car il n’y avait que rarement besoin d’agir dans la situation aiguë [13]. Cependant, un examen plus attentif de l’évolution naturelle de la maladie a montré qu’un grand nombre de patients développent des complications à des moments donnés et doivent alors être traités activement [14]. Les raisons et les moments se sont avérés différents, la perfusion des organes, la propagation rétrograde dans l’arc aortique et dans l’aorte ascendante (dissection rétrograde de type A) étant au premier plan dans la phase aiguë de la maladie, puis la formation d’anévrisme prédominant dans la phase subaiguë et chronique [15]. La réponse à la question de savoir quels patients suivront quelle évolution primaire et qui développera secondairement des complications s’est surtout manifestée en termes de paramètres morphologiques et fonctionnels et a conduit à la définition de groupes à haut risque [16,17].
Classification temporelle de la maladie
La phase aiguë se définit à partir de l’apparition immédiate de l’événement douloureux primaire jusqu’au 14ème jour suivant, entre le 15ème et le 90ème jour, nous parlons de la phase subaiguë et à partir du 91ème jour, de la phase chronique [13].
INSTEAD trial
L’essai INSTEAD (Investigation of STEnt Grafts in Aortic Dissection) et le suivi à long terme (INSTEAD-XL trial) ont comparé de manière prospective si l’implantation prophylactique supplémentaire d’une endoprothèse (TEVAR) présente un avantage par rapport au traitement médicamenteux optimal seul chez les patients présentant une dissection de type B non compliquée entre 2 et 52 semaines après l’événement aigu. Après 5 ans, un effet positif significatif a été observé chez les patients ayant reçu TEVAR à titre prophylactique en termes de survie aortique et de progression de la maladie sous-jacente [18,19].
Essai ADSORB
L’essai ADSORB (Acute Dissection Stent Grafting or Best Medical Treatment) a comparé de manière prospective si l’ajout de TEVAR présentait un avantage par rapport au traitement médicamenteux optimal seul chez les patients présentant une dissection aiguë de type B non compliquée entre 0 et 2 semaines après l’événement aigu. Le critère d’évaluation principal était ici une combinaison de l’état de thrombose de la lumière vraie et, de la dilatation aortique ou d’événements aortiques adverses (rupture) à un an. La conclusion était que le TEVAR permettait d’obtenir à la fois un remodelage aortique positif et une réduction du diamètre avec thrombose (volontaire) consécutive de la fausse lumière, mais qu’il fallait attendre les résultats à long terme, qui ne sont pas encore disponibles à l’heure actuelle [20].
Ces deux études représentent le niveau de preuve le plus élevé disponible à l’heure actuelle. L’essai INSTEAD XL a précisément conduit à une modification des dernières directives aortiques de l’ESC et a élevé le TEVAR prophylactique à une recommandation de classe IIA, niveau de preuve B, en cas de dissection de type B non compliquée.
Evolution naturelle de la dissection de type B non compliquée
Après la phase aiguë, une chronicisation se produit, la membrane de dissection se trouvant dans une phase de transition entre l’état aigu hautement élastique et fragile et un état statique. L’effet de la réapposition complète des couches de la paroi est le meilleur dans les quelques semaines qui suivent l’événement aigu [21]. Il est très rare que des complications telles que la perfusion d’organes ou la propagation rétrograde dans l’aorte ascendante (dissection rétrograde de type A) surviennent encore à ce stade ; cependant, on observe toujours une augmentation du diamètre transversal maximal de l’aorte. Cette augmentation de diamètre peut être anticipée par des critères morphologiques ou par des contrôles angiographiques par tomographie assist ée par ordinateur (CTA) et peut alors être stoppée à un stade précoce et, dans le meilleur des cas, rendue réversible par TEVAR [16].
Stratégie de traitement optimale en cas de dissection aiguë de type B non compliquée
Sur la base des preuves actuellement disponibles, il est juste de recommander un traitement médicamenteux optimal comme base de traitement de toute dissection aiguë de type B. Une analyse morphologique précise permet d’identifier les sous-groupes à “haut risque” qui bénéficient d’un TEVAR précoce en termes de pronostic. Cela représente finalement un très grand nombre de patients, jusqu’à 80% dans certains collectifs. L’essai INSTEAD et son suivi à 5 ans (INSTEAD XL Trial) nous fournissent les meilleures preuves actuellement disponibles sur le bénéfice d’une stratégie endovasculaire chez les patients présentant une dissection de type B non compliquée. Le TEVAR prophylactique doit être envisagé si l’anatomie est appropriée [19]. Ces dernières années, cette connaissance accrue a déjà été intégrée dans des lignes directrices internationales et des documents de consensus d’experts [22,23].
Étude de cas 1 – Dissection aiguë compliquée de type BUn homme de 57 ans souffre d’une douleur thoracique aiguë soudaine qui commence entre les omoplates et s’étend jusqu’à l’aine. Après 5 minutes, il développe d’abord des troubles de la sensibilité, puis une paraparésie et finalement une paraplégie du membre inférieur droit. Le médecin urgentiste appelé sur place constate cliniquement un déficit du pouls dans l’aine droite et, en associant la symptomatologie douloureuse migratoire et le déficit du pouls, il suspend la suspicion d’une dissection aortique aiguë. De plus, le patient développe cliniquement un abdomen aigu avec des douleurs et une tension défensive. Il est transféré au service d’urgence le plus proche où, sur la base du diagnostic de suspicion, un CTA de l’aorte entière est effectué. Résultat de l’ECT : L’ECT montre une dissection de type B, l’entrée primaire étant située sur la face interne de l’arc aortique, essentiellement sans distance avec l’artère sous-clavière gauche. Il existe un collapsus de la vraie lumière au niveau des vaisseaux viscéraux et rénaux et l’artère iliaque commune droite est également fonctionnellement occluse. Évolution clinique : Le lactate sérique augmente jusqu’à 10 mmol/l et la diurèse s’arrête. Il est urgent de fermer l’entrée primaire pour décomprimer la vraie lumière et rétablir la circulation sanguine dans les segments aortiques en aval et dans le membre inférieur droit. Constellation favorisant un TEVAR primaire. Dans le cadre du diagnostic de CTA, les vaisseaux de la tête et du cou ont également été examinés, l’artère vertébrale gauche est petite et ne contribue pas à la compétence du cercle de Willisi. Dans cette constellation, un TEVAR primaire avec surstentation du départ de l’artère sous-clavière gauche peut être réalisé pour résoudre la situation aiguë, la probabilité de déclencher une ischémie aiguë du membre supérieur est faible, mais une mesure de la saturation périphérique en oxygène doit être effectuée sur le bras gauche et la suite de la procédure doit en outre dépendre de l’évolution clinique (claudication à l’effort). La constellation qui favorise le TEVAR et la revascularisation simultanée de l’artère sous-clavière gauche : L’artère vertébrale gauche est un très gros vaisseau et le cercle de Willisi est interrompu, ce qui – en cas d’hypoplasie de l’artère vertébrale droite – confère à la gauche une importance fondamentale. C’est pourquoi un pontage carotido-sous-clavier est réalisé avant l’implantation de l’endoprothèse afin de préserver la circulation cérébrale postérieure et de maintenir l’afflux dans l’artère spinale antérieure (pour éviter l’ischémie de la moelle épinière). Constellation favorisant l’implantation primaire de FET : Le patient présente un anévrisme de l’aorte ascendante et de la crosse aortique d’un diamètre transversal maximal de 5 cm, ce qui ne permet pas de disposer d’une zone d’atterrissage proximale adéquate et d’effectuer un TEVAR. |
Sous-groupes “à haut risque” avec dissection aiguë de type B – localisation de l’entrée primaire
La localisation de l’éventration primaire à la face interne de la crosse aortique s’est avérée être l’un des facteurs de risque morphologique les plus importants pour la présence ou la survenue de complications en cas de dissection aiguë de type B, en particulier pour la survenue d’une perfusion d’organe et de dissections rétrogrades de type A dans les 14 premiers jours suivant l’événement aigu [2,16,17].
Distance entre l’entrée primaire et la sortie de l’artère sous-clavière gauche
La distance entre l’entrée primaire et la sortie de l’artère sous-clavière gauche est également un facteur prédictif important, le risque diminuant nettement avec une distance plus grande [16, 24-26].
Taille de l’entrée primaire
La taille de l’éventration primaire est également importante pour le pronostic, notamment en ce qui concerne l’augmentation précoce du diamètre transversal maximal de l’aorte. Au-delà de 10 mm de diamètre transversal maximal, le risque d’expansion aortique précoce et de rupture augmente de manière significative. La meilleure méthode, mais rarement utilisée en première intention pour des raisons pragmatiques, est l’échocardiographie transoesophagienne (ETO) [25]. Cela s’explique également par un pic de pression artérielle souvent associé à l’ETO, que l’on souhaite en principe éviter en cas de dissection aortique.
Diamètre total de l’aorte et diamètre de la fausse lumière
Un diamètre total de 40 mm ou plus, initialement mesuré dans le cadre du diagnostic de CTA, ainsi qu’un diamètre initial de la lumière fasciculée égal ou supérieur à 22 mm se sont également révélés être des prédicteurs d’augmentation de taille au fil du temps et justifient la mise en place d’une endoprothèse endovasculaire [17,27,28].
Nombre et taille des communications entre les luminaires
Le nombre et la taille des communications entre les lumières dans l’ensemble de l’aorte thoraco-abdominale se sont également avérés être des facteurs importants d’augmentation de la taille au fil du temps. Même après TEVAR, des communications de gros calibre entre les lumières peuvent agir fonctionnellement comme une nouvelle entrée primaire, du côté distal de l’endoprothèse. Un mécanisme similaire peut être observé lorsque, après TEVAR, la membrane de dissection à l’extrémité distale de l’endoprothèse se déchire vers l’intérieur dans la fausse lumière en raison de forces de cisaillement excessives (généralement lorsque l’endoprothèse est surdimensionnée), on parle alors de nouvelle entrée induite par l’endoprothèse distale(dSINE) [29,30].
Thrombose de la fausse lumière à des degrés divers
Une thrombose partielle de la fausse lumière s’est également avérée être un substitut pronostique pour une évolution défavorable. Une thrombose partielle peut souvent être caractérisée comme un phénomène de flux avec l’imagerie moderne, mais l’hypothèse d’une pression artérielle moyenne élevée dans la fausse lumière en raison d’un retard d’écoulement (petite communication distale entre les lumières) reste la même, car la résistance périphérique est élevée dans la fausse lumière [10].
TEVAR pour chaque patient présentant une dissection de type B non compliquée ?
L’intérêt du TEVAR prophylactique reste d’éviter la formation ultérieure d’anévrisme et les complications tardives qui y sont associées, car la malperfusion et la dissection rétrograde spontanée de type A ne surviennent que pendant la phase aiguë. Cependant, une dissection rétrograde de type A peut également survenir dans le cadre d’un TEVAR, et ce fait, combiné à d’autres complications liées à la procédure, très rares mais présentes, telles que les accidents vasculaires cérébraux et les ischémies médullaires symptomatiques, est la raison pour laquelle il faut continuer à bien justifier l’indication. Une aorte ascendante ectasiée, un arc aortique ectasié et des procédures de transposition extensives pour atteindre une zone d’atterrissage proximale adéquate constituent d’autres facteurs de risque [31,32].
Étude de cas 2 – Dissection aiguë non compliquée de type BUne femme de 64 ans souffre d’une douleur thoracique aiguë qui commence entre les omoplates et se poursuit jusqu’au niveau du diaphragme. Elle perd conscience pendant 30 secondes, puis la douleur s’atténue. Le médecin urgentiste pose le diagnostic clinique de suspicion de syndrome coronarien aigu et dirige la patiente vers le service d’urgence le plus proche disposant d’un poste de cathétérisme pour la poursuite du diagnostic. Des examens complémentaires sont effectués : Une prise de sang est effectuée, les enzymes cardiaques sont normales, mais les D-dimères sont élevés. Un CTA est effectué pour exclure une embolie pulmonaire ou une dissection aortique. L’ACT montre une dissection de type B avec une entrée primaire à la face externe de l’arc aortique sans indication de malperfusion. Constellation favorisant une approche principalement conservatrice : La distance entre l’entrée primaire et l’artère sous-clavière gauche est de 3 cm, le diamètre transversal maximal de l’entrée primaire est de 5 mm, le diamètre total de l’aorte est de 37 mm et le diamètre de la fausse lumière est de 16 mm. Il n’y a aucun signe de malperfusion à l’imagerie et à l’examen clinique. Dans cette constellation, il existe donc une situation à faible risque et une approche conservatrice primaire avec un traitement médicamenteux optimal et un CTA de contrôle sont ordonnés. Constellation favorisant un TEVAR prophylactique :
Ces deux constellations peuvent être considérées comme des constellations à “haut risque” malgré une dissection de type B formelle “non compliquée” et un traitement TEVAR précoce pour fermer l’entrée primaire doit être effectué. En principe – si TEVAR est effectué dans des circonstances prévues, un drainage du liquide céphalo-rachidien doit être mis en place avant l’intervention pour protéger la moelle épinière (le drainage du liquide céphalo-rachidien est la fasciotomie de la moelle épinière). |
Évaluation des risques de complications potentielles associées au traitement
Le risque résiduel d’accident vasculaire cérébral est de l’ordre d’un faible pourcentage à un chiffre. Dans ce cas, il est possible d’obtenir des informations précises dès le départ en évaluant l’ACT diagnostique en termes de lésions artérioscléreuses à proximité des départs des branches supra-aortiques, ce qui permet de comprendre ou d’exclure un risque potentiel d’embolie dû à la manipulation du cathéter.
L’ischémie médullaire symptomatique reste un sujet important, avec des degrés divers allant des troubles de la sensibilité à la paraplégie complète. Dans ce domaine, les connaissances sur les mécanismes sous-jacents et leur prévention ont fait un bond quantique ces dernières années. Il convient de préciser que la moelle épinière, à l’instar de l’arcade de Riolan de l’apport artériel viscéral, possède des mécanismes de sauvegarde extra- et intraspinaux qui peuvent, dans une certaine mesure, compenser une diminution aiguë et chronique de l’irrigation sanguine. Nous allons tout d’abord aborder le concept de “quatre territoires” [33]. Cela présuppose l’existence anatomique de quatre affluents artériels de la moelle épinière – de valeur égale -, à savoir l’artère sous-clavière (avec son prolongement dans l’artère vertébrale et donc dans l’artère spinale antérieure, les artères segmentaires thoraciques (vaisseaux intercostaux), les artères segmentaires lombaires (vaisseaux lombaires) et les artères iliaques internes, qui constituent toutes des affluents des artères radiculomédullaires antérieures et donc de l’artère spinale antérieure. L’occlusion de l’un de ces affluents artériels (par exemple, la couverture de plusieurs artères segmentaires thoraciques par une endoprothèse) n’a pas d’impact significatif sur le risque d’ischémie médullaire symptomatique. Cependant, si deux affluents sont fermés en même temps (par ex. surstentation supplémentaire de l’artère sous-clavière gauche), cela augmente significativement le risque de paraplégie, car ce degré de diminution de la circulation sanguine ne peut plus être compensé. Même une seule phase d’hypotension prononcée peut déjà augmenter le risque de paraplégie (par exemple, TEVAR aigu en cas de rupture). En cas de diminution aiguë de l’irrigation sanguine, par exemple dans la partie thoracique de la moelle épinière, la nature a la possibilité de compenser par le biais des muscles dorsaux autochtones et d’induire un bourgeonnement de vaisseaux capillaires dans la zone moins bien irriguée [34]. Il existe même des vaisseaux collatéraux -préformés à l’intérieur de la moelle épinière qui peuvent prendre le relais dans de telles situations, mais la capacité de ce réseau collatéral est justement limitée et toute forme d’hypotension per- ou postopératoire contribue au risque [35].
Une mesure extrêmement utile en situation élective pour prévenir les ischémies médullaires symptomatiques est la mise en place d’un drainage du liquide céphalorachidien avant l’intervention. Chaque tissu, y compris la moelle épinière, réagit à une ischémie aiguë par un gonflement des tissus, mais la moelle épinière est très limitée dans son canal spinal étroit par la présence de son liquide porteur, le liquide céphalo-rachidien, et – comme pour l’ischémie des extrémités sans fasciotomie – on assiste à une compression du lit capillaire et donc à un cercle vicieux qui se termine par la perte d’un organe, dans la mesure où le drainage du liquide céphalo-rachidien peut être considéré comme la fasciotomie de la moelle épinière. [36]. Même en cas d’ischémie médullaire secondaire symptomatique, par exemple quelques jours après l’intervention, la mise en place d’un drainage du liquide céphalorachidien est souvent associée à un succès clinique impressionnant.
Une autre mesure de surveillance très utile pour le TEVAR est la mesure des potentiels évoqués moteurs et somatosensoriels (MEPs/SSEPs) [37]. Ces mesures peuvent également être très utiles dans la phase précoce d’une ischémie aiguë de la moelle épinière.
Au cours des dernières années, la technique FET s’est établie dans le traitement d’un grand nombre de pathologies aortiques thoraciques aiguës et chroniques, mais aussi chez les patients présentant une dissection complexe de type B, mais ne disposant pas d’une zone d’atterrissage proximale adéquate pour ancrer l’endoprothèse. Bien que cette indication soit rare, elle doit être envisagée si le risque estimé de dissection rétrograde de type A est élevé. Les résultats de cette procédure dans cette indication sont très bons dans les centres expérimentés [33]. En revanche, l’opération ouverte classique par thoracotomie latérale gauche n’a plus de valeur aujourd’hui.
Les opérations de fenestration ouverte, au cours desquelles la membrane de dissection est partiellement excisée, sont également obsolètes aujourd’hui. En outre, le seul traitement interventionnel d’un organe terminal malperfusé n’a pas de sens, car la cause de la malperfusion persisterait à travers l’entrée primaire ouverte et resterait inchangée.
Choisir le bon moment pour le traitement
Les preuves actuellement disponibles suggèrent – en cas de stabilité clinique – qu’un délai plus long entre l’événement aigu et le TEVAR (plus de 2 semaines) est favorable en termes de complications liées à la procédure [38,39].
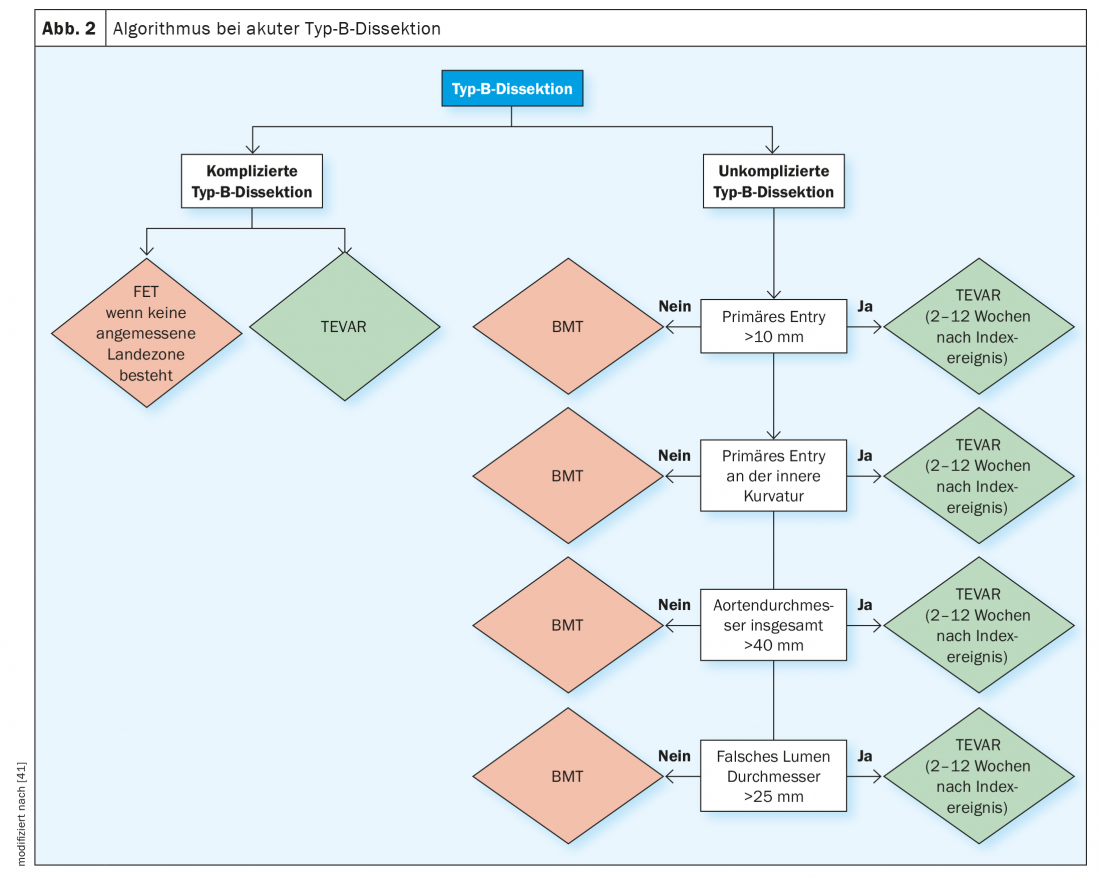
Algorithme de diagnostic et de traitement recommandé
Le diagnostic de dissection aiguë et subaiguë de type B non compliquée nécessite un algorithme d’évaluation complexe dans le cadre duquel les paramètres de substitution évoqués pour les complications précoces et tardives doivent être évalués avant de poser le diagnostic de dissection de type B “non compliquée”. La figure 2 illustre l’algorithme de diagnostic recommandé par les grandes sociétés médicales pour définir ces sous-groupes à haut risque et pour choisir la bonne voie de traitement.
Messages Take-Home
- L’incidence de la dissection de type B vraiment non compliquée est plus faible que ce que l’on pensait jusqu’à présent.
- Un diagnostic d’exclusion progressif pour confirmer ou exclure les substituts à haut risque doit être utilisé sur la base d’une angiographie par scanner avant d’établir le diagnostic “non compliqué”.
- Le potentiel de remodelage positif de l’aorte (réduction du diamètre, approximation des couches de la paroi) diminue avec le temps, ce qui doit être pris en compte lors du choix du moment du traitement (“window of opportunity of 90 days”).
- Le maintien de la perfusion de la moelle épinière par les quatre principales voies artérielles est un facteur essentiel pour réduire le risque résiduel d’ischémie médullaire symptomatique.
- Le drainage du liquide céphalo-rachidien est une mesure très efficace pour la prévention et le traitement des ischémies médullaires symptomatiques.
- La technique FET doit être envisagée chez les patients qui nécessitent un traitement mais qui présentent un risque élevé de dissection rétrograde de type A. La technique FET permet de réduire le risque de dissection rétrograde.
Littérature :
- Czerny M, Schmidli J, Adler S, et al : Current options and recommendations for the treatment of thoracic aortic pathologies involving the aortic arch- an expert consensus document of the European Association for Cardio-Thoracic Surgery (EACTS) and the European Society of Vascular Surgery (ESVS). Eur J Cardiothorac Surg 2019(55) : 133-162.
- Loewe C, Czerny M, Sodeck GH, et al : Un nouveau mécanisme par lequel une dissection aortique aiguë de type B est principalement compliquée, devient compliquée, ou reste non compliquée. Ann Thorac Surg 2012 ; 93 : 1215-1522.
- Ante M, Mylonas S, Skrypnik D, et al : Prévalence des prédicteurs morphologiques DISSECT tomodensitométriques dans la dissection aortique de type B de Stanford non compliquée. Eur J Vasc Endovasc Surg 2018 ; 56 : 525-533.
- Weiss G, Wolner I, Folkmann S, et al : L’emplacement de la fissure d’entrée primaire dans la dissection aortique aiguë de type B affecte l’issue précoce. Eur J Cardiothorac Surg 2012 ; 42 : 571-576.
- Erbel R, Aboyans V, Boileau C, et al : 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases- Document couvrant les maladies aortiques aiguës et chroniques de l’aorte thoracique et abdominale de l’adulte- The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J 2014 ; 35 : 2873-2926.
- Rylski B, Reser D, Kari F, et al : Acute Non A, non B aortic dissection : definition, treatment and outcome. Eur J Cardiothorac Surg 2017 ; 52 : 1111-1117.
- Grimm M, Loewe C, Gottardi R, et al : Novel insights into the mechanisms and treatment of intramural hematoma affecting the entire thoracic aorta. Ann Thorac Surg 2008 ; 86 : 453-456.
- Trimarchi S, Jonker FH, van Bogerijen GH, et al : Predicting aortic enlargement in type B aortic dissection. Ann Cardiothorac Surg 2014 ; 3 : 285-291.
- Czerny M, Eggebrecht H, Rousseau H, et al : Stent-graft distal induit une nouvelle entrée après TEVAR ou FET – insights into a new disease from EuREC. Ann Thorac Surg 2020, e-pub ahead of print.
- Tsai TT, Evangelista A, Nienaber CA, et al : International Registry of Acute Aortic Dissection. Thrombose partielle de la fausse lumière chez les patients ayant subi une dissection aortique aiguë de type B. N Engl J Med 2007 ; 357 : 349-59.
- Evangelista A, Isselbacher EM, Bossone E, et al. : Insights from the International Registry of Acute Aortic Dissection : A 20 year experience of collaborative clinical research. Circulation 2018 ; 137 : 1846-1860.
- Czerny M, Rodler S, Fakhimi S, et al : Résultats à mi-parcours du TEVAR chez les patients présentant des anévrismes impliquant l’aorte descendante et provenant de dissections chroniques de type B. Ann Thorac Surg 2010 ; 90:90-94.
- Evangelista A, Isselbacher EM, Bossone E, et al. : Insights from the International Registry of Acute Aortic Dissection : A 20 year experience of collaborative clinical research. Circulation 2018 ; 137 : 1846-1860.
- Pape LA, Awais M, Woznicki EM, et al : Présentation, diagnostic et résultats de la dissection aortique aiguë : 17-year trends from the international registry of acute aortic dissection. J Am Coll Cardiol 2015 ; 66 : 350-358.
- Zeeshan A, Woo EY, Bavaria JE, et al : Thoracic endovascular aortic repair for acute complicated type B aortic dissection : superiority relative to conventional open surgical and medical therapy. J Thorac Cardiovasc Surg 2010 ; 140(6 Suppl) : S109-15.
- Trimarchi S, Jonker FH, van Bogerijen GH, et al : Predicting aortic enlargement in type B aortic dissection. Ann Cardiothorac Surg 2014 ; 3 : 285-291.
- Ante M, Mylonas S, Skrypnik, et al : Prévalence des prédicteurs morphologiques DISSECT tomodensitométriques dans la dissection aortique de type B de Stanford non compliquée. Eur J Vasc Endovasc Surg 2018 ; 56 : 525-533.
- Nienaber C, Rousseau H, Eggebrecht H, et al. : A randomized comparison of strategies for noncomplicated type B aortic dissection – the INvestigation of STEnt-grafts in Aortic Dissection (INSTEAD) trial. Circulation 2009 ; 120 : 2519-2528.
- Nienaber CA, Kische S, Rousseau H, et al : Endovascular repair of type B aortic dissection : long-term results of the randomized investigation of stent grafts in aortic dissection trial. Circ Cardiovasc Intervent 2013 ; 6 : 407-416.
- Brunkwall J, Kasprzak P, Verhoeven E, et al : Endovascular repair of acute uncomplicated aortic type B dissection promotes aortic remodeling ; 1 year results of the ADSORB trial. Eur J Vasc Endovasc Surg 2014 ; 48 : 285-291. Erratum dans Eur J Vasc Endovasc Surg 2015 ; 50 : 130.
- Moulakakis KG, Mylonas SN, Dalainas I, et al : Management of complicated and uncomplicated acute type B dissection. A systematic review and meta-analysis. Ann Cardiothorac Surg 2014 ; 3 : 234-246.
- Erbel R, Aboyans V, Boileau C, et al : 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases- Document couvrant les maladies aortiques aiguës et chroniques de l’aorte thoracique et abdominale de l’adulte- The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J 2014 ; 35 : 2873-2926.
- Grabenwöger M, Alfonso F, Bachet J, et al : Déclaration de position ESC/EACTS sur la réparation endovasculaire de l’aorte thoracique (TEVAR). Eur J Cardiothorac Surg 2012 ; 42 : 17-24.
- Weiss G, Wolner I, Folkmann S, et al : L’emplacement de la fissure d’entrée primaire dans la dissection aortique aiguë de type B affecte l’issue précoce. Eur J Cardiothorac Surg 2012 ; 42 : 571-576.
- Evangelista A, Salas A, Ribera A, et al : Résultat à long terme de la dissection aortique avec fausse lumière patente : rôle prédictif de la taille et de l’emplacement de la brèche d’entrée. Circulation 2012 ; 125 : 3133-3141.
- Codner JA, Lou X, Duwayri YM, et al : The distance of the primary intimal tear from the left subclavian artery predicts aortic growth in uncomplicated type B aortic dissection. J Vasc Surg 2019 ; 69 : 692-700.
- Song JM, Kim SD, Kim JH, et al : Prédicteurs à long terme des changements anévrismaux de l’aorte descendante chez les patients ayant subi une dissection aortique. J Am Coll Cardiol 2007 ; 50 : 799-804.
- Fattori R Cao P, De Rango P, et al : Interdisciplinary expert consensus document on endovascular treatment of type B aortic dissection. J Am Coll Cardiol 2013 ; 61 : 1661-1678.
- Czerny M, Eggebrecht H, Rousseau H, et al : Stent-graft distal induit une nouvelle entrée après TEVAR ou FET – insights into a new disease from EuREC. Ann Thorac Surg 2020, sous presse.
- Lou X, Duwayri YM, Jordan WD Jr, et al : The Safety and Efficacy of Extended TEVAR in Acute Type B Aortic Dissection. Ann Thorac Surg 2020, sous presse.
- Cochennec F, Tresson P, Cross J, et al : Réparation hybride des dissections de l’arc aortique. J Vasc Surg 2013 ; 57 : 1560-1567.
- Eggebrecht H, Thompson M, Rousseau H, et al ; au nom du Registre européen des complications de la réparation endovasculaire de l’aorte. Dissection aortique ascendante rétrograde pendant ou après la pose d’une endoprothèse aortique thoracique – enseignements tirés du registre européen des complications de la réparation endovasculaire de l’aorte (EuREC). Circulation 2009 ; 120 : S276-281.
- Czerny M, Eggebrecht H, Sodeck G, et al : Mechanisms of symptomatic spinal cord ischemia after TEVAR- Insights from the European Registry of Endovascular Aortic Repair Complications (EuREC). J Endovasc Ther 2012 ; 19 : 37-43.
- Etz CD, Kari FA, Mueller CS, et al : The collateral network concept : remodeling of the arterial collateral network after experimental segmental artery sacrifice. J Thorac Cardiovasc Surg 2011 ; 141 : 1029-1036.
- Heber U, Mayrhofer M, Gottardi R, et al : The intraspinal arterial collateral network – a new anatomical basis for understanding and preventing paraplegia during aortic repair. Eur J Cardiothorac Surg 2020, sous presse.
- Etz C, Weigang E, Hartert M, et al : Contemporary spinal cord protection during thoracic and thoracoabdominal aortic surgery and endovascular aortic repair : A position paper of the vascular domain of the European Association for Cardio-Thoracic Surgery. Eur J Cardiothorac Surg 2015 ; 47 : 943-957.
- Maier S, Shcherbakova M, Beyersdorf F, et al. : Benefits and risks of prophylactic cerebro-spinal fluid catheter and evoked potential monitoring in symptomatic spinal cord ischemia low-risk thoracic endovascular aortic repair. Thorac Cardiovasc Surg 2018 ; 67 : 379-384.
- Kreibich M, Berger T, Morlock J, et al : The frozen elephant trunk technique for the treatment of acute complicated type B aortic dissection. Eur J Cardiothorac Surg 2018 ; 53 : 525-530.
- Desai ND, Gottret JP, Szeto WY, et al : Impact du timing sur les complications majeures après réparation endovasculaire thoracique de l’aorte pour dissection aortique aiguë de type B. J Thorac Cardiovasc Surg 2015 ; 149(2 Suppl) : S151-156.
- Heijmen R, Fattori R, Thompson M, et al : Résultats à mi-parcours et remodelage aortique après réparation endovasculaire thoracique pour dissection aortique aiguë, subaiguë et chronique : le registre VIRTUE. Eur J Vasc Endovasc Surg 2014 ; 48 : 363-371.
- Czerny M, Pacini D, Aboyans V, et al.: Options actuelles et recommandations pour l’utilisation de la réparation endovasculaire aortique thoracique dans les maladies aortiques thoraciques aiguës et chroniques : un document de consensus d’experts du groupe de travail de la Société européenne de cardiologie (ESC) sur la chirurgie cardiovasculaire, du groupe de travail de l’ESC sur les maladies aortiques et vasculaires périphériques, de l’Association européenne des interventions cardiovasculaires percutanées (EAPCI) de l’ESC et de l’Association européenne de chirurgie cardio-thoracique (EACTS). Eur J Cardiothorac Surg 2021 Jan 4;59(1) : 65-73.
CARDIOVASC 2022 ; 21(3) : 6-12