Les extraits de millepertuis ont fait leurs preuves dans le traitement des troubles dépressifs. Cependant, certaines préparations diminuent les taux plasmatiques d’autres médicaments en induisant le CYP3A4 et la glycoprotéine P (ABCB1), ce qui réduit leur efficacité. Ces interactions pharmacocinétiques ne sont pas observées avec les extraits hyperforamineux. Un traitement avec de tels extraits augmente la sécurité de cette thérapie.
Selon l’OMS, environ 264 millions de personnes de toutes les catégories d’âge souffrent de dépression dans le monde. Elle constitue la principale cause d’incapacité de travail [1]. Les directives internationales et nationales en matière de traitement recommandent le recours à la psychothérapie ou à la pharmacothérapie en cas de dépression légère, et à la psychothérapie ou/et à la pharmacothérapie en cas de dépression modérée ou sévère [2]. Outre les antidépresseurs de synthèse tels que les ISRS, les phytothérapies comme le millepertuis (Hypericum perforatum) font partie de l’arsenal thérapeutique, son efficacité et sa bonne tolérance ayant été démontrées par de nombreuses études [3–5]. Mais le millepertuis doit également être pris sous contrôle médical spécialisé [6] : bien qu’il existe sur le marché de nombreuses préparations en vente libre en plus de celles délivrées sur ordonnance, le millepertuis est connu pour son potentiel d’interaction pharmacocinétique avec un grand nombre de médicaments, ce qui explique que sa prise ne soit pas sans risque. Ce phytomédicament a acquis une notoriété inquiétante après la découverte d’un rejet de l’organe transplanté chez des patients transplantés cardiaques traités à la ciclosporine et recevant une comédication à base de millepertuis en raison d’une comorbidité dépressive [7]. L’extrait d’hypéricum induit l’enzyme CYP3A4 responsable du métabolisme de la ciclosporine. L’efficacité de cet immunosuppresseur est considérablement réduite par la baisse de sa biodisponibilité [8]. Le composant du millepertuis responsable de l’induction du CYP3A4 est l’hyperforine, mais les extraits d’hypéricum disponibles sur le marché varient considérablement en termes de teneur en ce composé.
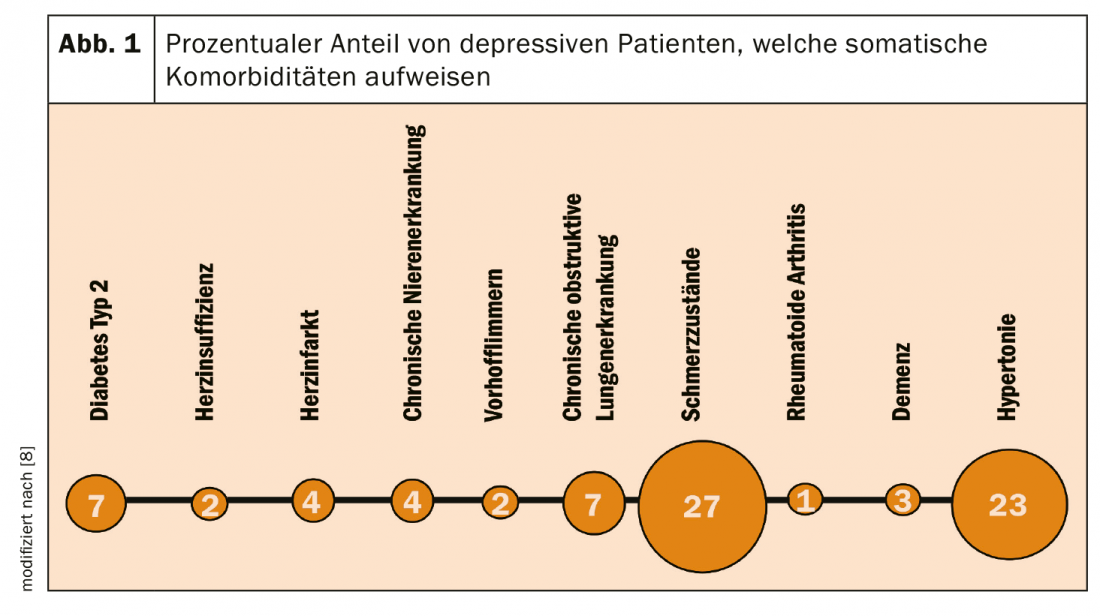
Les patients dépressifs ne sont pas uniquement traités par un spécialiste en psychiatrie et psychothérapie, mais également par un spécialiste en médecine générale ou interne. En cas de dépression, le risque de certaines comorbidités est particulièrement élevé (fig. 1), mais les patients dépressifs souffrent également d’autres maladies somatiques et psychiques qui entraînent des comédications [8]. Heureusement, il existe un extrait pauvre en hyperfornine qui se caractérise par un faible risque d’interaction avec d’autres médicaments et qui favorise les conditions d’un traitement sûr chez ces patients.
Les extraits d’hypéricum et leurs indications
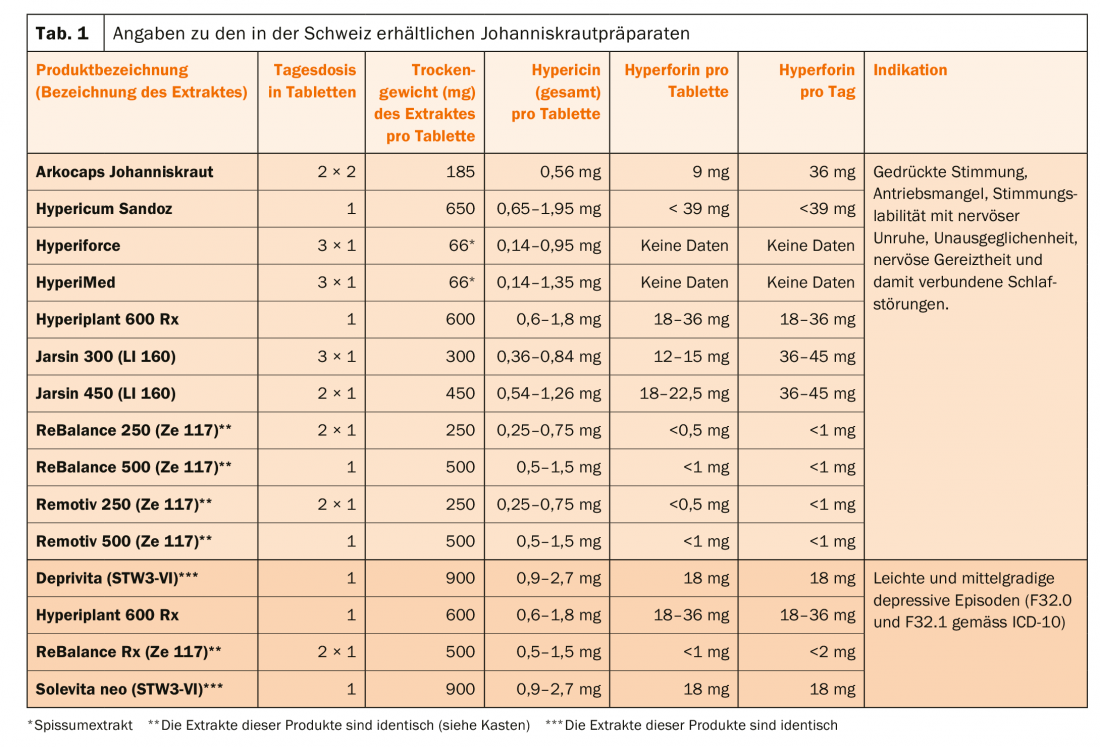
Les extraits d’hypéricum dont il est question dans cet article sont recommandés pour deux groupes de diagnostic différents, selon la préparation utilisée (tableau 1) :
- Pour les patients qui souffrent d’une humeur déprimée, d’une instabilité de l’humeur, d’une agitation intérieure, d’états de tension et de troubles de l’endormissement et du sommeil qui en découlent. Il s’agit de médicaments de la catégorie de remise D.
- Pour les patients chez qui un épisode dépressif léger ou modéré (F32.0 et F32.1 selon la CIM-10) a été diagnostiqué. Il s’agit de médicaments de la catégorie de remise B.
Les doses quotidiennes pour le traitement des patients avec du millepertuis varient considérablement (tableau 1). Or, une analyse de 28 études cliniques sur l’efficacité de différents extraits d’hypericum dans la dépression majeure montre qu’à partir d’une dose ≥180 mg/jour d’extrait, on obtient un plateau d’efficacité en ce sens que même avec des doses de 1800 mg/jour n’ont pas permis d’obtenir de meilleurs résultats thérapeutiques [9].
Hypericum a relativement peu d’effets secondaires et est bien toléré [10]. Une certaine photosensibilisation s’applique à tous les produits phytothérapeutiques Hypericum et une forte exposition au soleil doit être évitée. Cependant, le risque ne semble devenir cliniquement significatif qu’à des doses quotidiennes de >2-4 g d’hypericum (correspondant à 5-10 mg/jour d’hypericine) [9].
Les interactions pharmacodynamiques doivent également être prises en compte. L’hypericum est également un inhibiteur de l’absorption de la sérotonine et son association avec les ISRS comporte donc un risque de syndrome sérotoninergique, bien que dans le cas du citalopram, par exemple, l’induction attendue de son métabolisme vers une diminution de sa biodisponibilité rendrait un tel risque moins probable [10].
Mécanisme d’action
Les extraits d’hypéricum contiennent un grand nombre de substances actives, dont les concentrations varient non seulement d’une préparation à l’autre, mais aussi d’une préparation à l’autre, par exemple pour l’hypéricine totale, elles varient de 0,14 à 1,35 mg pour un comprimé pelliculé Hyperimed® (Tab.1). On pensait auparavant que l’hypéricine, la pseudohypéricine (l’hypéricine + la pseudohypéricine étant désignées comme l’hypéricine totale) et l’hyperforine étaient principalement responsables des effets thérapeutiques, mais il a été démontré depuis que les extraits à faible hyperforine sont également efficaces. L’Hypericum contient d’autres composés comme ceux de type flavinoïde (quercétine, quercétrine, rutine) qui pourraient également contribuer à l’effet thérapeutique [11]. En général, les extraits inhibent la recapture de la sérotonine, de la noradrénaline et de la dopamine, mais ils agissent également sur le GABA et le glutamate. Leur profil d’action est similaire à celui de nombreux antidépresseurs synthétiques, y compris leur capacité à provoquer une régulation négative des récepteurs β et une régulation positive des récepteurs 5-HT2 (c’est-à-dire que le nombre de récepteurs diminue, respectivement augmente). L’hyperforine favorise l’entrée des ions Na et Ca dans les canaux TRPC6 (transient receptor potential channels). Dans les expériences sur les animaux, l’hyperforine et/ou l’hypéricine, selon le modèle, se révèlent actives [12,13]. Il est néanmoins difficile de tirer des conclusions sur le mécanisme d’une usine, car la standardisation des extraits ne porte que sur un ou deux composés. Les extraits pauvres en hyperforine sont ceux qui contiennent <1 mg/dose quotidienne d’hyperforine, par opposition aux produits riches en hyperforine (>1 mg/dose quotidienne) (tableau 1) (encadré).
Pharmacocinétique clinique et métabolisme
Dans une étude pharmacocinétique, un Tmax de 5-10h et une demi-vie d’élimination de 12-28h ont été mesurés pour l’hypéricine. Des mesures équivalentes ont également été obtenues pour la pseudohypéricine (1,5-4h ; 5-38h), l’hyperforine (3-8h ; 10-28h) et la quercitine (0,5-6h (avec 2 maxima dans cet intervalle !); 0,8-7h) [14]. Les études sur le rôle des enzymes participant au métabolisme de l’hyperforine et de l’hypéricine sont rares. L’hyperforine produit au moins 57 métabolites, dans la formation desquels les formes de CYP2C et de CYP3A jouent un rôle. Il inhibe le CYP2D6 et le CYP3A in vitro, mais on ne sait pas dans quelle mesure cette découverte est cliniquement pertinente, car après une administration prolongée, l’effet inducteur prévaut [15]. Ainsi, d’autres médicaments comme le ritonavir inhibent également le CYP3A4 dans un premier temps, avant que l’effet inducteur sur la même enzyme ne passe au premier plan.
Le CYP3A4 est responsable du métabolisme de près de la moitié des médicaments. Elle partage de nombreux substrats avec la glycoprotéine P (PgP ; ABCB1) qui, en tant que transporteur d’efflux, assure le transport des médicaments hors de la cellule. L’hyperforine contenue dans les extraits d’hypéricum se lie au récepteur Pregnan X (PXR), après quoi différentes étapes induisent le CYP3A4 et la PgP dans le foie, l’intestin et d’autres organes [9]. Les résultats selon lesquels l’hyperforine induit également de manière significative le CYP1A2, le CYP2C9 et le CYP2C19 sont moins prononcés et, surtout, pas encore acceptés.
Une induction du CYP3A4 et de la PgP peut se produire après seulement 3 jours de traitement. Elle atteint un maximum après environ 1 à 2 semaines, et peut être observée pendant une période similaire après l’interruption du traitement, c’est-à-dire qu’elle est tout de même réversible [16]! Ce facteur doit donc être pris en compte lors du passage d’une préparation riche en hyperforine à une préparation pauvre en hyperforine.
Interactions pharmacocinétiques des extraits d’Hypericum riches en hyperforine
Les extraits d’hypéricum riches en hyperforine favorisent donc le métabolisme de nombreux médicaments, comme cela a déjà été décrit avec l’exemple de la ciclosporine. Mais ils empêchent également le transport des substrats PgP, par exemple l’absorption de la digoxine de l’intestin vers le sang. Comme de nombreux stéroïdes sont métabolisés par le CYP3A4, il existe un risque d’hémorragie, voire de grossesse, en cas de contraception hormonale avec, par exemple, de l’éthinylestradiol ou du désogestrel lors d’un traitement simultané avec de l’Hypericum riche en hyperforine.
Par exemple, dans les CPS d’Hypericum Sandoz®, plusieurs comédications sont listées comme contre-indications, comme certains immunosuppresseurs (par ex. la ciclosporine, le tacrolimus ou le sirolimus), les médicaments anti-VIH appartenant au groupe des inhibiteurs de la transcriptase inverse non nucléosidique (p. ex. la névirapine) et des inhibiteurs de protéinase (p. ex. l’indinavir), certains cytostatiques (p. ex. l’imatinib, l’irinotécan) et les anticoagulants oraux de type coumarinique (tableau 2).
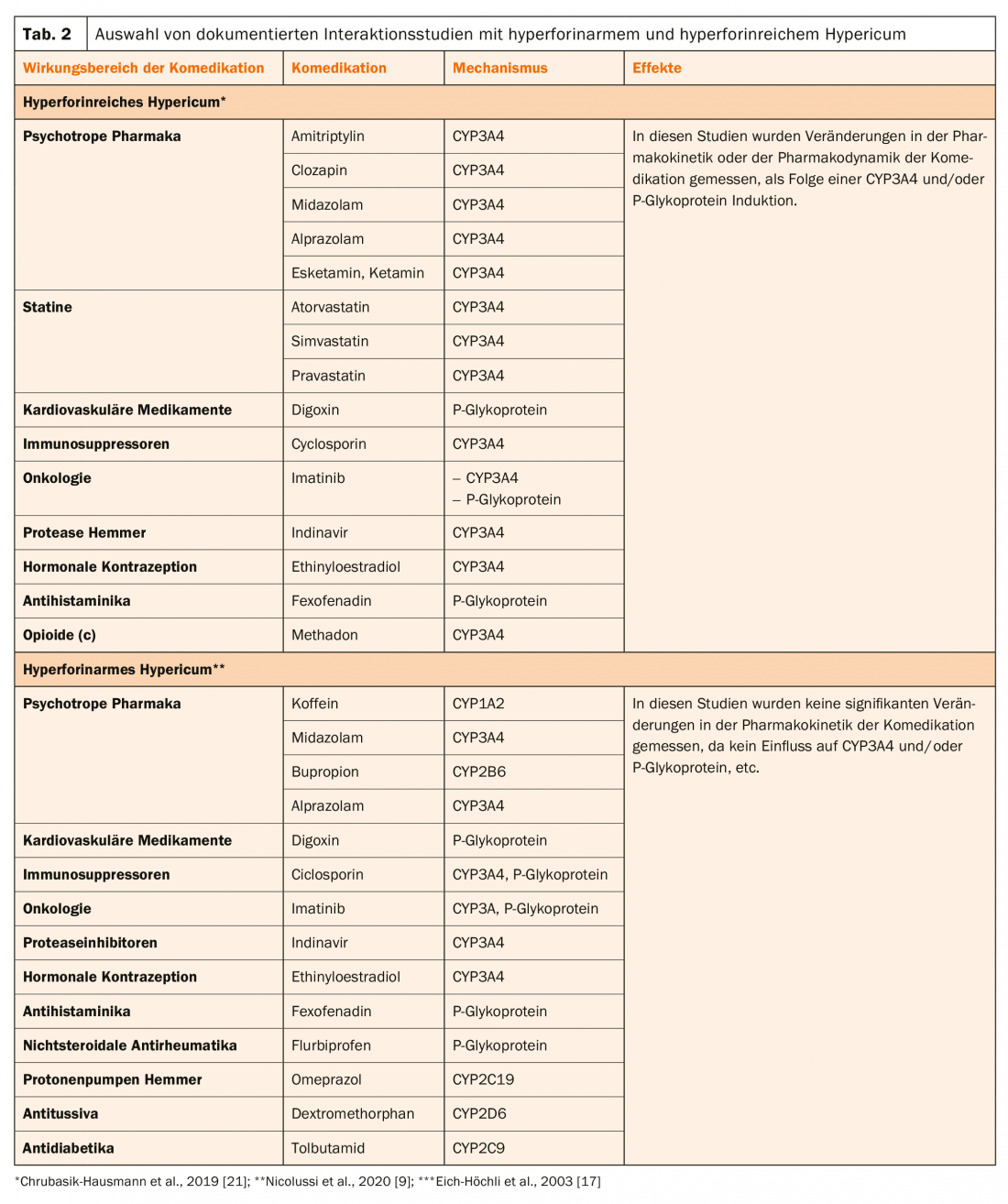
Chez les patients traités à la méthadone, l’ajout d’un traitement antidépresseur au millepertuis a entraîné non seulement une baisse de ses taux plasmatiques, mais aussi des symptômes de sevrage qui n’ont régressé qu’après l’interruption du traitement à l’hypericum [17].
L’eskétamine vient d’être introduite en Suisse comme antidépresseur d’appoint chez les patients résistants au traitement. Comme il est dégradé par le CYP3A4, il n’est pas surprenant que l’Hypericum riche en hyperforine réduise ses taux plasmatiques d’environ la moitié [18]. On peut supposer que ce ne sera pas le cas avec le millepertuis hyperforinaire.
Comparaison entre Hypericum pauvre en hyperforine et Hypericum riche en hyperforine
Les interactions pharmacocinétiques des extraits d’Hypericum ont été documentées dans de nombreuses études et revues [9,19–21].
Actuellement, il n’existe que l’extrait Ze 117, qui est pauvre en hyperforine selon les directives de l’EMA (encadré, tableau 1). Ainsi, après l’administration de ce produit, aucune diminution des taux plasmatiques de digoxine n’est observée chez les sujets traités avec ce médicament [22]. Le tableau 2 présente les études d’interaction avec Hypericum pauvre en hyperforine et riche en hyperforine. Il en ressort que ces extraits se distinguent clairement par leur action sur le CYP3A4 et/ou la glycoprotéine P. Il faut donc s’attendre à des risques plus élevés d’interactions pharmacocinétiques lors du traitement avec ces extraits, qui se manifestent principalement par une perte de l’effet clinique de la co-médication.
| L’EMA (European Medicines Agency) a autorisé en 2018 que les soi-disant SPC (Summary of Product Characteristics) ne doivent plus contenir un avertissement sur les interactions pharmacocinétiques lorsque, dans la dose journalière d’un extrait d’hypéricum, la teneur en hyperforine <est de 1 mg/jour, comme c’est le cas pour l’extrait Ze 117. La Suisse (Swissmedic) a été le premier pays à l’adopter. De tels avertissements ont déjà été supprimés dans les informations sur les médicaments concernant les extraits d’hypéricum Ze 117 Remotiv 250/500 et ReBalance 250/500, mais la procédure de réécriture est toujours en cours pour ReBalance Rx, raison pour laquelle ce produit n’est actuellement pas fourni par la société (en date de mars 2020). |
Conséquences pratiques et conclusions
L’offre de produits phytothérapeutiques Hypericum est déroutante. Par exemple, dans le cas de l’extrait Ze 117 hyperforinaire, trois produits sont proposés, qui sont identiques, à savoir Remotiv®, Rebalance®, Rebalance®Rx. Ces deux derniers produits sont remboursés par la caisse, tandis que Remotiv est en vente libre et n’est pas remboursé. Comme indiqué ci-dessus, Rebalance® RX (liste B) doit être prescrit par un médecin pour une dépression légère à modérée. Rebalance et Remotiv sont en revanche inscrits sur la liste D, et peuvent donc être délivrés par les pharmacies et les drogueries pour le traitement de l’humeur déprimée, de l’instabilité de l’humeur, etc. Or, l’information sur le médicament ne précise pas encore que Rebalance® RX est un produit contenant au maximum 0,1 mg d’hyperforine (par dose journalière), contrairement à Remotiv® et Rebalance® (encadré) . Il est donc important que la collaboration médecin – pharmacien – patient soit optimale, d’autant plus qu’il faut expliquer au patient qu’une automédication peut comporter des risques lors du passage d’un extrait Ze 117 à un autre produit, par exemple, d’autant plus que la majorité des autres produits sont riches en hyperforine. Lors du passage d’un extrait riche en hyperforine à un extrait pauvre en hyperformine, la dose de la comédication doit être ajustée avec précaution si nécessaire, et un drug monitoring thérapeutique est alors recommandé [23,24]. Sous réserve de certaines précautions, les extraits de millepertuis hyperforinés sont désormais considérés comme des médicaments efficaces et sûrs pour le traitement de la dépression légère à modérée. Il y a non seulement de nombreux patients qui préfèrent la phytothérapie, mais aussi des médecins qui souhaitent l’utiliser de manière ciblée, c’est-à-dire en fonction du patient.
Littérature :
- www.who.int/news-room/fact-sheets/detail/depression (dernière entrée le 15.4.2020)
- Holsboer-Trachsler E, Hättenschwiler J, Beck J, et al. : Le traitement aigu des épisodes dépressifs. Swiss med forum. 2016;16(35) : 716-725.
- Apaydin EA, Maher AR, Shanman R, et al : A systematic review of St. John’s wort for major depressive disorder. Syst Rev. 2016;5(1) : 148.
- Rahimi R, Nikfar S, Abdollahi M : Efficacité et tolérance de Hypericum perforatum dans le trouble dépressif majeur en comparaison avec les inhibiteurs sélectifs de la recapture de la sérotonine : une méta-analyse. Prog Neuropsychopharmacol Biol Psychiatry. 2009;33(1) : 118-127.
- Linde K, Berner MM, Kriston L : St John’s wort for major depression. Cochrane Database Syst Rev. 2008(4) : CD000448.
- Anheyer D, Haller H, Klose P, et al. : Médicaments à base de plantes pour les troubles psychiatriques. Médecin spécialiste des maladies nerveuses. 2018;89(9) : 1009-1013.
- Ruschitzka F, Meier PJ, Turina M, et al : Rejet aigu de transplantation cardiaque dû à la maladie de Saint John. Lancet . 2000;355 : 548-549.
- Dumbreck S, Flynn A, Nairn M, et al : Drug-disease and drug-drug interactions : systematic examination of recommendations in 12 UK national clinical guidelines. BMJ. 2015;350 : h949.
- Nicolussi S, Drewe J, Butterweck V, et al : Clinical relevance of St. John’s wort drug interactions revisited. Br J Pharmacol. 2020;177(6) : 1212-1226.
- Henderson L, Yue QY, Bergquist C, et al. : St John’s wort (Hypericum perforatum) : drug interactions and clinical outcomes. British Journal of Clinical Pharmacology. 2002;54(4) : 349-356.
- Gurley BJ, Swain A, Hubbard MA, et al : Évaluation clinique des interactions plantes-médicaments médiées par le CYP2D6 chez l’homme : effets du chardon-Marie, du cohosh noir, de la sauge dorée, du kava kava, de l’herbe de Saint-Jean et de l’échinacée. Mol Nutr Food Res. 2008;52(7) : 755-763.
- Muller WE : Current St John’s wort research from mode of action to clinical efficacy. Pharmacol Res. 2003;47(2) : 101-109.
- Leuner K, Kazanski V, Muller M, et al : Hyperforine – un composant clé de l’herbe de Saint-Jean active spécifiquement les canaux TRPC6. FASEB J. 2007;21(14) : 4101-4111.
- Schulz HU, Schurer M, Bassler D, Weiser D : Investigation of the bioavailability of hypericin, pseudohypericin, hyperforin and the flavonoids quercetin and isorhamnetin following single and multiple oral dosing of a hypericum extract containing tablet. Recherche sur les médicaments. 2005;55(1) : 15-22.
- Hokkanen J, Tolonen A, Mattila S, Turpeinen M : Métabolisme de l’hyperforine, le composant actif de l’herbe de Saint-Jean, dans les microsomes hépatiques humains. Eur J Pharm Sci. 2011;42(3) : 273-284.
- Johne A, Schmider J, Brockmöller J, et al. : Decreased Plasma Levels of Amitriptyline and Its Metabolites on Comedication With an Extract From St. John’s Wort ( Hypericum perforatum ). Journal of Clinical Psychopharmacology. 2002;22(1) : 46-54.
- Eich-Höchli D, Oppliger R, Powell Golay K, et al. : Methadone maintenance treatment and St. John’s wort – A case report. Pharmacopsychiatrie. 2003;36 : 35-37.
- Peltoniemi MA, Saari TI, Hagelberg NM, et al : St John’s wort greatly decreases the plasma concentrations of oral S-ketamine. Fundam Clin Pharmacol. 2012;26(6) : 743-750.
- Soleymani S, Bahramsoltani R, Rahimi R, Abdollahi M : Risques cliniques de la co-administration du mot de St John (Hypericum perforatum). Expert Opin Drug Metab Toxicol. 2017;13(10) : 1047-1062.
- Zahner C, Kruttschnitt E, Drewe J, et al. : No clinically relevant interactions of st. john’s wort extract ze 117 low in hyperforin with cytochrome p450 enzymes and p-glycoprotein. Pharmacologie clinique et thérapeutique. 2019;106(2) : 432-440.
- Chrubasik-Hausmann S, Vlachojannis J, McLachlan AJ : Comprendre les interactions médicamenteuses avec le St John’s wort (Hypericum perforatum L.) : impact du contenu en hyperforine. J Pharm Pharmacol. 2019;71(1) : 129-138.
- Mueller SC, Uehleke B, Woehling H, et al : Effect of St John’s wort dose and preparations on the pharmacokinetics of digoxin. Clin Pharmacol Ther. 2004;75(6) : 546-557.
- Hiemke C, Bergemann N, Clement HW, et al : Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology : Update 2017. Pharmacopsychiatry. 2018 ; 51(1/2) : 9-62.
- Klein HG, Haen E : Pharmacogénétique et surveillance thérapeutique des médicaments. Berlin, Boston : De Gruyter ; 2018. 465 p.
InFo NEUROLOGIE & PSYCHIATRIE 2020 ; 18(3) : 20-23
PRATIQUE DU MÉDECIN DE FAMILLE 2020 ; 15(6) : 38-41