La néphroprotection comprend des interventions qui ralentissent la baisse du DFG au fil du temps, retardant ainsi le stade final de l’insuffisance rénale. L’intervention la plus récente consiste à utiliser des inhibiteurs de SGLT2 chez les patients atteints de néphropathie diabétique.
L’insuffisance rénale chronique peut être diagnostiquée de deux manières :
- Preuve d’une fonction rénale réduite avec un débit de filtration glomérulaire (DFGe) calculé inférieur à 60 ml/min, qui persiste pendant au moins trois mois.
- Preuve d’une atteinte rénale chronique (albuminurie, hématurie, preuve par l’imagerie comme les reins polykystiques) qui persiste depuis au moins trois mois – indépendamment du DFGe.
Le diagnostic d’insuffisance rénale chronique peut donc être posé en pratique à l’aide de trois examens simples : Dosage de la créatinine (calculer le DFGe à partir de ce dosage), bilan urinaire avec sédimentation et protéinurie (urine spot) et échographie rénale.
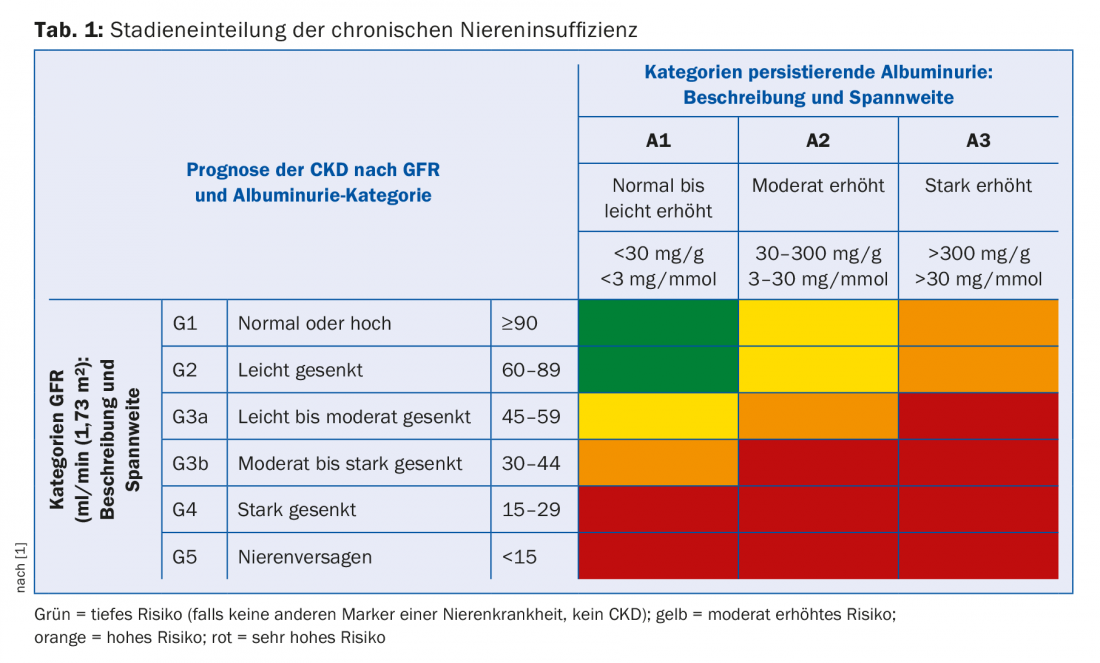
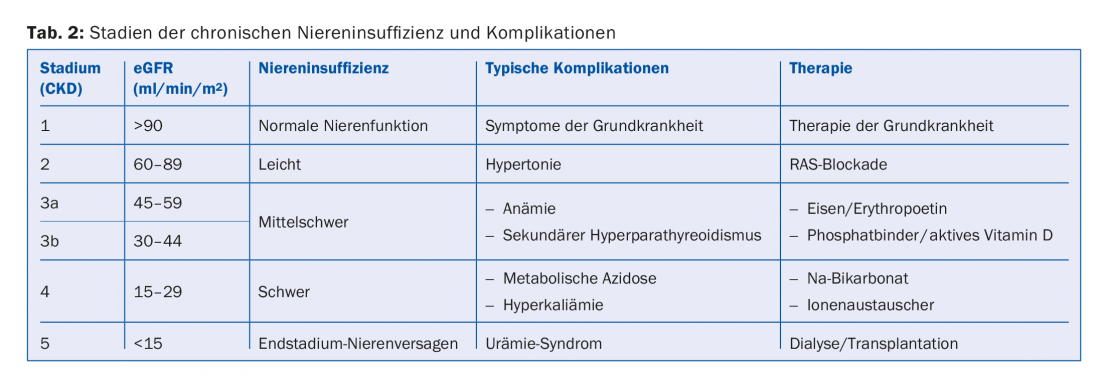
La classification de l’insuffisance rénale chronique dépend de l’importance de l’altération de la fonction rénale et de l’albuminurie. Le DFGe et l’albuminurie sont des facteurs de risque indépendants à la fois pour la mortalité cardiovasculaire et pour le risque de développer une insuffisance rénale terminale [1]. La classification en stades donne donc des indications sur la fréquence de contrôle de ces patients et sur le degré d’agressivité de leur traitement en termes de risques cardiovasculaires (tab. 1). En outre, l’ampleur de l’altération de la fonction rénale donne des indications sur les complications secondaires auxquelles il faut s’attendre (tab. 2). Celles-ci doivent être activement recherchées et, si nécessaire, traitées.
Historique
L’insuffisance rénale chronique est progressive au fil des ans, que la maladie sous-jacente soit encore active ou non. Ce phénomène est expliqué par ce que l’on appelle “l’hypothèse de Brenner”, selon laquelle, avec la perte d’un grand nombre de néphrons, les néphrons restants compensent au moins partiellement la perte de fonction, ce qui entraîne une hyperfiltration. Cette hyperfiltration prolongée entraîne des lésions des néphrons encore intacts. L’histologie révèle d’abord une hypertrophie glomérulaire, puis une glomérulosclérose croissante, qui se traduit par une perte progressive de fonction et l’apparition d’une albuminurie.
La progression de l’insuffisance rénale chronique peut être décrite individuellement par patient à l’aide de ce que l’on appelle la courbe de Mitch [2]. Si l’on reporte l’eGFR ou la valeur 1/créatinine en fonction du temps, on obtient une courbe linéaire décroissante. Cette courbe permet d’estimer le risque de développer une insuffisance rénale terminale pour un patient donné (figure 1A). Cela facilite le dialogue avec le patient et permet de prendre à temps les dispositions nécessaires à la mise en place d’une procédure de remplacement rénal.
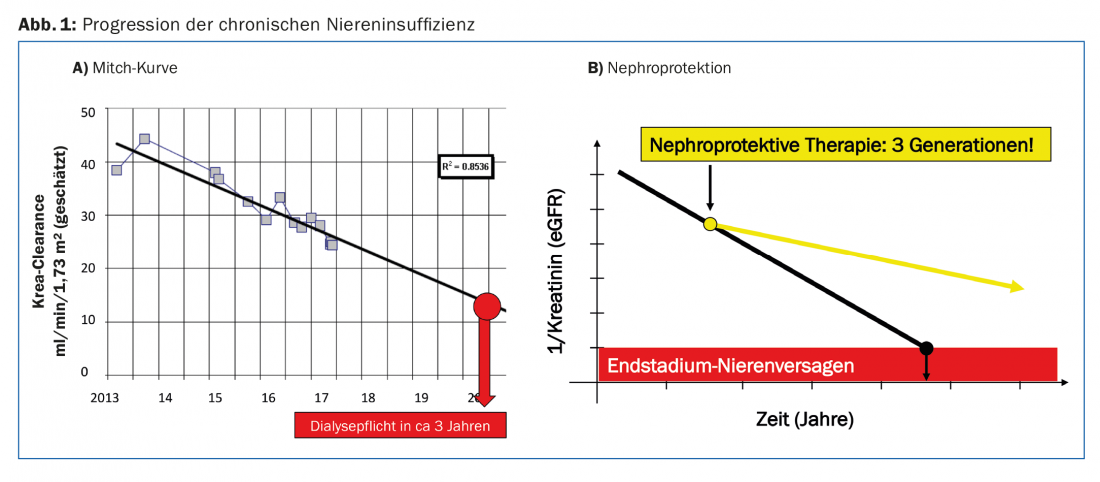
En tant que médecins, nous aimerions pouvoir influencer favorablement la progression de l’insuffisance rénale chronique. Par “mesures de néphroprotection”, nous entendons toutes les interventions qui ralentissent la baisse du DFGe au fil du temps. Il est vrai qu’il n’existe à ce jour aucune intervention permettant d’arrêter totalement ces déchets. Mais si l’on parvient à aplanir ne serait-ce qu’un peu la chute de la courbe de Mitch, le patient peut gagner plusieurs années de temps sans dialyse (Fig. 1B).
Néphroprotection
Première génération – blocage du système rénine-angiotensine : le système rénine-angiotensine (SRA) joue un rôle crucial dans la régulation du flux sanguin rénal et donc de la perfusion des différents glomérules. L’angiotensine affecte directement le tonus du vaisseau efférent. Une augmentation de l’angiotensine entraîne une constriction du vas efférent et donc une augmentation de la pression de filtration dans le lit capillaire glomérulaire. Cela permet d’une part l’autorégulation de la filtration glomérulaire sur une large gamme de variations de la pression artérielle. D’autre part, il entraîne également l’hyperfiltration mentionnée ci-dessus dans le cadre de l’hypothèse Brenner. Le blocage du SRA par des inhibiteurs de l’ECA, des bloqueurs du récepteur de l’angiotensine de type 1 (sartans) ou des inhibiteurs de la rénine entraîne une dilatation du vaisseau efférent au niveau du glomérule. Cela permet de réduire la pression de perfusion glomérulaire et de préserver le lit capillaire glomérulaire. Mais en même temps, le taux de filtration glomérulaire par néphron et au total diminue. Par conséquent, le début d’un blocage du SRA chez un patient insuffisant rénal entraîne toujours une augmentation de la créatinine. Une telle hausse peut être tolérée jusqu’à 25%, à condition qu’elle reste stable à ce niveau par la suite. L’augmentation de la créatinine est fonctionnelle et constitue la preuve que la pression de perfusion glomérulaire a effectivement été réduite. Si le blocage du SRA est à nouveau arrêté, la créatinine diminue à nouveau de la même valeur. Si la créatinine ne se stabilise pas après l’introduction du blocage du SRA, il faut l’arrêter à nouveau et rechercher une sténose de l’artère rénale.
Plusieurs études randomisées menées dans les années 1990 ont montré que le blocage du SRA pouvait freiner la progression de l’insuffisance rénale chronique, que ce soit dans le cadre d’une néphropathie diabétique ou non diabétique [3]. Le blocage du SRA est donc aujourd’hui la base de toute intervention néphroprotectrice et doit être rendu d’autant plus agressif que la protéinurie est élevée. Les substances individuelles doivent être dosées au maximum et le double blocage du SRA doit être strictement évité [4].
Deuxième génération – Correction de l’acidose métabolique : le rein est l’organe le plus important pour l’élimination des acides fixes, et ceux-ci s’accumulent au fur et à mesure que la fonction rénale est réduite. L’insuffisance rénale chronique est donc généralement associée à l’apparition d’une acidose métabolique, en particulier dans les stades avancés à partir de l’IRC G3b.
L’acidose métabolique a plusieurs effets défavorables. Elle affecte la santé des os et favorise l’apparition d’une hyperkaliémie, qui augmente à son tour le risque d’arythmie cardiaque. Cependant, on n’a longtemps pas su si l’acidose métabolique influençait elle-même la progression de l’insuffisance rénale chronique. Dans les années 2000, plusieurs études randomisées ont été publiées pour évaluer l’impact du traitement de l’acidose métabolique par le bicarbonate de sodium sur la progression de l’insuffisance rénale chronique. À la surprise de nombreux néphrologues, il a été démontré qu’à différents stades de l’insuffisance rénale chronique (IRC G2, G3 et G4), cette mesure simple permettait de ralentir la progression et de retarder l’apparition de l’insuffisance rénale terminale [5]. Ainsi, l’une des recommandations générales actuelles est de traiter l’acidose métabolique avec un bicarbonate sérique <20 mmol/l avec du bicarbonate de sodium. L’hyperkaliémie s’en trouve également améliorée, ce qui permet de maintenir un blocage du SRA aussi efficace que possible.
Les limites de cette intervention sont souvent la tolérance (le bicarbonate de sodium provoque des ballonnements), le nombre élevé de comprimés (pour atteindre un bicarbonate sérique >20 mmol/l, il faut parfois six à huit comprimés par jour) et la charge en sodium, qui peut entraîner une augmentation des œdèmes et/ou de la tension artérielle.
Troisième génération – blocage du co-transporteur sodium/glucose SGLT2 dans le tubule proximal : Ces dernières années, un nouveau groupe d’antidiabétiques oraux a été testé dans plusieurs études randomisées : Il s’agit d’inhibiteurs du co-transporteur sodium/glucose dans le tubule proximal (SGLT2, “sodium-glucose transporter 2”). Ces médicaments induisent une glucosurie. Cela permet d’obtenir une meilleure HbA1c et un bilan calorique négatif, ce qui entraîne une perte de poids nette. Cependant, le blocage de SGLT2 entraîne également une natriurèse. Ces substances constituent donc une nouvelle classe de diurétiques qui, contrairement aux diurétiques de l’anse et aux thiazides, n’agissent pas dans le néphron distal, mais dans le tubule proximal.
Jusqu’à présent, les inhibiteurs de SGLT2 ont surtout été testés chez les patients atteints de diabète de type 2 et présentant un profil de risque cardiovasculaire élevé (souvent en prophylaxie secondaire). Un bénéfice hautement significatif sur la mortalité totale (empagliflozine) et sur la mortalité cardiovasculaire (empagliflozine, canagliflozine) a été démontré. L’effet diurétique a également permis de réduire significativement les réhospitalisations dues à une insuffisance cardiaque décompensée [6,7].
Des études de suivi ont également montré un effet positif hautement significatif sur les critères d’évaluation rénaux durs (nouvelle apparition d’une macroalbuminurie, doublement de la créatinine sérique, apparition d’une insuffisance rénale terminale). L’effet est du même ordre de grandeur que le blocage du SRA dans un groupe de patients dont la plupart sont déjà traités par des bloqueurs du SRA [8] ! Le mécanisme de la néphroprotection n’est pas encore élucidé en détail. On postule toutefois un effet via la macula densa avec dilatation du vas afferens. La même augmentation fonctionnelle de la créatinine au début du traitement suivie d’une stabilisation de la fonction rénale qu’avec le blocage du SRA a été démontrée [9].
Deux effets secondaires cliniques sont à noter pour cette classe de substances : Les infections urogénitales, fréquentes mais bénignes, sont faciles à traiter. L’acidocétose diabétique euglycémique, qui peut survenir en cas de déficit en insuline et de longues périodes de jeûne, constitue une complication rare mais grave. Par conséquent, dans les situations cliniques énumérées dans le tableau 3, les inhibiteurs de SGLT2 ne doivent pas être utilisés ou doivent être utilisés avec beaucoup de prudence ou être temporairement interrompus.

Conclusion
Après le blocage du SRA et le traitement de l’acidose métabolique, nous disposons depuis deux ans d’une troisième mesure néphroprotectrice : l’utilisation d’inhibiteurs du SGLT2. Pour le moment, celle-ci n’est autorisée que chez les patients atteints de néphropathie diabétique (tableau 4). Comme le mécanisme de néphroprotection n’a très probablement rien à voir avec l’influence sur le métabolisme du glucose, mais avec l’effet diurétique de ces substances, on peut supposer qu’elles seraient également efficaces en cas de néphropathie non diabétique. Les études correspondantes sont actuellement en cours.

Messages Take-Home
- L’insuffisance rénale chronique a une évolution progressive qui peut être décrite par la courbe de Mitch.
- Par mesures néphroprotectrices, nous entendons des interventions qui ralentissent la chute du DFG au fil du temps et peuvent ainsi retarder le stade final de l’insuffisance rénale.
- La base de toute néphroprotection est l’utilisation d’inhibiteurs du système rénine-angiotensine (inhibiteurs de l’ECA, bloqueurs des récepteurs AT1, inhibiteurs de la rénine). Ils doivent être dosés en fonction de leur tolérance, mais ne doivent pas être combinés.
- Le traitement de l’acidose métabolique par le bicarbonate de sodium est néphroprotecteur et doit être initié lorsque le bicarbonate sérique <20 mmol/l.
- L’intervention la plus récente consiste à utiliser des inhibiteurs de SGLT2 chez les patients atteints de néphropathie diabétique. Ils ont un effet diurétique sur le tubule proximal et sont cardio- et néphroprotecteurs.
Littérature :
- Stevens PE, Levin A : Evaluation and management of chronic kidney disease : synopsis of the kidney disease : improving global outcomes 2012 clinical practice guideline. Ann Intern Med 2013 ; 158 : 825-830.
- Mitch WE, et al : A simple method of estimating progression of chronic renal failure. Lancet 1976 ; 2 : 1326-1328.
- Lewis EJ, et al. : L’effet de l’inhibition de l’enzyme de conversion de l’angiotensine sur la néphropathie diabétique. Le groupe d’étude collaborative. N Engl J Med 1993 ; 329 : 1456-1462.
- Luft FC : Perspective sur la thérapie de blocage du RAS en combinaison : off-TARGET, dis-CORD, MAP-to-nowhere, low ALTITUDE, et NEPHRON-D. Am J Nephrol 2014 ; 39 : 46-49.
- de Brito-Ashurst I, et al : La supplémentation en bicarbonate ralentit la progression de l’IRC et améliore l’état nutritionnel. J Am Soc Nephrol 2009 ; 20 : 2075-2084.
- Zinman B, et al : Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015 ; 373 : 2117-2128.
- Neal B, et al : Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med 2017 ; 377 : 644-657.
- Wanner C, et al : Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016 ; 375 : 323-334.
- Anders HJ, et al : Protection du néphron dans la maladie rénale diabétique. N Engl J Med 2016 ; 375 : 2096-2098.
PRATIQUE DU MÉDECIN DE FAMILLE 2018 ; 13(4) : 22-25
CARDIOVASC 2019 ; 18(5) : 6-9