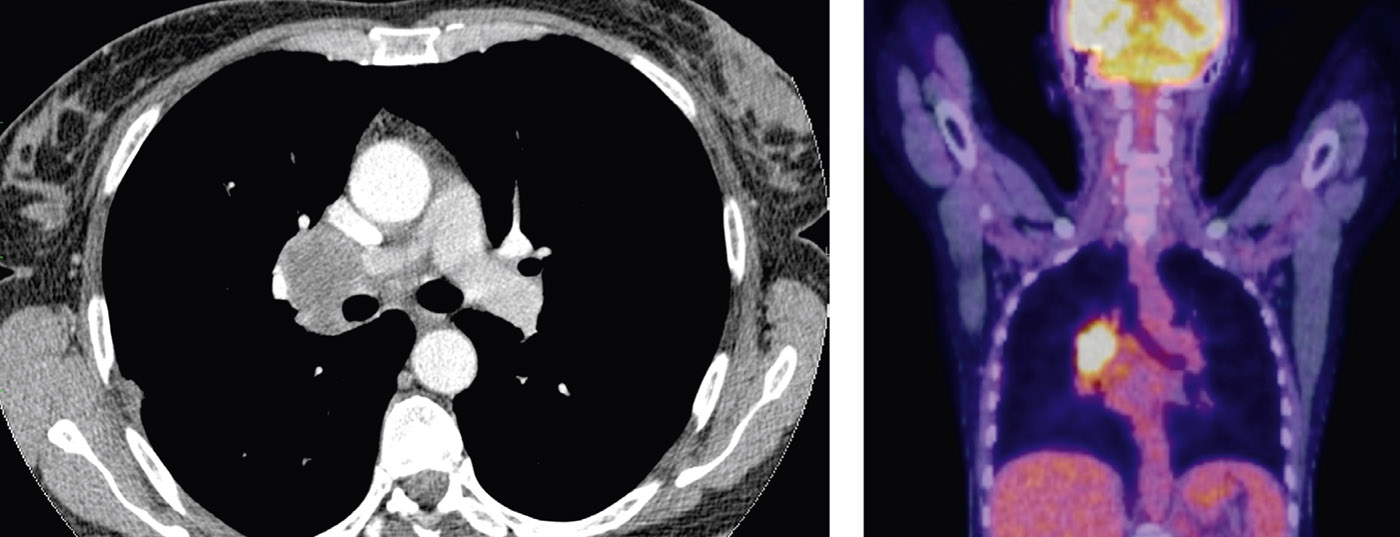
Le choix des modalités de traitement du cancer du poumon dépend de plusieurs facteurs. Un staging précis, l’évaluation de l’opérabilité et la connaissance des facteurs pronostiques tels que le nombre de stations ganglionnaires atteintes et le grading sont décisifs. Le traitement standard des stades précoces est la chirurgie primaire. Chez les patients à un stade avancé mais encore opérable, une chimiothérapie néoadjuvante peut améliorer la résécabilité. Pour augmenter les taux de survie au cancer du poumon, des programmes de dépistage devraient être mis en place chez les personnes à risque.
Avec un taux de survie actuel à 5 ans de 15,1%, le cancer du poumon reste une forme de cancer avec une mortalité très élevée. Malgré l’utilisation massive de ressources et l’amélioration de toutes les modalités de traitement disponibles – y compris les thérapies anticorps de pointe – la mortalité est restée inchangée depuis 30 ans [1]. La raison de cette évolution insatisfaisante est le fait que le cancer du poumon n’est généralement diagnostiqué que lorsque la maladie est déjà à un stade avancé.
Le cancer du poumon serait tout à fait curable, notamment grâce aux possibilités de traitement chirurgical, mais au moment du diagnostic, 75% des patients concernés ne peuvent déjà plus être traités de manière curative. Cette situation de départ défavorable ne s’améliorera pour les patients que si un dépistage systématique du groupe à risque est effectué à l’aide d’un scanner à faible dose selon un algorithme bien défini et si ce dépistage est également remboursé par les caisses d’assurance maladie. Dans ce cas, le pronostic pourrait effectivement être amélioré, comme cela a été documenté de manière scientifiquement impressionnante [2], et la mortalité par cancer du poumon diminuerait de manière continue et significative. Le rôle de la chirurgie va évoluer avec l’émergence espérée des programmes de dépistage, et les méthodes chirurgicales peu invasives et les résections limitées vont augmenter en conséquence [3].
Staging
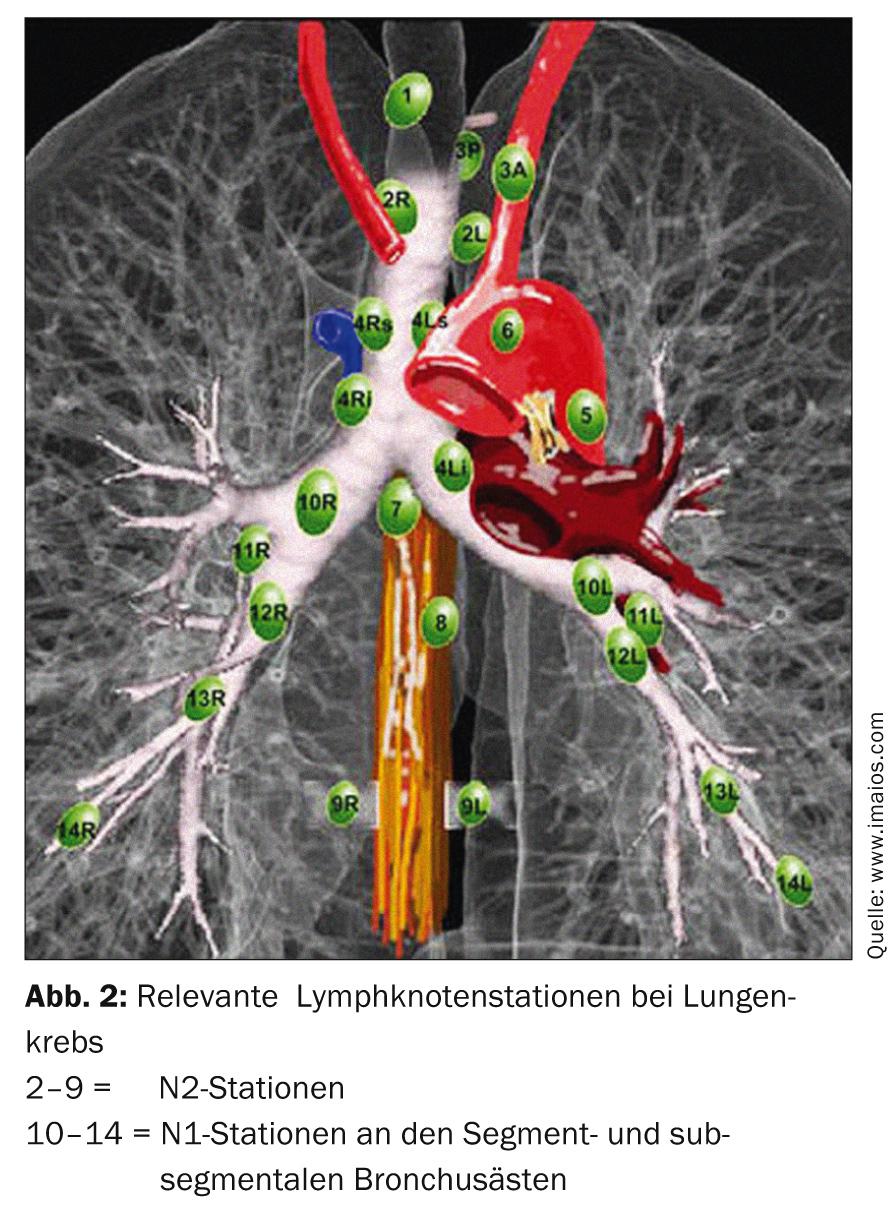
La classification des stades des cancers bronchiques non à petites cellules (NSCLC) est basée sur la classification TNM et la classification des stades cliniques de l’AJCC [4]. La stadification se fait à la suite du staging et est très pertinente pour le choix des modalités de traitement lors de la réunion obligatoire du tumor board interdisciplinaire. Un diagnostic correct du NSCLC comprend une bronchoscopie avec biopsie ainsi qu’un scanner et un PET. La détermination du stade exact du ganglion lymphatique (stade N) est très pertinente pour la planification du traitement chirurgical. La TEP a ici un grand poids, car elle fournit des résultats très fiables en termes de valeur prédictive négative (VPN). Les ganglions médiastinaux positifs à la TEP doivent toutefois être documentés histologiquement (par ex. par échographie endobronchique, biopsie transbronchique ou médiastinoscopie), car la TEP est insuffisante en termes de valeur prédictive positive (VPP). Cela vaut également pour le foyer tumoral primaire dans le parenchyme pulmonaire. Si aucune histologie transbronchique ou au moins une cytologie de lavage ne documente la malignité, il est recommandé de procéder à une ponction transthoracique ou à une résection thoracoscopique du wedge pour compléter le staging [5–7].
Opérabilité
La majorité des patients atteints de NSCLC sont des fumeurs actifs ou d’anciens fumeurs avec une comorbidité pulmonaire et cardiaque correspondante (BPCO, emphysème, etc.). Un staging dit fonctionnel est donc un élément important avant de poser l’indication d’une intervention chirurgicale. Les examens clés pour cela sont l’épreuve fonctionnelle respiratoire, l’ergométrie et, dans les cas critiques, la spiroergométrie combinée à la scintigraphie de perfusion. Il est recommandé de suivre les directives de l’ESMO [8]. En pratique, le VEMS reste une bonne référence, puisqu’il doit être au minimum d’environ 1 litre après l’opération.
Facteurs pronostiques pour la pose d’indications
La planification d’une intervention chirurgicale pour un NSCLC est très complexe et exige des connaissances détaillées en raison de la grande diversité des manifestations tumorales. Il existe des règles méthodologiques claires pour l’indication et l’objectif est de fournir au patient une solution aussi personnalisée que possible ou un traitement adapté. de proposer un traitement chirurgical individualisé. Alors que pour les stades précoces (T1-2, N0, M0 ou AJCC IA-IB), l’accent est mis sur les voies de traitement peu invasives économisant le parenchyme, y compris la lymphadénectomie de staging, pour les stades avancés encore traitables par chirurgie (T1-4, N1-2, M0, ou AJCC IIA-IIIB), il s’agit d’optimiser les traitements multimodaux oncologiques, radiothérapeutiques et chirurgicaux. Le chirurgien doit connaître en détail les facteurs pronostiques importants et être en mesure d’adapter le traitement, y compris en peropératoire, en recourant le plus souvent possible à des diagnostics histopathologiques rapides. Dans l’état actuel des connaissances, les facteurs suivants sont des facteurs pronostiques indépendants pour le traitement chirurgical du NSCLC, pondérés par leur importance [9–12]:
- Nombre de stations de ganglions lymphatiques atteintes
- Grading et différenciation histologique
- Invasion de la lymphangie dans l’histologie définitive
- Nombre total de ganglions lymphatiques atteints
- Réponse au traitement néoadjuvant
- Sexe et âge du patient
- Taille de la tumeur
Traitement chirurgical des stades précoces
Les tumeurs de stade T1-T2 sans atteinte des ganglions lymphatiques sont considérées comme des stades précoces et ont un bon pronostic en conséquence (figure 1) .
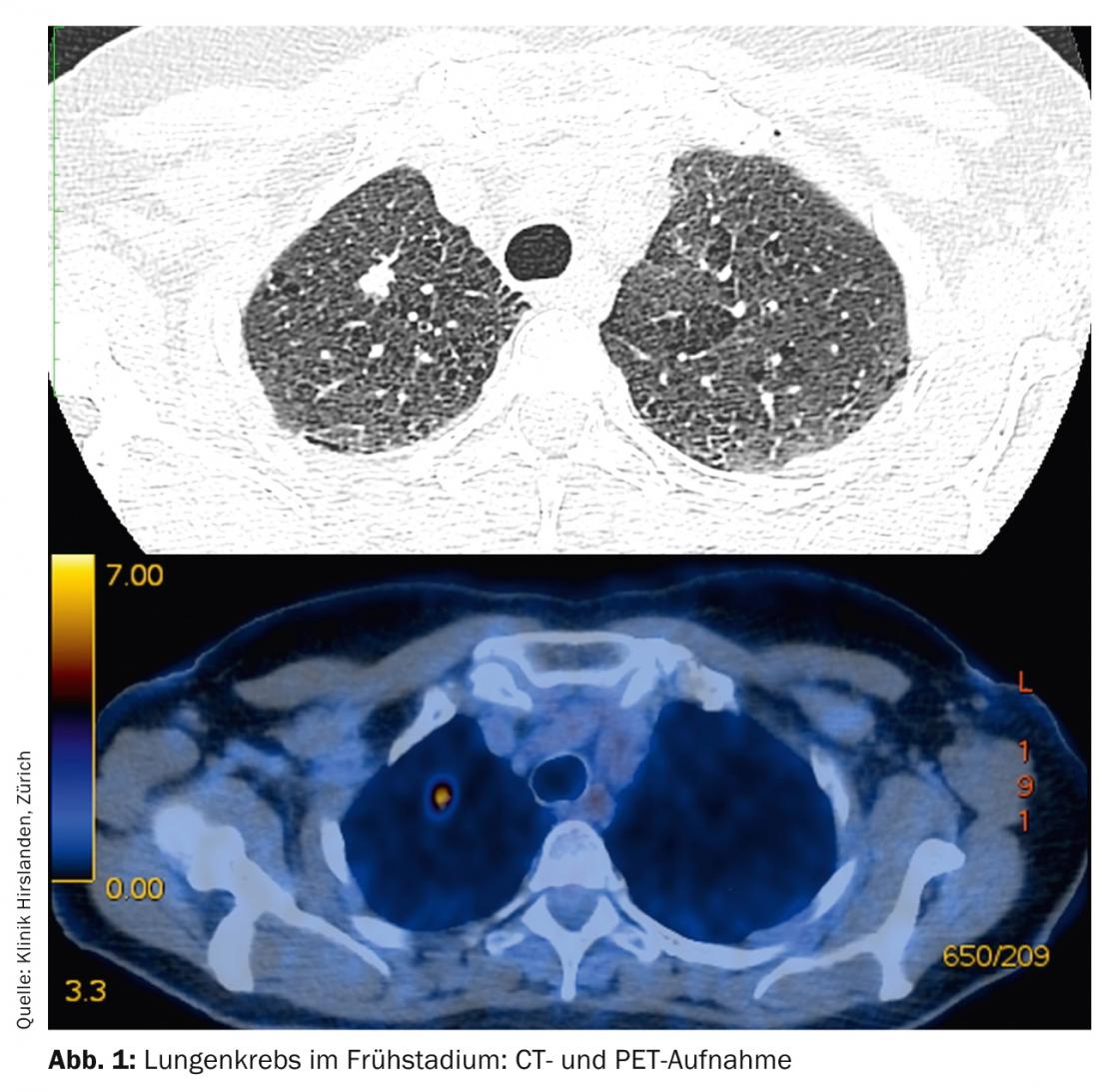
Le traitement standard est la thérapie chirurgicale primaire. Selon l’emplacement de la tumeur dans le lobe pulmonaire, une résection segmentaire ou une lobectomie peut être nécessaire. Il est obligatoire de vérifier le stade N0 par un échantillonnage systématique des ganglions lymphatiques dans le médiastin (fig. 2). En cas de changement de stade peropératoire (atteinte surprenante de N1 ou N2), il est nécessaire d’adapter immédiatement le traitement chirurgical par lymphadénectomie radicale et lobectomie de complétion. L’âge et le statut de performance du patient doivent également être des critères essentiels dans cette décision. Si un patient a subi une résection segmentaire et qu’il s’avère en postopératoire qu’il existe de nombreux facteurs de risque pronostiques (lymphangioinvasion, atteinte ganglionnaire sous-segmentaire, mauvais grading, adénocarcinome chez l’homme, etc.), une lobectomie de complétion au sens d’une deuxième intervention est nécessaire et une chimiothérapie additive doit être discutée en tumorboard [13].
Traitement chirurgical des stades avancés
Tous les stades T avec atteinte N1 ou N2 sont des stades avancés mais encore opérables (IIA-IIIB). Ce groupe de patients présente des morphologies très différentes, ce qui rend la planification du traitement chirurgical très complexe. Il y a deux questions cruciales pour l’orientation des approches thérapeutiques disponibles :
- Y a-t-il un gros bourrelet tumoral ou un bourrelet de ganglions lymphatiques au centre ou à la périphérie ? proche de la division de la bronche principale ou à proximité d’autres organes médiastinaux (aorte, cœur) ?
- Plusieurs stations de ganglions lymphatiques N2 sont-elles atteintes ? Et si oui, lesquelles par rapport au lobe atteint par la tumeur ?
Si la réponse à l’une de ces questions est “oui”, la question du traitement néoadjuvant préalable se pose. Si la réponse à ces deux questions est négative, le patient sera traité en premier lieu par une intervention chirurgicale. L’objectif du traitement néoadjuvant préalable est d’améliorer la résécabilité et d’identifier les patients dont le pronostic est intact. Après généralement trois cycles de chimiothérapie (par exemple avec du cisplatine et du docétaxel), un restaging est effectué. Si la réponse est bonne, la chirurgie est l’étape suivante. En cas d’absence de réponse ou même de progression de la maladie, le patient ne se qualifie pas pour le traitement chirurgical ; il continuera à recevoir une chimiothérapie ou une radiothérapie en intention palliative [14,15].
Étude de cas 1 : Stade IIIA, non bulky, T3 N1
Chez le patient concerné, l’imagerie montre un adénocarcinome partant de la lingula, avec une atteinte des ganglions lymphatiques N1 et deux tumeurs dans le lobe (T3) (Fig. 3).

Le staging préopératoire par TEP et échographie endobrachiale (EBUS) des stations N2 ne révèle aucune trace de tumeur. Ainsi, le patient se qualifie pour une thérapie chirurgicale directe. Une résection thoracoscopique du lobe supérieur (lobectomie VATS peu invasive [VATS thoracic surgery]) (fig. 4) avec lymphadénectomie médiastinale étendue est réalisée. En peropératoire, la résection R0 est confirmée par un diagnostic histopathologique rapide des marges de résection et des ganglions lymphatiques N2. Le stade définitif de la tumeur TNM de la pathologie est pT3, pN1 (3 sur 34), L1, V1, Pn0, R0. En raison de la situation des ganglions lymphatiques, une chimiothérapie adjuvante est recommandée.
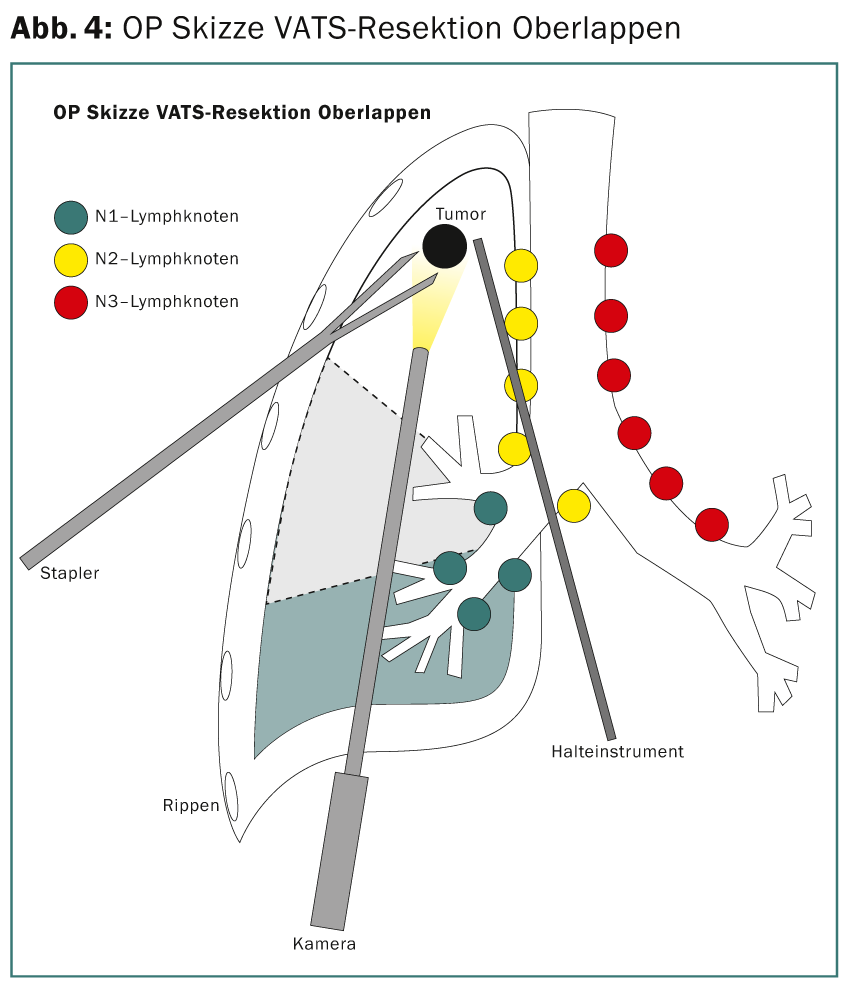
Étude de cas 2 : Stade IIIA, étendu (bulky), T2 N2
L’imagerie montre un adénocarcinome, partant du lobe supérieur droit, avec atteinte des ganglions lymphatiques du groupe N2 4R (fig. 5).
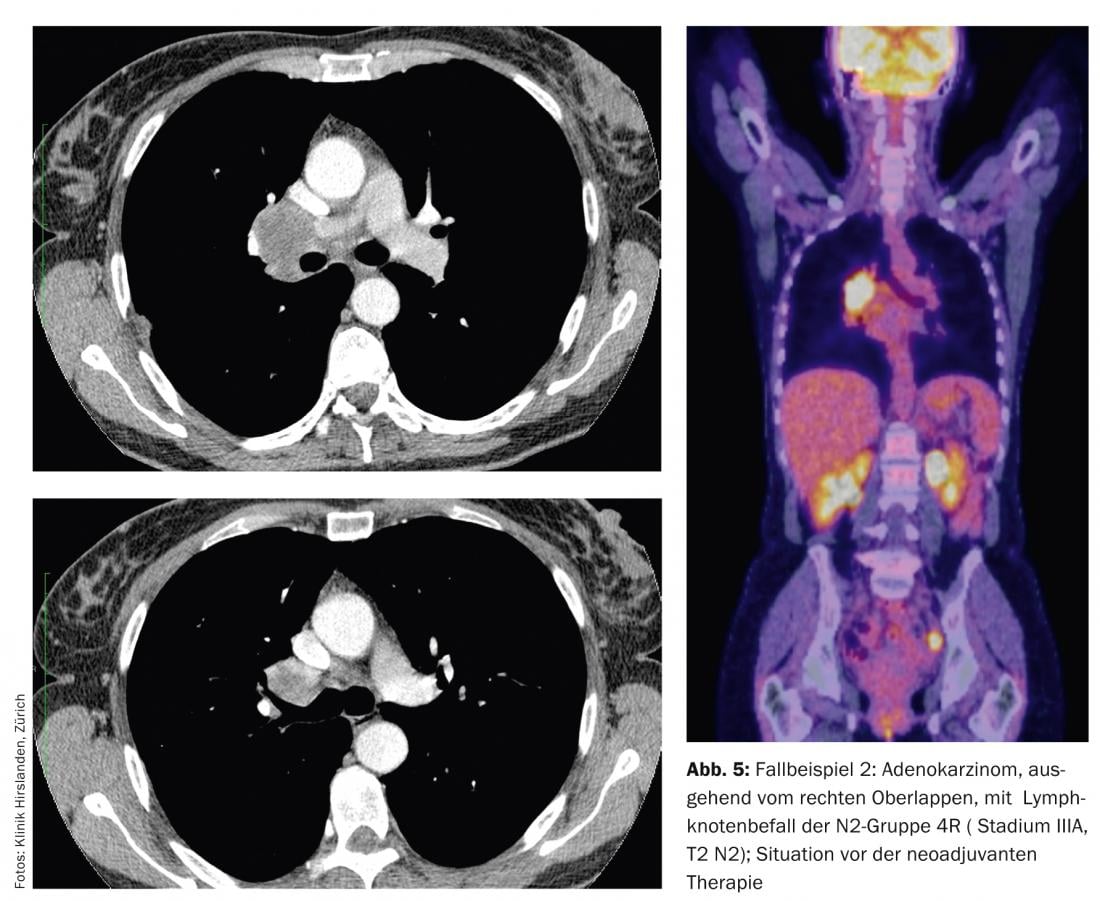
Cette infestation est très volumineuse et s’étend jusqu’à la carène principale ou au-delà. Une chirurgie radicale primaire ne peut pas être réalisée dans cette zone. La tumeur primaire n’est pas bulky et, avec environ 5 cm, elle est au stade T2. Le staging préopératoire avec TEP et EBUS des stations N2 ne révèle aucune trace de tumeur dans d’autres stations N2 ou N3 controlatérales. Néanmoins, ce patient est un candidat pour un prétraitement néoadjuvant afin de réduire l’étendue de la lésion et de sélectionner le patient pour la chirurgie. Après trois cycles de chimiothérapie, le nouveau scanner montre une très bonne réponse (down-staging) et aucune nouvelle manifestation tumorale en termes d’hypertrophie de nouveaux ganglions lymphatiques, de foyers ronds ou de métastases (fig. 6) .

Le patient est donc désormais éligible pour un traitement chirurgical secondaire. Une résection ouverte du lobe supérieur avec résection en bloc de la bronche principale et reconstruction bronchoplastique (Fig. 7) entraîne une résection R0 avec confirmation peropératoire par diagnostic histopathologique rapide des marges de coupe et des ganglions lymphatiques médiastinaux radicalement évacués. Le stade définitif de la tumeur TNM de la pathologie est ypT1a, ypN0 (0 sur 29), L0, V0, Pn0, R0 (“y” désigne l’état après traitement néoadjuvant préalable). En raison de l’extension péribronchique primaire très étendue, une irradiation consolidante du médiastin est recommandée dans ce cas pour compléter le concept de traitement multimodal.

Perspectives
Le traitement des stades avancés du NSCLC est un défi interdisciplinaire et chirurgical technique. Le pronostic de survie moyen à 5 ans des patients concernés se situe entre 23 et 55% maximum. La probabilité de survie est vraiment bonne pour les tumeurs au stade précoce. La cohorte de l'”International early lung cancer action program” (IELCAP) présente des courbes de survie pour les patients dépistés à un stade précoce de plus de 90% (survie à 10 ans !). Actuellement, le pronostic global du cancer du poumon n’est que de 15,1% de survie à 5 ans pour tous les stades, y compris le cancer du poumon. inopérable. Tous les efforts visant à améliorer ce chiffre doivent se concentrer sur l’amélioration de la prévention chez les jeunes et sur la réalisation systématique du dépistage chez les groupes à risque (fumeurs actifs ou anciens fumeurs, âge 50+, plus de 20 pack-years). Dans ce cas, la situation actuelle, qui est mauvaise avec seulement 15,1% de survie à 5 ans, peut être améliorée de manière significative.
Take-home-messages
- Seul un quart des patients atteints de cancer du poumon peut bénéficier d’un traitement chirurgical et donc d’une guérison potentielle.
- Pour détecter les stades précoces, il faut dépister le groupe à risque ; un programme de dépistage avec TDM à faible dose réduit significativement la mortalité.
- Le groupe à risque est celui des fumeurs actifs ou anciens fumeurs de plus de 50 ans ayant plus de 20 pack-years.
- Une connaissance approfondie des facteurs pronostiques individuels et généraux détermine le concept thérapeutique sur mesure, en particulier pour les cas devant être traités par chirurgie.
Prof. Othmar Schöb, docteur en médecine
Littérature :
- Ferlay J, et al : Eur J of Cancer 2013 ; 49 : 1374-1403.
- The national lung screening trial research team : Reduced Lung-Cancer Mortality with Low-Dose Computed Tomographic Screening. N Engl J Med 2011 ; 365 : 395-409.
- Altorki NK, et al : J Thor Cardiovasc Surg 2014 ; 147(2) : 754-764.
- Comité mixte américain sur le cancer. 7ème édition.
- Sahiner I, et al. : Quant Imaging Med Surg 2014 ; 4(3) : 195-206.
- Shingyoji M, et al : Ann Thorac Surg 2014, Aug 19. pii : S0003-4975(14)01277-6. doi : 10.1016/j.athoracsur.2014. 05.078. [Epub ahead of print].
- Teran MD, et al : J Thorac Dis 2014 ; 6(3) : 230-236.
- Vansteenkiste J, et al : Ann Onc 2014 ; 25 : 1462-1474.
- Riquet M, et al : Ann Thorac Surg 2014 ; 98 : 224-231.
- Ichinose J, et al. : Chest 2014 ; 146 ;(3) ; 644-649.
- Kuo SW, et al : J Thorac Cardiovesc Surg 2014 ; 148(4) : 1200-1207.
- Ito M, et al : Lungcan 2014 ; 85 : 270-275.
- Mediratta N, et al. : Chirurgie cardio-thoracique 2014 ; 46 : 267-273.
- Jaklitsch MT, et al : J Surg Oncol 2006 : 94(7) : 599-606.
- Trodella L, et al : Ann Oncol 2014 ; 15 : 389-398.
InFo ONKOLOGIE & HÉMATOLOGIE 2015 ; 3(1) : 13-17