Rapport de cas : Le patient, âgé de 56 ans, souffrait de maux de tête et de nausées depuis trois mois, ainsi que d’un ralentissement psychomoteur croissant. Cliniquement, il présentait une faiblesse de la branche buccale du nerf facial gauche, une hémiparésie légère à gauche accentuée par les bras et une négligence vers la gauche. Un singultus a été considéré comme un signe d’augmentation de la pression intracrânienne. Le médecin généraliste a initié un examen d’imagerie qui a révélé une volumineuse masse temporale droite.
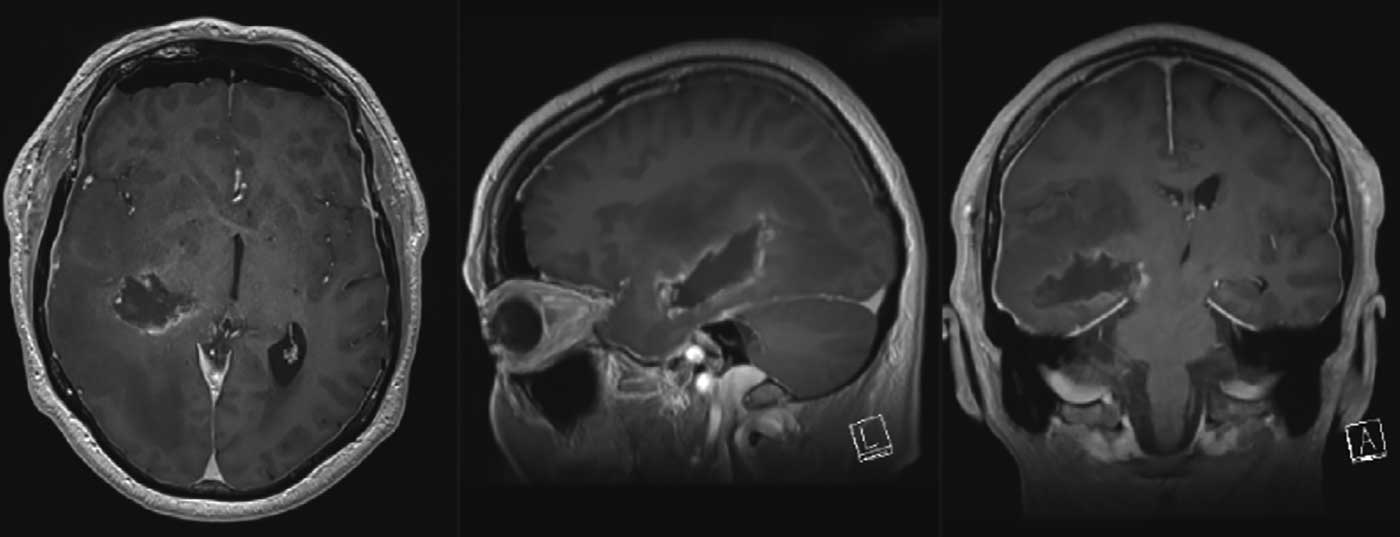
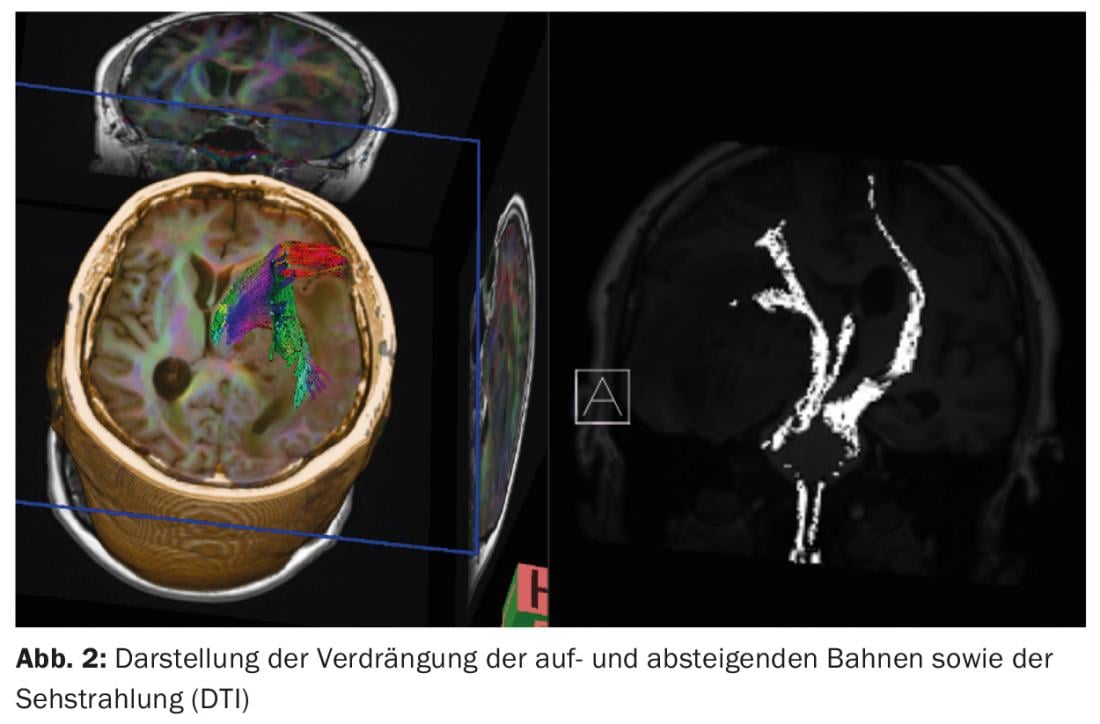
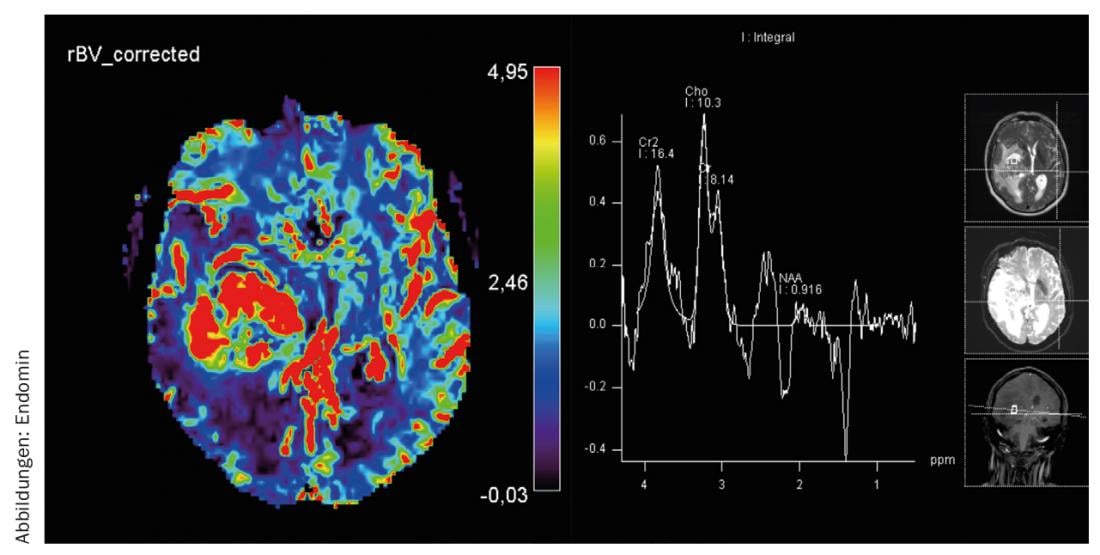
Diagnostic par IRM : il s’agit d’une masse inhomogène de 60×45×40 mm avec des parties solides et kystiques qui prennent le contraste en périphérie. En outre, un œdème périfocal important est mis en évidence. En fonction du déplacement de la ligne centrale de 12 mm, la trajectoire de la pyramide est fortement décalée vers la gauche. La tumeur atteint le thalamus et le mésencéphale, qui sont également comprimés et déplacés. La spectroscopie 1H et la perfusion RM sont en faveur de la présence d’un gliome malin (Fig. 1-3).

Opération : un traitement anti-œdémateux par dexaméthasone 16 mg/j a été initié lors de l’hospitalisation. Le patient est placé sur le dos, la tête est fixée en rotation vers la gauche et une IRM peropératoire est réalisée (Fig. 4) .

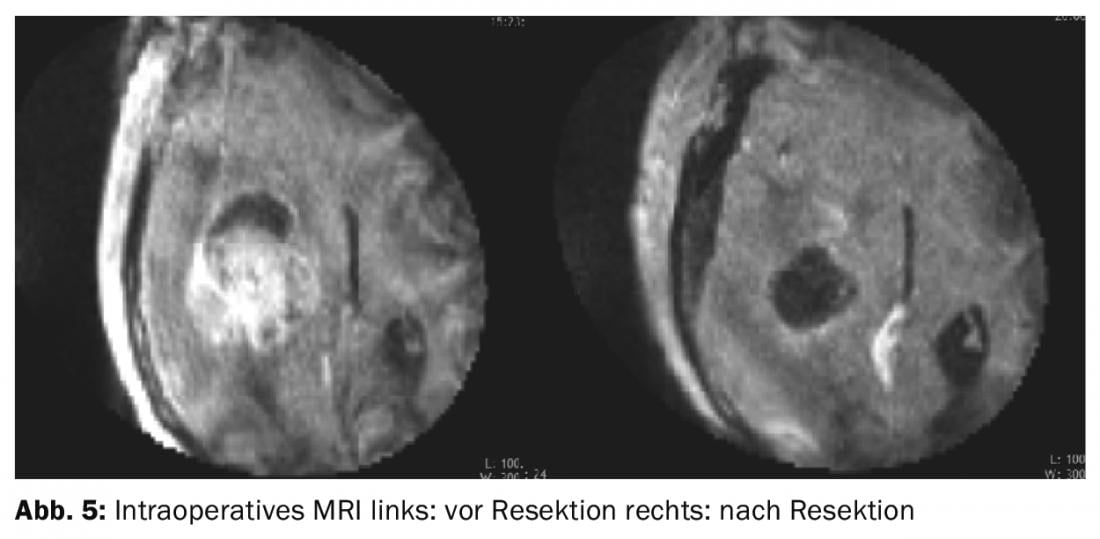
Un neuromonitoring peropératoire multimodal avec SEP, EEG et stimulation motrice transcorticale est mis en place afin de surveiller les voies descendantes et ascendantes. Une petite craniotomie temporobasale de 2×2 cm est délibérément pratiquée afin d’éviter une hernie du tissu cérébral par l’ouverture du crâne. Une préparation transcorticale en direction de la tumeur est alors effectuée à l’aide du microscope opératoire. Après avoir déchargé plusieurs kystes tumoraux, il est possible de gagner suffisamment d’espace pour identifier la limite entre la tumeur et le tissu cérébral sain et procéder à la résection le long de cette limite. Les zones de la cavité de résection non visibles au microscope ne sont pas représentées par rétraction du tissu cérébral sain, mais inspectées à l’aide de l’endoscope et le tissu pathologique est retiré sous contrôle endoscopique. Une IRM peropératoire renforcée par produit de contraste montre à la fin de l’opération la résection complète de toutes les parties de la tumeur qui prennent le contraste (Fig. 5).
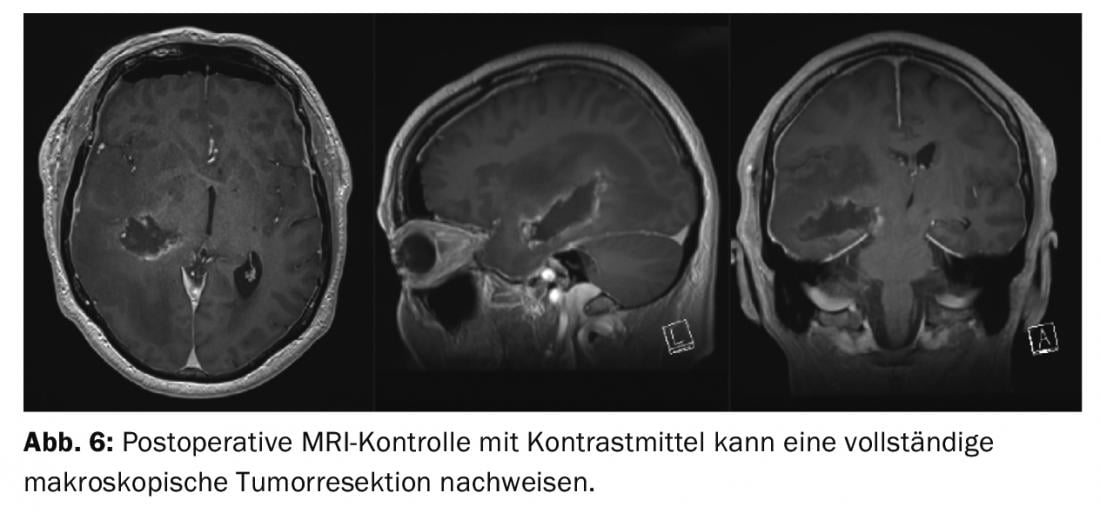
Évolution postopératoire : Le patient a pu être extubé sans problème et n’a pas présenté de nouveaux déficits neurologiques focaux. Par la suite, le ralentissement psychomoteur et l’hémiparésie se sont considérablement améliorés. Le traitement neuropathologique a révélé un glioblastome WHO IV°. Le patient a pu rentrer chez lui après quatre jours et reçoit une radiochimiothérapie combinée avec Temodal en ambulatoire (fig. 6).
Conclusion : les grosses lésions spatiales sont souvent réséquées par des craniotomies étendues, avec les lésions des tissus sains que cela implique. Les tumeurs profondes sont toutefois prédestinées à une approche chirurgicale mini-invasive (Fig. 7) .
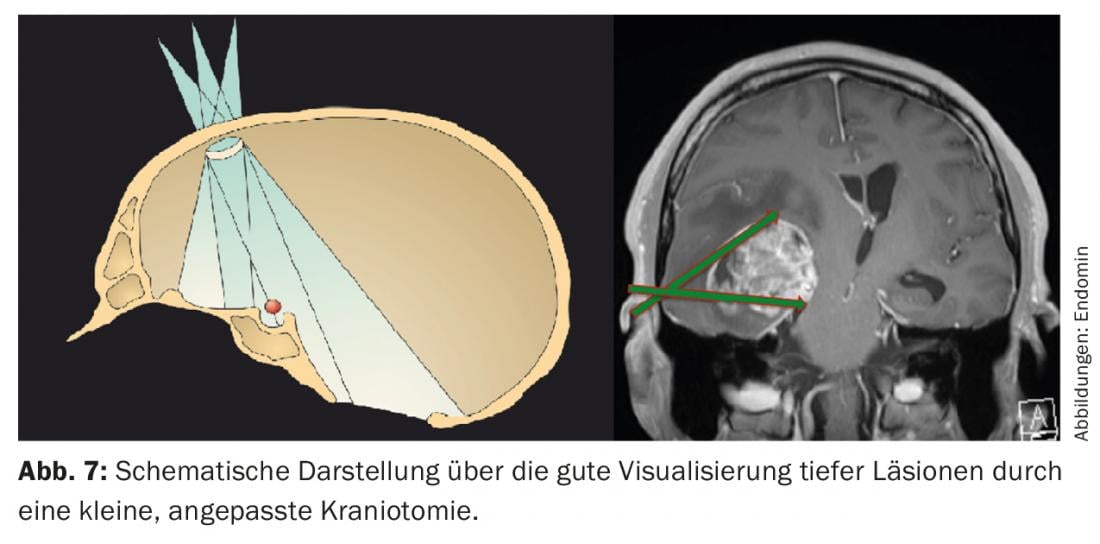
L’utilisation systématique de la neuronavigation, de l’endoscopie peropératoire, du monitoring neurophysiologique et de l’IRM peropératoire permet une radicalité chirurgicale maximale tout en minimisant le traumatisme opératoire grâce à une petite craniotomie en forme de trou de serrure. Ainsi, le tissu cérébral fonctionnellement intact dans la zone d’accès et autour de la lésion est préservé et n’est pas affecté.
InFo NEUROLOGIE & PSYCHIATRIE 2017 ; 15(1) : 30-31