Le traitement de la LAM et de la LAL est en pleine évolution. A l’avenir, elle se présentera de manière beaucoup plus différenciée. Certaines nouvelles options ont déjà été approuvées, d’autres sont en cours de développement ou en passe d’être utilisées en clinique. La maladie résiduelle minimale est de plus en plus importante pour le contrôle de la thérapie.
Le paysage thérapeutique de la LAM et de la LAL est en pleine évolution et sera beaucoup plus différencié à l’avenir. Dans l’aperçu suivant, il est surtout question des nouveaux développements qui ont déjà été autorisés par Swissmedic ou par d’autres autorités comme la FDA ou l’EMA, ou qui pourraient bientôt être disponibles pour les patients en Suisse dans le cadre d’études cliniques ou de programmes “early access”.
Dans le cas de la LAM, il s’agit de médicaments bien connus qui améliorent les options thérapeutiques grâce à de nouvelles formulations, ainsi que de possibilités immunothérapeutiques grâce à des antagonistes monoclonaux contre des cibles moléculaires pathogènes (FLT-3, IDH, BCL-2).
Dans la leucémie lymphoïde aiguë, le séquençage de nouvelle génération a permis d’identifier de nouveaux marqueurs pronostiques, des cibles et des sous-types. Sur le plan thérapeutique, des anticorps monoclonaux, des constructions d’anticorps bispécifiques et des thérapies chimériques à base de lymphocytes T récepteurs d’antigènes (cellules CAR-T) sont en cours de développement et, dans certains cas, déjà sur la voie de la pratique clinique quotidienne.
L’évaluation et le traitement de la maladie résiduelle minimale sont de plus en plus importants pour la gestion du traitement des leucémies aiguës.
Anticorps monoclonaux – gemtuzumab ozogamicin (Mylotarg®) dans la LAM
Le gemtuzumab ozogamicin (GO) est un anticorps monoclonal anti-CD33 lié de manière covalente à une toxine cellulaire très puissante (calichéamicine) qui, une fois internalisée, exerce son effet cytotoxique. Alors que le GO avait été approuvé par la FDA il y a plusieurs années sur la base de paramètres de substitution pour le traitement de la LAM chez les patients âgés, des doutes quant à son efficacité sont apparus par la suite sur la base de données d’études supplémentaires, tandis que des toxicités inattendues (foie) ont été observées, ce qui a conduit au retrait du médicament par le fabricant. Plus tard, une méta-analyse basée sur les données individuelles des patients de cinq essais randomisés contrôlés a démontré un avantage significatif en termes de survie globale (OR 0,90 ; p=0,01). Les bénéfices en termes de survie globale ont été les plus marqués, en particulier pour les patients classés dans le groupe de pronostic “bon” sur la base des aberrations cytogénétiques, avec une amélioration absolue de la survie globale à six ans de 20,7% (OR 0,47 ; p=0,0006). Pour les patients à risque intermédiaire, le bénéfice absolu était de 5,7% (OR 0,84 ; p=0,005), alors que pour les patients de la catégorie de risque la plus faible, il n’y avait pas de bénéfice absolu.
a été démontré par le GO [1].
Plusieurs études initiées par des universitaires ont permis de faire évoluer la posologie et la séquence d’administration, ce qui a permis d’améliorer la toxicité tout en conservant l’efficacité. Depuis 2017, GO est à nouveau approuvé par la FDA et, depuis quelques mois, par l’EMA en tant que traitement combiné avec la daunorubicine et la cytarabine (AraC) pour le traitement de première ligne de la LAM.
Nouvelle formulation de médicaments : CPX-351
CPX-351(nom commercial : Vyxeos®) est une association liposomale de cytarabine et de daunorubicine. Cette préparation a été comparée à un traitement d’induction classique “7+3” dans une étude randomisée de phase III portant sur 309 patients âgés de 60 à 75 ans atteints de LAM à haut risque. Le CPX-351 a montré des taux de rémission significativement plus élevés (CR/CRi 47,7% vs. 33,3%) et une amélioration de la survie globale (HR 0,69 ; p=0,003, médiane 9,6 vs. 6 mois) par rapport au traitement d’induction classique. Les taux de survie à 2 ans étaient respectivement de 31% et 12% [2]. Le CPX-351 a été approuvé par la FDA en juin 2017 pour le traitement de la LAM et a également reçu récemment une évaluation positive de la part du comité compétent de l’EMA, de sorte que l’on peut s’attendre à ce qu’il soit également approuvé prochainement. Le CPX-351 peut améliorer le traitement des patients âgés atteints de LAM à haut risque.
Nouveaux médicaments oraux pour la LAM
Inhibiteurs de tyrosine kinase (ITK) – Inhibition de FLT3 : chez environ 25% des patients atteints de LMA, une mutation peut être détectée dans la tyrosine kinase FLT3. L’ajout de midostaurine, un inhibiteur de FLT3 par voie orale, à la chimiothérapie classique permet d’améliorer de manière significative les résultats thérapeutiques d’une chimiothérapie standard. Dans l’étude internationale de phase III randomisée et contrôlée par placebo “RATIFY”, la midostaurine a amélioré de manière significative la survie globale médiane par rapport au bras placebo (74,7 mois contre 25,6, p=0,009) et la survie à 4 ans (51,4% contre 44,3% ; HR 0,78 ; p=0,009). Cet avantage a été démontré de manière cohérente dans les différents sous-groupes de mutations FLT3 (ratio allélique FLT3-ITD élevé ou faible, mutations FLT3-TKD) ainsi qu’avec et sans censure pour la transplantation de cellules souches hématopoïétiques allogéniques [3].
Le giltéritinib, un inhibiteur du FLT3 plus sélectif, a démontré une activité clinique prometteuse dans les récidives de LMA avec mutation du FLT3 [4]. Le groupe d’étude HOVON/SAKK prépare actuellement une étude qui sera menée en Suisse et qui comparera ces deux inhibiteurs FLT3 en première ligne de traitement, en complément de la chimiothérapie standard.
Inhibition de l’IDH2 : chez environ 12% des patients atteints de LMA, des mutations récurrentes de l’isocitrate déshydrogénase 2 (IDH2) peuvent être identifiées comme une cible pathogénique importante. L’énasidenib est un inhibiteur oral de l’IDH2 mutée. Dans une étude prospective à un seul bras, l’énasidenib en monothérapie s’est avéré remarquablement efficace chez les patients atteints de LMA récidivante ou réfractaire (LMA réf. / LMA récessive) et de mutations IDH2, avec un taux de réponse global de 39% et un taux de RC de 20% [5].
Sur la base de ces données, l’énasidenib est approuvé par la FDA depuis 2017. Actuellement, une étude internationale de phase III recrute des patients atteints de LMA pré-traitée avec des mutations IDH2 afin de comparer le traitement par l’énasidenib au traitement standard. De plus, une étude de phase III HOVON/SAKK est en préparation pour évaluer l’inhibition de l’IDH en traitement de première ligne en plus du traitement d’induction.
Thérapies combinées avec l’inhibiteur de BCL-2 vénétoclax chez les patients âgés : Pour les patients âgés qui ne se qualifient pas pour un traitement d’induction intensif, il existe, en plus du traitement purement supportif, la cytarabine à faible dose ou les agents hypométhylants azacitidine et décitabine, avec des taux de réponse globaux – selon les études – de l’ordre de 50% (taux CR/CRi de 7 à 47%) et des durées de survie médianes comprises entre 5 et 24 mois. Plusieurs études prospectives à un seul bras ont testé l’association du vénétoclax, un inhibiteur de BCL-2, avec de faibles doses de cytarabine ou d’agents hypométhylants. Ces études ont révélé des taux de rémission prometteurs allant jusqu’à 60% pour les différentes combinaisons, ainsi que des temps de réponse plus longs en comparaison historique et une tolérance satisfaisante [6–8].
Importance croissante de la maladie résiduelle minimale (MRD)
Une analyse rétrospective de plusieurs études HOVON/SAKK, publiée en bonne place, a montré que l’absence de détection d’une MRD (par cytométrie en flux ou par génétique moléculaire) après un traitement d’induction était associée à une amélioration de l’absence de récidive. La survie sans récidive la plus longue a été observée chez les patients chez lesquels aucune maladie résiduelle minimale n’a été détectée par cytométrie en flux ou par PCR [9]. Il en découle le concept de poser l’indication d’une transplantation de cellules souches sanguines allogéniques en tenant compte du statut MRD en plus de la classification génétique traditionnelle des risques. Cette question est étudiée dans le cadre d’une étude HOVON/SAKK, dont le recrutement des patients est terminé.
Nouveaux marqueurs pronostiques et cibles pour la LAL
Dans un peu plus de 80% des patients présentant une Philadelphia pos. B-ALL (Ph+ ALL), on trouve également une mutation/délétion du facteur de transcription IKZF1, ce qui est associé à une résistance au traitement et à une augmentation des récidives. Les mutations IKZF2 sont caractéristiques des LAL B hypodiploïdes profondes et les altérations IKZF3 sont présentes dans la plupart des LAL presque haploïdes.
Les ALL “Ph-like” ou “BCR-ABL1 like” présentent un profil d’expression génique comparable à celui des ALL Ph+, mais ne présentent pas de mutation classique de BCR-ABL. 20 à 30 % de tous les patients atteints de B-ALL peuvent être classés dans ce groupe. Ils ont une PFS et un OS significativement plus bas de 20-25% vs. environ 50-55% [10]. Près de la moitié des patients atteints de l’AL “Ph-like” présentent un réarrangement du “cytokine receptor-like factor 2” (CRLF2). De plus, chez environ 50% des patients atteints d’une altération du CRLF2, on trouve une mutation avec activation de la Janus kinase [11]. Chez les patients sans réarrangement du CRLF2, des fusions avec des tyrosines kinases ont été mises en évidence.
En plus de l’ALL “Ph-like”, l’ALL “early T precursor” (ETP-ALL) a été ajoutée en tant qu’entité distincte dans la classification 2016 de l’OMS, sur la base d’un profil d’immunophénotypage et d’expression génétique distinct. Environ 35% des T-ALL peuvent être attribués à cette entité, qui peut être associée à un pronostic légèrement moins favorable.
Des mutations d’activation dans la voie de signalisation NOTCH1 peuvent être trouvées chez plus de 50% des patients atteints de T-ALL et sont associées à un meilleur pronostic, alors que les délétions PTEN et les mutations NRAS sont associées à un moins bon pronostic.
Dans le domaine de la LAL hypodiploïde, deux sous-types ont été identifiés : un groupe avec un jeu de chromosomes presque haploïde (24-31 chromosomes), qui présente des mutations de la voie de signalisation de la tyrosine kinase et du RAS dans environ 71% ou des mutations de l’IKZF3 dans environ 13%, et un groupe avec une LAL faiblement hypodiploïde (32-39 chromosomes) avec des altérations de TP53 (91%), IKZF2 (53%) et RB1 (41%).
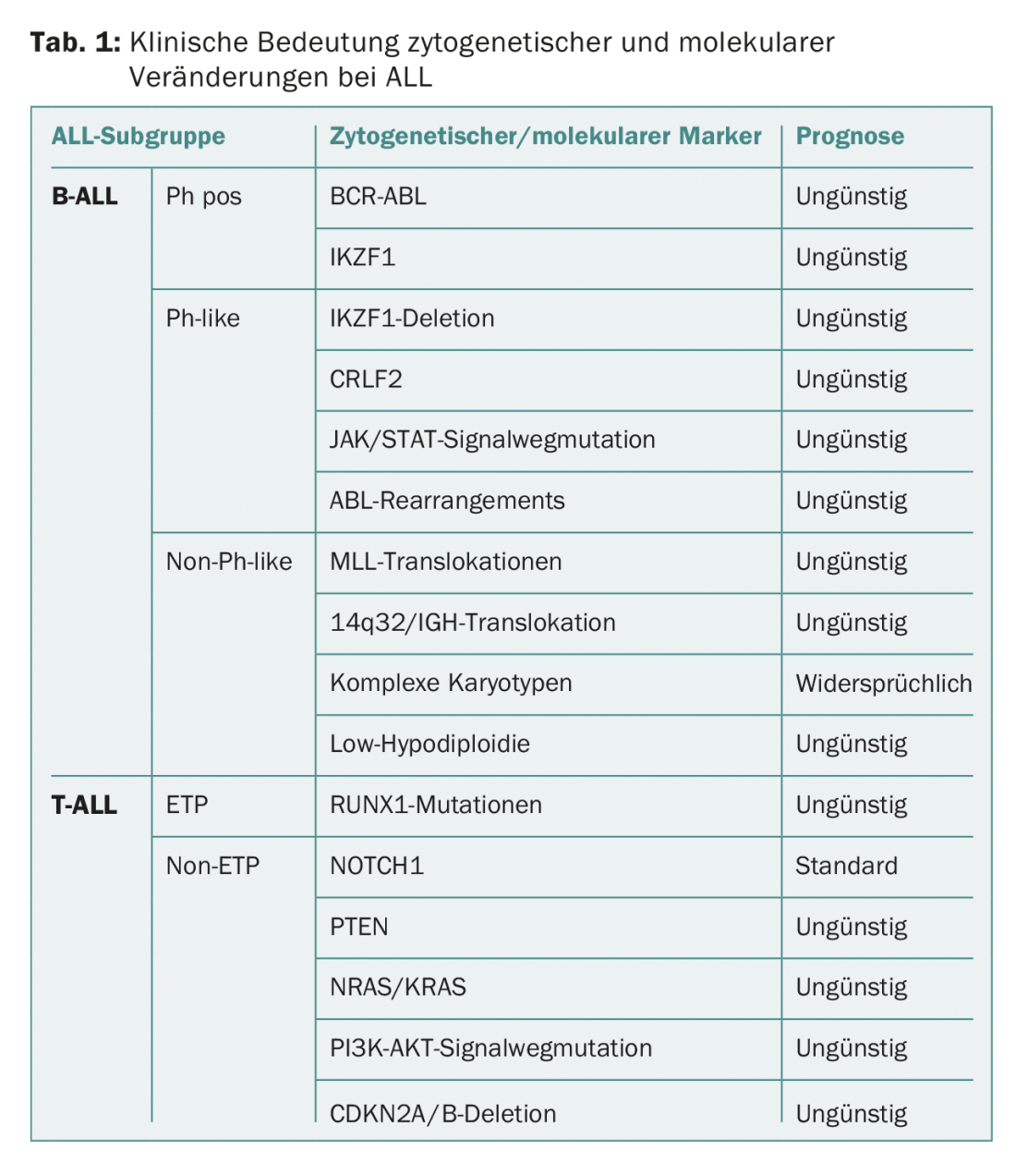
Le tableau 1 donne un aperçu de la signification clinique des modifications cytogénétiques et moléculaires dans la LAL.
Maladie résiduelle minimale
La détection précoce d’une absence de réponse à la chimiothérapie ou d’une récidive est possible grâce à la détermination de la MRD. Chez les patients atteints de LAL, cela se fait par des méthodes PCR et la détection de gènes clonaux réarrangés codant pour des immunoglobulines ou des récepteurs de cellules T, ou la détection d’un phénotype spécifique à la leucémie via la cytométrie de flux multiparamètre. Un événement positif à une fréquence de <10-4 est reconnu comme une MRD négative et un niveau de MRD de >10-3 comme une MRD positive. L’obtention d’une MRD négative après un traitement d’induction et de consolidation est un facteur pronostique important qui, à l’avenir, complétera ou remplacera probablement les facteurs cliniques et cytogénétiques traditionnels.
Anticorps
CD20 : dans 30 à 40% des cas de B-ALL, on observe une expression de CD20. L’ajout du rituximab à la chimiothérapie standard entraîne une négativité plus élevée et plus rapide de la MRD après le traitement d’induction et le traitement de consolidation. Il est encourageant de constater que cela permet d’obtenir une amélioration de la survie sans maladie et de la survie globale [12,13].
CD22 : étant donné que pratiquement toutes les B-ALL expriment CD22, il s’agit d’une cible idéale. L’inotuzumab ozogamicin (IO) est un conjugué d’un anticorps CD22 avec la calichéamicine qui, une fois lié à l’antigène, est internalisé et provoque des cassures de l’ADN. Des études cliniques ont montré un avantage de survie avec cette substance par rapport aux thérapies basées sur la chimiothérapie en situation de récidive [14]. L’IO est actuellement à l’étude dans le traitement de première ligne. D’autres anticorps anti-CD22 sont également testés dans le cadre d’études cliniques.
Blinatumomab : il s’agit d’une construction d’anticorps bispécifique qui se lie simultanément aux cellules T CD3+ normales et aux cellules B-ALL CD19+, entraînant une réaction cytotoxique médiée par les cellules T contre les cellules B. Le blinatumomab est un anticorps qui se lie aux cellules T CD3+ normales et aux cellules B-ALL CD19+. Les premiers essais de blinatumomab chez l’adulte ont été réalisés dans le but d’éliminer la maladie résiduelle minimale. Dans le cadre d’un suivi à long terme, douze des vingt patients sont restés en RC, neuf patients de cette étude ayant reçu une TCSH allogénique de consolidation. Il convient de noter que les patients non transplantés ont présenté un résultat comparable. Le blinatumomab a été comparé à la chimiothérapie dans une étude portant sur des patients fortement prétraités atteints de B-ALL récidivante. Des différences significatives ont été observées avec un CR/CRi de 44% vs 25% et une survie globale médiane de 7,7 vs 4,0 mois [15].
CD38 : une autre cible prometteuse dans la T-ALL est le CD38, car les blastes T-ALL présentent une expression élevée et stable du CD38, alors que les cellules myéloïdes et lymphatiques normales ne présentent qu’une faible expression. Le daratumumab est un anticorps monoclonal CD38 qui présente un bon profil d’efficacité et de sécurité dans le myélome multiple. Les modèles de xénogreffes et les observations de cas individuels ont montré un effet convaincant [16].
Cellules CAR-T
Une nouvelle option prometteuse est l’utilisation de ce que l’on appelle les CAR-T cells. Il s’agit de cellules T propres au patient (autologues) qui ont été modifiées ex vivo par des moyens de génie génétique afin de contenir un récepteur de cellules T chimérique. Grâce à celui-ci, ils se lient aux antigènes tumoraux (par exemple, CD 19 sur les cellules B) et provoquent ainsi l’élimination sélective des cellules portant cet antigène. Actuellement, seules les cellules CAR-T dirigées contre CD19 sont autorisées par les autorités réglementaires (FDA) pour le traitement de la LAL infantile réfractaire et des lymphomes à cellules B réfractaires. Les études d’enregistrement correspondantes pour la LAL ont montré un taux de RC de 67-91% avec une négativité de la MRD de 60-81% des patients en rémission complète. Des toxicités pertinentes (syndrome de libération de cytokines, neurotoxicité) doivent être prises en compte lors du traitement avec des cellules T CD19-CAR. Après le traitement d’une LAL réfractaire avec des cellules CAR-T ciblées sur CD19, des récidives CD19 négatives surviennent chez environ 20% des patients et sont difficiles à traiter. L’intérêt d’une TCSH allogénique de consolidation après un traitement par cellules CAR-T fait l’objet de controverses.
Résumé
Après une longue période sans innovation efficace dans le traitement des leucémies aiguës, nous sommes maintenant à l’aube d’une nouvelle ère avec plusieurs nouvelles options thérapeutiques, notamment les immunothérapies, qui promettent une amélioration significative du pronostic et dont certaines ont déjà été démontrées dans des études. Dans le cas de la LAM, de nouvelles substances, appelées “petites molécules”, sont en outre testées dans le cadre d’études ou sont déjà utilisées en clinique dans certains cas. Il est de plus en plus clair qu’il est important de déterminer la MRD au cours de l’évolution et, si elle est encore présente, d’éliminer la maladie résiduelle en tant que marqueur pronostique.
Messages Take-Home
- Le paysage thérapeutique de la leucémie myéloïde aiguë (LMA) est de plus en plus différencié. Des avantages en termes de survie ont été démontrés pour une nouvelle formulation liposomale des agents de chimiothérapie classiques, la renaissance du gemtuzumab ozogamicin et de nouvelles combinaisons d’inhibiteurs de tyrosine kinase (ITK) avec la chimiothérapie conventionnelle.
- L’analyse moléculaire et le suivi de la maladie résiduelle minimale (MRD) deviennent de plus en plus importants et pertinents pour les décisions thérapeutiques dans la LAM.
- L’utilisation de la détermination de la MRD dans les algorithmes thérapeutiques dans tous les sous-types de leucémie lymphoïde aiguë (LLA) est de plus en plus courante et pourrait remplacer la plupart des facteurs pronostiques dans le futur.
- De nombreux nouveaux traitements à base d’anticorps sont en train de s’établir dans les situations de récidive de la LAL et sont également étudiés dans le cadre d’essais cliniques en première ligne de traitement. La thérapie cellulaire CAR-T est une nouvelle option sur le point d’être utilisée en routine.
Littérature :
- Hills RK, et al : Addition of gemtuzumab ozogamicin to induction chemotherapy in adult patients with acute myeloid leukaemia : a meta-analysis of individual patient data from randomised controlled trials. Lancet Oncol 2014 ; 15(9) : 986-996.
- Lancet JE, et al : CPX-351 (cytarabine et daunorubicine) Liposome for Injection Versus Conventional Cytarabine Plus Daunorubicin in Older Patients With Newly Diagnosed Secondary Acute Myeloid Leukemia. J Clin Oncol 2018 ; 38(26) : 2684-2692.
- Stone RM, et al : Midostaurin plus chimiothérapie pour la leucémie myéloïde aiguë avec une mutation FLT3. N Engl J Med 2017 ; 377(5) : 454-464.
- Perl AE, et al : Inhibition sélective du FLT3 par le giltéritinib dans la leucémie myéloïde aiguë en rechute ou réfractaire : une étude multicentrique, de première intention, en ouvert et de phase 1-2. Lancet Oncol 2017 ; 18(8) : 1061-1075.
- Stein EM, et al. : Enasidenib in mutant IDH2 relapsed or refractory acute myeloid leukemia. Blood 2017 ; 130(6) : 722-731.
- DiNardo C, et al. : Sécurité et efficacité préliminaire du vénétoclax avec la décitabine ou l’azacitidine chez les patients âgés atteints de leucémie myéloïde aiguë non traitée auparavant : étude non randomisée, en ouvert, phase 1b. Lancet Oncol 2018 ; 19(2) : 216-228.
- DiNardo C, et al : Durable Response with Venetoclax in Combination with Decitabine or Azacitidine in Elderly Patients with Acute Myeloid Leukemia. Congrès de l’Association européenne d’hématologie 2018 ; Abstract S1563.
- Wei A, et al : Étude de phase 1/2 du vénétoclax avec de la cytarabine à faible dose chez des patients âgés naïfs de traitement atteints de leucémie myéloïde aiguë et inaptes à une chimiothérapie intensive : résultats à 1 an. ASH Annual Meeting and Exposition 2017 ; Abstract 890.
- Jongen-Lavrencic M, et al : Molecular Minimal Residual Disease in Acute Myeloid Leukemia. N Engl J Med 2018 ; 378(13) : 1189-1199.
- Roberts KG, et al : Fréquence élevée et mauvais résultat de la leucémie lymphoblastique aiguë à chromosome Philadelphie chez les adultes. J ClinOncol 2017 ; 35(4) : 394-401.
- Herold T, et al : Les adultes atteints de leucémie lymphoblastique aiguë à chromosome Philadelphie ont souvent des mutations IGH-CRLF2 et JAK2, la persistance d’une maladie résiduelle minimale et un mauvais pronostic. Haematologica 2017 ; 102(1) : 130-138.
- Thomas DA, et al : La chimio-immunothérapie avec un régime modifié hyper-CVAD et rituximab améliore les résultats dans la leucémie lymphoblastique aiguë à chromosome B précurseur négatif de novo Philadelphie. JCO 2010 ; 28 : 3880.
- Maury S, et al : Addition of Rituximab Improves the Outcome of Adult Patients with CD20-Positive, Ph-Negative, B-Cell Precursor Acute Lymphoblastic Leukemia (BCP-ALL) : Results of the Randomized Graall-R 2005 Study. Réunion ASH 2015 ; 126 : 1 .
- Kantarjian HM, et al : Inotuzumab ozogamicin versus standard therapy for acute lymphoblastic leukemia. N Engl J Med 2016 ; 375(8) : 740-753.
- Kantarjian HM, et al : Blinatumomab versus Chemotherapy for Advanced Acute Lymphoblastic Leukemia. N Engl J Med 2017 Mar 2 ; 376(9) : 836-847.
- Bride KL, et al : Preclinical efficacy of daratumumab in T-cell acute lymphoblastic leukemia. Blood 2018 Mar 1 ; 131(9) : 995-999.
InFo ONKOLOGIE & HÉMATOLOGIE 2018 ; 32-35