L’hidradénite suppurée (HS) a une étiopathogénie multifactorielle et s’accompagne d’une altération importante de la qualité de vie. Les résultats empiriques d’une expression accrue de cytokines inflammatoires suggèrent une origine immunologique de cette maladie inflammatoire récurrente de la peau. L’éventail des traitements médicamenteux disponibles à ce jour est limité. Parallèlement à la poursuite des recherches sur les bases immunopathologiques, différentes substances actives sont testées dans le cadre d’études cliniques.
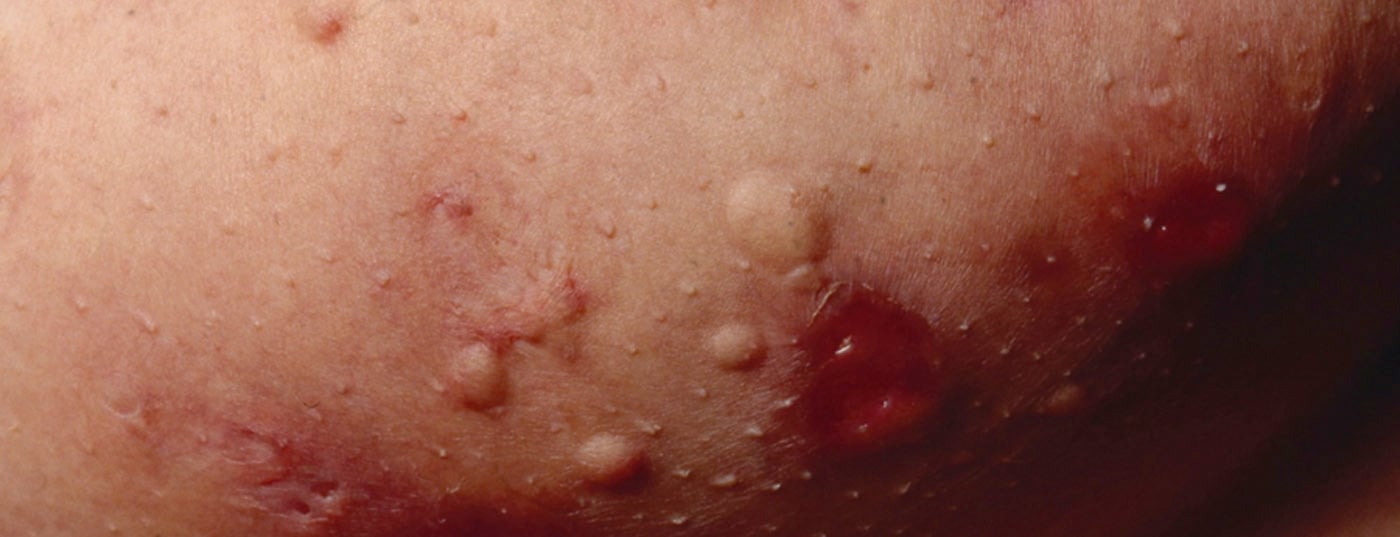
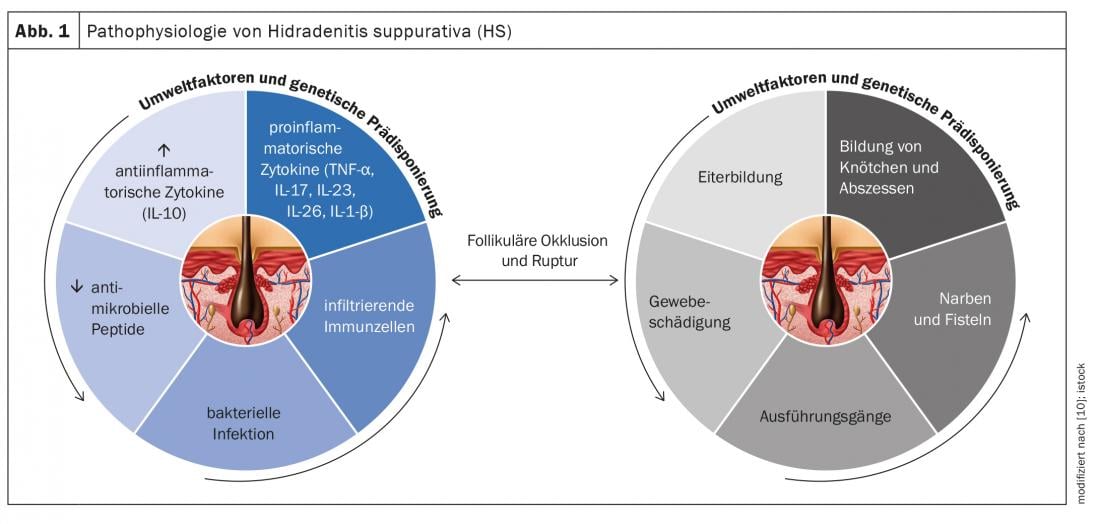
L’hidradénite suppurée (HS) – également appelée “acné inversa” – est une maladie inflammatoire chronique des follicules pileux qui provoque des fistules chroniques, des abcès et des cicatrices dans les régions axillaire, inguinale et périanale [1]. On pense qu’il s’agit d’une pathogenèse multifactorielle, mais de nombreuses questions restent en suspens [2]. Selon les connaissances actuelles, l’HS commence par une occlusion et une dilatation dans le follicule pileux, ce qui entraîne une rupture et une réaction inflammatoire et se traduit par une inflammation chronique avec des canaux de fistule [3,4]. De nombreuses cytokines sont impliquées dans la réaction inflammatoire d’origine multifactorielle. Outre les facteurs génétiques prédisposants, le tabagisme et l’obésité contribuent au développement de la maladie (Fig. 1) [11]. On distingue différents degrés de gravité en fonction de l’expression clinique. Outre la classification de Hurley [5], Zouboulis et al. 2017, a publié l'”International Hidradenitis Suppurativa Severity Score System” (score IHS4) – un outil validé utilisable dans la pratique clinique quotidienne pour évaluer la gravité de l’HS(tableau 1) [6,9].
Besoin d’autres options de traitement médicamenteux
Les options de traitement de l’HS sont limitées. Il existe différentes approches pour contrôler l’inflammation et réduire la gravité des manifestations. Les crèmes et solutions antiseptiques et antibiotiques ainsi que les antibiotiques sous forme de comprimés peuvent réduire les germes sur la peau et contribuer ainsi à améliorer la qualité de vie des patients. Le médicament biologique adalimumab (Humira®), un bloqueur du facteur de nécrose tumorale (TNF)-α, est autorisé en Suisse depuis 2016 pour le traitement de l’HS aux stades intermédiaire et avancé [7]. En outre, diverses thérapies pharmacologiques sont utilisées hors étiquette. Les autres options de traitement comprennent des procédures de médecine laser et une excision chirurgicale des fistules avec ou sans couverture plastique des défauts.

Physiopathologie de l’HS : aperçu des résultats immunopathologiques
Afin d’élargir l’éventail des traitements médicamenteux, la recherche sur les bases physiopathologiques de l’HS a fait l’objet d’une attention croissante de la part des scientifiques au cours des dernières années. Le rôle de différentes cytokines pro-inflammatoires est ainsi analysé au niveau moléculaire [2]. Voici les résultats d’une analyse secondaire publiée en 2020 dans l’International Journal of Molecular Sciences, avec une intégration des résultats immunopathologiques chez les patients HS [2] :
TNF-α et IFN-γ : les taux de TNF-α hautement régulés présentent une corrélation positive avec la sévérité de l’HS. Le TNF-α augmente le ratio Th17:Treg*, ce qui se traduit par une production excessive de cellules Th17 et, en conséquence, des cytokines IL-17 et IL-22. Le TNF-α induit l’expression des chimiokines CXCL8, CXCL11, CCL20, et CCL2 dans les kératinocytes. Ceux-ci sont responsables du recrutement des neutrophiles, des lymphocytes T et des monocytes dans la peau. Globalement, ces signaux entraînent une infiltration massive de cellules immunitaires dans les tissus endommagés. Par conséquent, les lésions d’HS sont caractérisées par des granulocytes, des lymphocytes T, des lymphocytes B et des monocytes qui se différencient en macrophages et en cellules dendritiques. L’IL-23 et l’IL-12 aident les cellules Th17 et Th1 à produire les cytokines IL17 et IFN-γ.
*Treg=cellules T régulatrices
IL-1 : les résultats empiriques montrent que les processus médiés par l’IL-1 sont hautement régulés dans l’HS et contribuent à l’infiltration cellulaire et aux dommages tissulaires. La famille des cytokines IL-1 comprend 7 cytokines ayant une activité pro-inflammatoire, dont IL-1α, IL-1β, IL-18, IL-33, IL-36α, IL-36β, et IL-36γ. L’IL-1α est fortement pro-inflammatoire et induit une cascade de médiateurs inflammatoires tels que le TNF et l’IL-18. Plusieurs résultats empiriques indiquent que les kératinocytes produisent des niveaux élevés d’IL-1. On suppose qu’il existe un mécanisme de rétroaction positive entre l’IL-1 et l’IL-17. L’IL-36 est impliquée dans l’activation des inflammasomes ainsi que des signaux pro-inflammatoires par l’activation du facteur nucléaire-kB (NF-κB) et de la mitogen-activated protein kinase (MAPK). Des taux élevés d’IL-36α, d’IL-36β, et d’IL-36γ ont été détectés dans le sérum et la peau lésionnelle des patients atteints d’HS.
IL-6 : les résultats concernant les associations entre IL-6 et HS sont controversés. Alors que certaines études ont montré une augmentation de l’expression de l’ARNm de l’IL-6 dans les lésions des patients atteints d’HS par rapport à la peau non lésionnelle, d’autres études ont montré des niveaux réduits d’IL-6 dans les lésions d’HS par rapport à la peau non lésionnelle. L’IL-6 est une cytokine pléotropique qui joue un rôle clé dans toute une série de processus immunitaires. En combinaison avec le TGF-β, l’IL-1β, et l’IL-23, l’IL-6 déclenche le développement des cellules Th17 et inhibe le développement des cellules T régulatrices induites par le TGF-β.
IL-10 : Il a été observé que dans l’HS, non seulement les taux de cytokines pro-inflammatoires sont élevés, mais que le médiateur anti-inflammatoire IL-10 est également surexprimé dans la peau lésionnelle des patients atteints d’HS. Une explication possible est que la régulation à la hausse de l’IL-10 immunosuppressive est une réaction compensatoire aux processus inflammatoires et à la prolifération des microbes commensaux dans la peau. Cela supprime les niveaux d’IL-22 et d’IL-17 dans la peau lésionnelle. Des études supplémentaires sont nécessaires pour en savoir plus sur le rôle de cette cytokine anti-inflammatoire dans la pathogenèse de l’HS.
IL-17/IL-23 : Dans le derme papillaire et réticulaire des lésions d’HS, il y a un grand nombre de cellules Th17 qui pourraient être impliquées dans l’inflammation neutrophile excessive et le drainage purulent. Une surexpression de l’IL-17 a été observée dans la peau lésionnelle, périlésionnelle et non lésionnelle de patients atteints d’HS, ce qui indique une inflammation subclinique précédant la formation de lésions actives. Des taux élevés d’IL-17 ont également été détectés dans le sérum de patients atteints d’HS. Dans les kératinocytes, l’IL-17 induit l’expression de plusieurs protéines (LL37/cathélicidine, S100A7, S100A8, et S100A9), qui sont augmentées dans la peau lésionnelle et dans le sérum des patients HS, mais pas dans la peau périlésionnelle. Ces protéines sont impliquées dans la prolifération des kératinocytes et dans l’expression de cytokines et de chimiokines pro-inflammatoires. Dans l’ensemble, les résultats suggèrent que l’axe IL-23/IL-17 est largement impliqué dans la pathogenèse de l’HS.

Parallèlement à la recherche sur les mécanismes pathologiques au niveau moléculaire, des essais cliniques sont en cours pour évaluer l’efficacité de nouveaux traitements anti-inflammatoires [8]. Caroline Hilbring, médecin-assistante à l’Institut de recherche sur les soins en dermatologie et dans les professions de santé, à l’Hôpital universitaire de Hambourg (Allemagne) (encadré) [9].
Congrès : Réunion DDG 2021
Littérature :
- Iesalnieks I, Dornseifer U : Acné inversa (hidradénite suppurée). Chirurgien 2020 ; 91 : 293-300.
- Del Duca E, et al. : Cytokine Pathways and Investigational Target Therapies in Hidradenitis Suppurativa (Voies des cytokines et thérapies ciblées d’investigation dans l’hidradénite suppurée). Int J Mol Sci 2020 ; 21 : 8436 ; doi:10.3390/ijms21228436
- Vossen ARJV, van der Zee HH, Prens EP : Hidradénite suppurative : une revue systématique intégrant les voies inflammatoires dans un modèle pathogénique cohérent. Front Immunol 2018 ; 9 : 2965.
- Van der Zee H : Les produits biologiques dans le traitement de l’hidradénite suppurative. Hessel van der Zee, MD, PhD. EADVVirtual Highlights, 2020.
- https://2020.eadvhighlights.com (dernier appel 14.09.2021)
- Revuz J : Hidradénite suppurée. J Eur Acad Dermatol Venereol 2009 ; 23 : 985-998.
- Zouboulis C, et al. : Développement et validation de l’International Hidradenitis Sup-purativa Severity Score System (IHS4), un nouveau système de notation dynamique pour évaluer la sévérité de l’HS. Br J Dermatol 2017 ; 177 : 1401-1409.
- Information sur les médicaments, www.swissmedicinfo.ch, (dernière consultation 14.09.2021)
- Schuch A, Absmaier-Kijak M, Volz T : Acne inversa/Hidradenitis suppurativa – De la pathogenèse au traitement. Dermatologie actuelle 2019 ; 45(06) : 277-287.
- Hilbring C, Kirsten N, Augustin M : Série de cas de 10 patients atteints d’acné inversa : utilisation de l’ixe-kizumab en cas de perte d’efficacité secondaire de l’adalimumab. FV01/08, réunion de la DDG, 15.04.2021.
- Scala E, et al. : Hidradénite suppurative : où nous sommes et où nous allons. Cells 2021 ; 10(8), 2094 ; https://doi.org/10.3390/cells10082094
- Wolk K, Join-Lambert, O, Sabat, R : Etiologie et pathogenèse de l’hidradénite suppurée. Br J Dermatol 2020 ; 183(6) : 999-1010.
DERMATOLOGIE PRATIQUE 2021 ; 31(6) : 39-40